全肠内营养对儿童克罗恩病诱导缓解疗效研究
罗优优 方优红 余金丹 徐罗佳 孙明芳 成琦 陈洁
(浙江大学医学院附属儿童医院消化科/国家儿童健康与疾病临床医学研究中心,浙江杭州 310052)
全肠内营养(exclusive enteral nutrition,EEN)是指回避常规饮食,将肠内营养制剂作为唯一的饮食来源[1]。近年EEN分别被欧洲克罗恩病和结肠炎组织/欧洲儿童胃肠病、肝病和营养协会、中华医学会儿科学分会消化学组及临床营养学组先后推荐为轻中度儿童克罗恩病(Crohn's disease,CD)诱导缓解的一线治疗方案[1-3]。EEN能抑制炎症反应,改善肠上皮细胞功能,促进肠黏膜屏障的形成[4]。与传统的激素诱导缓解相比,EEN具有类似疗效,且对儿童生长影响较小[5-6]。目前国外关于EEN对儿童CD诱导缓解的疗效已有较多报道[6-8],而检索国内文献,仅有1篇小样本(其中EEN治疗患儿25例)研究,比较了EEN和激素对儿童CD临床及肠道组织学诱导缓解的疗效,提出EEN具有更优的黏膜愈合率[9]。该研究样本量小,且未对儿童的营养状况及生长进行总结。本研究回顾总结近8年本中心接受EEN治疗的儿童CD共62例,观察EEN对CD患儿短期临床结局及生长发育的影响,为儿童CD的EEN治疗提供理论基础。
1 资料与方法
1.1 研究对象
回顾性收集2013年3月至2021年8月在本中心接受EEN治疗的CD患儿的临床资料。纳入标准为:根据病史、实验室检查、内镜及影像学检查,符合《儿童炎症性肠病诊断和治疗专家共识》中CD的诊断标准[1];年龄小于18岁;接受EEN治疗的患儿。排除标准为:治疗初始8周联用美沙拉嗪、激素或生物制剂;合并严重心肺疾病;存在单基因缺陷者;临床资料不完整者。本研究已获得浙江大学医学院附属儿童医院伦理委员会批准(2021-IRB-260)。
1.2 资料收集
收集患儿的临床资料,包括性别、起病年龄、确诊年龄、初诊时病程、巴黎分型[10]、药物史,随访8周时患儿的身高、体重、儿童CD活动指数(pediatric Crohn's disease activity index,PCDAI)、CD内镜严重程度指数(Crohn's disease endoscopic index of severity,CDEIS),以及疾病活动相关实验室指标,包括C反应蛋白、红细胞沉降率、血清白蛋白。
1.3 评分标准及肠内营养给予量标准
临床疾病活动性评估采用PCDAI[11]。将PCDAI<10.0定义为缓解期,10.0~27.5为轻度活动期,30.0~37.5为中度活动期,40.0~100.0为重度活动期[1];临床应答定义为PCDAI下降≥15或终点PCDAI<10;复发定义为经8周EEN诱导缓解后PCDAI再次≥10。内镜下疾病活动度评估采用CDEIS。将CDEIS≤3定义为黏膜愈合(mucosal healing,MH);CDEIS下 降>5定 义 为 内 镜 下应答[12]。
儿童的生长发育评分标准为年龄别身高的Z评分(height for age Z score,HAZ)和年龄别体重指数Z评 分(body mass index for age Z score,BMIAZ)。上述Z评分采用WHO AnthroPlus v.1.0.4软件计算得出[13]。
肠内营养制剂给予量采用2013年中国居民膳食指南标准中相应年龄儿童按轻度体力活动水平的标准量[1,14]。
1.4 统计学分析
采用R软件对数据进行统计学分析,正态分布计量资料采用均数±标准差(±s)表示,治疗前后比较采用配对t检验;非正态分布的计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,治疗前后比较采用Wilcoxon符号秩和检验。计数资料采用百分率(%)表示,组间比较采用卡方检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 患儿的一般临床资料
2013年3月至2021年8月在本中心确诊CD患儿共172例,其中给予初始EEN治疗患儿67例,排除失访3例,联合生物制剂治疗2例,最终纳入62例。其中男39例,女23例;起病年龄(11.0±3.1)岁,确诊年龄(11.9±3.0)岁,确诊年龄<10岁16例(26%),确诊年龄在10~17岁46例(74%);病程3.8(2.2,9.1)个月。
生长发育:21例(34%)患儿BMIAZ<-2,其中BMIAZ<-3者11例;3例(5%)患儿BMIAZ>2,38例(61%)患儿BMIAZ介于-2~2。
巴黎分型:病变部位以发生在回结肠+小肠占多数(18/62,29%),其次为回结肠+小肠+上消化道12例(19%),小肠10例(16%),上消化道+小肠9例(14.5%),回盲部、回盲部+小肠及回结肠各3例(5%),回盲部+小肠+上消化道2例(3%),回盲部+上消化道及回结肠+上消化道各1例(2%);合并肛周病变者4例(6%);疾病分型中,非狭窄非穿透型为主(60/62,97%),狭窄型及穿透型各1例(2%)。
EEN配方及给予途径:除4例(6%)患儿采用含58%中链甘油三酯多肽配方肠内营养粉(雀巢公司)外,其余均采用整蛋白配方肠内营养粉(其中8例应用雀巢公司产品,50例应用雅培公司产品)进行治疗。所有患儿均采用口服治疗,每日总量(1 849±322)mL,分5~8次完成。
既往用药及合并用药:1例患儿在EEN前曾进行激素治疗;1例患儿既往曾进行美沙拉嗪治疗,其余患儿(60/62,97%)均在初诊时行单纯EEN诱导缓解。
EEN的平均治疗时间为(8.0±2.9)周。89%(55/62)的患儿完成了至少8周的EEN治疗。在完成至少8周治疗的患儿中,1例在治疗期间出现呕吐,伴有发热、流涕,诊断为上呼吸道感染,其余54例患儿均无不良反应。在7例(11%)未完成8周EEN治疗的患儿中,除1例因依从性不佳外,其余6例均因EEN不能控制CD而更换为其他治疗方案。
2.2 EEN对儿童CD诱导缓解的疗效
临床缓解:55例完成8周EEN治疗的患儿中,87%(48/55)的患儿在第8周获得临床缓解。治疗后第8周PCDAI[0.0(0.0,5.0)]显著低于治疗前[20.0(25.0,27.5)](Z=-6.172,P<0.001)。
黏膜愈合:除去17例病变部位单纯累及小肠患儿及3例未行结肠镜复查的累及结肠患儿,剩余35例累及结肠患儿在8周EEN治疗后进行了结肠镜复查。83%(29/35)的患儿达到黏膜愈合;治疗后第8周CDEIS[1.0(0.0,2.8)]显著低于治疗前[8.8(5.2,13.8)](Z=-4.437,P<0.001)。
实验室指标变化:55例患儿完成8周治疗后,C反应蛋白、红细胞沉降率较治疗前显著下降(P<0.001);血清白蛋白水平较治疗前显著上升(P<0.001)。见表1。
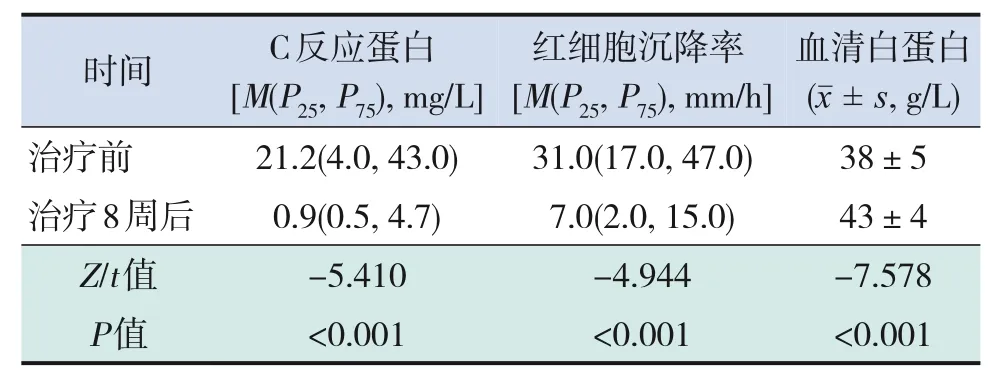
表1 EEN诱导缓解前后实验室指标比较 (n=55)
生长发育变化:55例完成8周EEN治疗的患儿中,HAZ及BMIAZ较治疗前均显著改善(P<0.05)。在第8周达到临床缓解的48例患儿中,HAZ及BMIAZ较治疗前均显著改善(P<0.01)。在第8周未达到临床缓解的7例患儿中,HAZ及BMIAZ与治疗前比较差异均无统计学意义(P>0.05)。见表2。
表2 EEN诱导缓解前后生长指标比较 (±s)

表2 EEN诱导缓解前后生长指标比较 (±s)
注:[HAZ]年龄别身高的Z评分;[BMIAZ]年龄别体重指数Z评分。
时间治疗前治疗8周后t值P值总体(n=55)HAZ-0.18±1.21-0.07±1.15-2.624 0.011 BMIAZ-1.05±1.88-0.35±1.38-5.145<0.001临床缓解(n=48)HAZ-0.11±1.86-0.09±1.36-2.624 0.009 BMIAZ-1.17±1.86-0.39±1.36-5.247<0.001临床未缓解(n=7)HAZ 0.023±1.136-0.004±1.145 0.618 0.559 BMIAZ-0.21±1.93-0.08±1.59-0.581 0.583
3 讨论
CD在儿童人群中的发病率逐渐增高[15],至今尚无完全安全有效的治愈方法。传统的儿童CD诱导缓解治疗为激素或氨基水杨酸类药物。美沙拉嗪治疗不良反应小,但对CD的诱导缓解率低,尤其是中重度CD患儿[16]。激素对CD诱导缓解疗效在成人患者中是肯定的[17-18],但其对骨代谢及发育的影响限制了其在儿童中的应用。自20世纪80年代以来,EEN逐渐被应用到儿童CD的诱导缓解治疗中。多项研究提出,EEN对于儿童CD诱导缓解率在75%~87%,与激素的诱导缓解率相当,而EEN有更好的肠黏膜愈合率[8,19-21]。同时,EEN与生物制剂(抗肿瘤坏死因子α单克隆抗体)的比较性研究发现,两者对儿童活动性CD的诱导缓解疗效无显著性差异[5]。因此,欧洲克罗恩病和结肠炎组织/欧洲儿童胃肠病、肝病和营养协会分别在2014年及2020年发布的关于儿童CD治疗共识中,“EEN作为一线诱导缓解方案治疗儿童活动性CD”这条建议的证据等级分别为1级和2级[2-3],提示了EEN在儿童活动性CD诱导缓解治疗方案中的重要性。国内关于EEN对儿童CD诱导缓解的临床一线数据罕见。在仅有的1篇报道中[9],只纳入了25例进行EEN治疗的CD患儿,且未对患儿的营养状况、依从性进行分析,因此能提供的信息有限。本研究回顾8年多经EEN治疗的儿童CD共62例,是迄今国内报道EEN治疗儿童CD样本量最多的研究。本研究发现EEN治疗8周具有较好的临床诱导缓解率、黏膜愈合率,不良反应少,为EEN在中国儿童CD中的应用提供客观的实践依据。
在本组资料中,经过8周的EEN诱导缓解治疗,CD患儿的临床缓解率及黏膜愈合率均在80%以上,并且实验室的炎症指标、白蛋白水平均有显著改善。提示EEN在中国儿童CD人群中有较好的诱导缓解作用。在国外的报道中,EEN对轻中度活动性CD的诱导缓解率与本研究结果类似[19-21]。此外,EEN在欧美人群中也有较好的黏膜愈合及实验室指标恢复正常的报道[22-24]。
本研究发现EEN短期治疗8周能使儿童患者BMIAZ及HAZ得到显著改善。这个临床结局在成功诱导缓解的患儿中体现更明显。而在诱导缓解失败的患儿中,治疗前后BMIAZ及HAZ无显著变化,提示疾病临床活动度的控制对儿童生长发育影响的重要性。对于反复疾病活动的患儿,可能需增加患儿的随访频率,及时调整EEN的剂量或更改治疗方案,以保证其更好的生长发育。
与激素及生物制剂对儿童CD诱导缓解治疗相比,EEN因较少的不良反应及较好的改善儿童营养状态而得到医生及家长的欢迎[7,20]。本组资料中,仅1例患儿在EEN期间出现呕吐,分析当时的情况,考虑呕吐原因可能与当时伴随的上呼吸道感染有关,而不一定与EEN相关。其余患儿均耐受良好。相对于其他的诱导缓解方案,患儿的依从性是EEN的主要缺点。本组资料中,所有患儿均选择口服的途径进行EEN。相较于鼻饲,口服的途径对于儿童的接受度更高。根据既往的研究,不同给予途径(鼻饲或口服)的EEN治疗对儿童CD的临床结局无影响[25]。本研究中,有1例患儿因不喜欢肠内营养制剂的口感未能坚持,其余均完成至少8周的EEN治疗,依从性98.2%,相较于文献的报道要高[21]。患儿的依从性与多方面因素有关,包括医生对这种治疗方案的肯定、家庭成员的支持、家庭经济状况、医护人员对患儿的鼓励和宣教等等。在这些因素中,家长对EEN方案的认可是保证EEN顺利执行的重要因素[26]。本中心在EEN治疗前,主管医生会对家长及患儿同时进行谈话沟通,告知EEN治疗的重要性和安全性,并告知既往成功病例,实施同伴激励措施等,可能是本研究人群依从性高的原因。
本研究为单中心回顾性的病例分析,存在选择偏倚。相较于国外的研究,本研究样本量尚小。因此,需多中心、前瞻性的随机对照研究来进一步明确EEN在中国儿童活动性CD诱导缓解中的疗效。

