台湾含笑变异株群‘中山含笑’的形态特征和遗传变异分析
殷云龙, 王芝权, 杨 颖, 刘向东, 於朝广
〔江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014〕
木兰科(Magnoliaceae)含笑属(MicheliaLinn.)植物有80余种,主要分布于亚洲热带、亚热带,中国约有70种,主要产于中国西南部至东部[1],其主要分类特征为花腋生、花药侧向开裂和具柄雄蕊明显[2,3]。含笑属种类均为常绿乔木或灌木,花色有白色、黄色、紫色和红色等,形态多样性丰富,是中国南方地区极具开发潜力的观赏植物,也是北亚热带区域普遍引种的常绿园林绿化树种[4,5],因此,含笑属植物的引种和利用一直备受关注,已经成为植物育种创新的热点树种之一[2,6,7]。例如:龚洵等[3,8]以云南含笑(M.yunnanensisFranch. ex Finet et Gagnep.)和灰岩含笑(M.calcicolaC. Y. Wu)为亲本,从杂交群体中选育出‘雏菊含笑’(‘Chujuhanxiao’)等9个新品种;邵文豪等[9]以乐昌含笑(M.chapensisDandy)和紫花含笑(M.crassipesY. W. Law)为亲本,从杂交群体中选育出新品种‘梦缘’(‘Mengyuan’);毛常丽等[10]从球花含笑(M.sphaeranthaC. Y. Wu ex Z. S. Yue)与云南含笑的杂交群体中选育出新品种‘晚春含笑’(‘Wanchunhanxiao’)。近年来,虽然含笑属植物的杂交育种研究取得了一定进展,但是能推广应用的品种仍然十分缺乏。
台湾含笑〔M.compressa(Maxim.) Sarg.〕又名台湾白兰花、乌心石和黄心树,为木兰科含笑属常绿乔木,原产于台湾地区,为该地区主要用材树种之一,株高可达20 m、胸径达1 m[11]。早在20世纪80年代初,江苏省中国科学院植物研究所就成功地对台湾含笑进行了引种驯化[11]。与同一地点栽培的含笑属其他树种相比,台湾含笑的抗寒性优于深山含笑(M.maudiaeDunn)和乐昌含笑等种类[12,13];且与同一地点栽培的其他常绿阔叶树种相比,台湾含笑的耐寒性优于香樟〔Cinnamomumcamphora(Linn.) Presl〕、石楠(PhotiniaserrulataLindl.)、乳源木莲(ManglietiayuyuanensisLaw)、山杜英〔Elaeocarpussylvestris(Lour.) Poir.〕、白楠〔Phoebeneurantha(Hemsl.) Gamble〕和石栎〔Lithocarpusglaber(Thunb.) Nakai〕等常绿阔叶树种[11],是在江苏南北过渡地带(北纬31°~35°)具有应用潜力的耐寒常绿阔叶树种。然而,与花朵硕大、色彩艳丽的常见木兰科观赏树种相比,台湾含笑花型较小、花被片淡黄色、观花特性不明显,限制了其推广应用。
‘中山含笑’(Michelia‘Zhongshanhanxiao’)是在台湾含笑嫁接苗自然授粉子代的育苗过程中发现的表型显著变异子代,其观赏价值明显优于台湾含笑母树及其表型无变异子代,但是目前对‘中山含笑’的遗传背景并不清楚。SSR分子标记具有多态性高、种属间通用性良好等优点,目前已广泛用于杂种鉴定、遗传图谱构建、指纹图谱分析等相关领域[14-16],例如:王紫阳等[17]筛选出7对SSR引物对‘中山杉’品种具有较高的鉴别率,段豪等[18]采用SSR分子标记构建了落羽杉种质资源的指纹图谱,袁金玲等[19]基于SSR分子标记对丛生竹杂交种进行准确鉴定,分析杂种与亲本间的遗传关系,并构建指纹图谱。作者在对‘中山含笑’与台湾含笑母树及其表型无变异子代进行表型特征观察的基础上,采用SSR分子标记技术对他们的遗传变异和遗传多样性以及亲缘关系进行了分析,以期为含笑属观赏树种的新品种培育奠定基础。
1 材料和方法
1.1 材料
江苏省中国科学院植物研究所于1982年从福建省引进了台湾含笑实生苗1株,通过嫁接扩繁成无性系(共7株)后定植于南京中山植物园内,并培育成单一基因型的台湾含笑母树,平均株高15 m,平均胸径30 cm,目前均已开花结实,具有较好的生态适应性和观赏价值。
于2015年秋季采集母树的成熟种子,脱去外种皮后用湿沙层积储藏,翌年春季播种育苗。2016年9月,从当年育成的2万余株台湾含笑实生苗群体中发现18株表型明显变异的单株,占实生苗总数的0.09%;2017年春季对全部实生苗进行移栽,株距和行距均为50 cm。2018年,少数表型变异子代单株开始开花,初步观察发现这些单株具有生长快、枝叶茂密、叶片大而厚实、花大量多、花香浓郁、耐热、耐寒等特点,观赏价值明显高于表型无变异子代,为此,参照鹅掌楸属(LiriodendronLinn.)种质‘优酉’(‘Youyou’)的命名[20]将表型变异子代株群命名为‘中山含笑’,18株单株依次编号为Z601至Z618,并据此扩繁成无性系。
1.2 方法
1.2.1 形态观察和表型性状测定 分别于2019年与2020年的2月底至3月初,对‘中山含笑’与台湾含笑母树及其表型无变异子代的物候期进行记录,并对树干、枝、叶和花等器官的形态指标进行观测。对开花早、生长量大和性状优良的3株‘中山含笑’(Z602、Z608、Z615)以及7株母树和36株表型无变异子代进行形态特征变异统计分析。
用钢围尺(精度1 mm)在树干距地面0.1和1.3 m处分别测量地径和胸径;用布鲁莱斯测高器(德国卡尔莱斯公司,精度0.1 m)和量杆(精度1 cm)测量树高;用量杆分别测量树冠东西向和南北向的投影直径,二者平均值即冠幅。在各单株高1.5~2.0 m处的朝南方向选取大小基本一致的枝条,利用直尺(精度1 mm)测量枝条上所有叶片的叶长(叶梗至叶尖的长度)和叶宽(叶最宽处的宽度),从而获得叶长和叶宽的测量值范围。于盛花期,在各单株高1.5~2.0 m处的朝南方向统计单枝着花数;采用目测法对花色进行判定;随机采集5朵盛开的花朵,统计花被片数量,并利用直尺测量花被片长度(花被片基部至顶端的长度)和花被片宽度(花被片最宽处的宽度),从而获得花被片长度和宽度的测量值范围。
1.2.2 SSR分子标记分析 2020年5月,以‘中山含笑’18株单株(Z601至Z618)和1株台湾含笑母树(M)及其表型无变异子代的3株单株(N1至N3)为样株,每株采集3~5枚幼嫩叶片,于-80 ℃冰箱中保存,用于SSR分子标记分析。
1.2.2.1 DNA提取 使用新型快速植物基因组DNA提取试剂盒(北京百泰克生物技术有限公司)提取嫩叶基因组DNA,并用Colibri超微量分光光度计(德国Berthold公司)检测提取的基因组DNA的浓度和纯度,用EB缓冲液将基因组DNA稀释至10 ng·μL-1,置于-20 ℃冰箱保存、备用。
1.2.2.2 SSR引物筛选 依据目前已公布的木兰科植物北美鹅掌楸〔Liriodendronchinense(Hemsl.) Sarg.〕[21]、深山含笑[22,23]、阿希氏木兰(MagnoliaasheiWeath.)[24]、西畴含笑(MicheliacoriaceaHung T. Chang et B. L. Chen)[25]、火力楠(MicheliamacclureiDandy)[26]和灰木莲(ManglietiaconiferaDandy)[27]的SSR标记分析结果,挑选出62对通用性较高的引物,以‘中山含笑’Z601、Z605、Z609、Z613和Z617的基因组DNA为模板进行引物初筛。
PCR反应体系总体积15.0 μL,包括2×TaqPCR Master Mix 7.5 μL、10.0 μmol·L-1正向和反向引物各0.9 μL、模板DNA 1.0 μL及双蒸水4.7 μL。PCR扩增程序为:95 ℃预变性3 min;94 ℃变性30 s、62 ℃退火30 s、72 ℃延伸45 s,共10个循环,每个循环降低0.5 ℃;94 ℃变性30 s、54 ℃退火30 s、72 ℃延伸45 s,共20个循环;72 ℃延伸7 min。每个样本重复扩增3次,扩增产物于4 ℃保存。
在扩增产物中加入1.5 μL溴酚蓝染液,混合均匀后,用质量体积分数8%SDS-PAGE进行电泳分离及银染。筛选出5对扩增条带清晰、多态性丰富及重复性高的引物,用于遗传多样性分析。5对引物序列如下:MMA72-F为5′-TTTTCCACCCCTCTCGAATA-3′,MMA72-R为5′-CCATTATGCTGGGGTGTCTT-3′;M02-F为5′-CAGCTCCCATTTTCTGTCGC-3′,M02-R为5′-TCTGCAGATCAAGGCCTTGG-3′;M23-F为5′-GTTCTCCACAAAGCTTGGCG-3′,M23-R为5′-CGTCCCCATCTTTCCTGTCC-3′;MA3-7-F为5′-CATGCTAACCCATCTAGTCACG-3′,MA3-7-R为5′-TCCCAATACCCATCCCAGTA-3′;MA3-12-F为5′-AGCCCAAGGAGACAACAGAA-3′,MA3-12-R为5′-GGGTTTCTTCGCATGTTGTT-3′。
1.2.2.3 PCR扩增和毛细管电泳 在每对引物正向引物的5′端添加荧光基团合成荧光引物,其中引物MMA72和M02进行FAM修饰,引物M23、MA3-7和MA3-12进行HEX修饰,荧光引物由上海捷瑞生物工程有限公司合成。以上述22株样株的基因组DNA为模板,在遮光条件下,按照前述反应体系和程序进行扩增。扩增产物由上海捷瑞生物工程有限公司进行毛细管电泳荧光检测,步骤为:PCR扩增产物先用双蒸水稀释10倍,再用HIDI(已混合ROX500)稀释10倍,95 ℃变性3 min,立即冰水浴,最后用ABI 3730XL遗传分析仪(美国ThermoFisher公司)进行检测。每个扩增产物重复检测4次。
1.3 数据处理和分析

2 结果和分析
2.1 ‘中山含笑’与台湾含笑母树及其表型无变异子代的形态特征比较
对‘中山含笑’与台湾含笑母树及其表型无变异子代的整株、叶片和花形态特征进行观测,结果见图1和表1。
从形态(图1)上看,与母树相似,‘中山含笑’也为常绿乔木,分枝多,呈塔状或圆锥状;供试‘中山含笑’为4年生幼树,最早在第3年始花,早于表型无变异子代(4年生表型无变异子代暂未始花);花期2月至3月,果期10月至11月。其叶革质,倒卵状椭圆形或狭倒卵形,先端急短尖,叶正面深绿色且有光泽,叶背面淡绿色,叶面积明显大于母树和表型无变异子代。‘中山含笑’开花多且芳香,单花腋生,花明显大于母树;花被片8~14枚,呈螺旋状排列,倒卵形;雌蕊群绿色,柱头带紫红色;雄蕊群黄绿色,基部紫色,雄蕊数量45~48枚,长8.0~14.0 mm。
由表1可见:‘中山含笑’Z602、Z608和Z615的株高、地径、胸径和冠幅分别是表型无变异子代的1.41~1.55、2.49~2.97、2.79~3.16和2.38~2.74倍;叶长和叶宽分别是表型无变异子代的1.40~2.04和1.50~2.17倍。并且,‘中山含笑’的叶长和叶宽以及花被片的长度和宽度均大于母树,花被片的长度和宽度分别是母树的3.50~4.53和4.33~7.00倍。母树和表型无变异子代的叶片大小无明显差异。‘中山含笑’的单枝着花数和花被片数与母树和表型无变异子代相似,但其花被片颜色与母树有差异,为乳白色,近基部带淡紫色或紫色,而母树的花被片为淡黄白色,近基部带深紫色。
综上所述,‘中山含笑’的整株、叶片和花在形状上与母树和表型无变异子代相似,但其叶片和花大小却发生了显著变化。

Z602,Z608,Z615: ‘中山含笑’单株 Individuals of Michelia ‘Zhongshanhanxiao’; M: 台湾含笑母树Mother tree of M. compressa (Maxim.) Sarg.; N: 台湾含笑表型无变异子代Progeny without phenotypic variation of M. compressa.
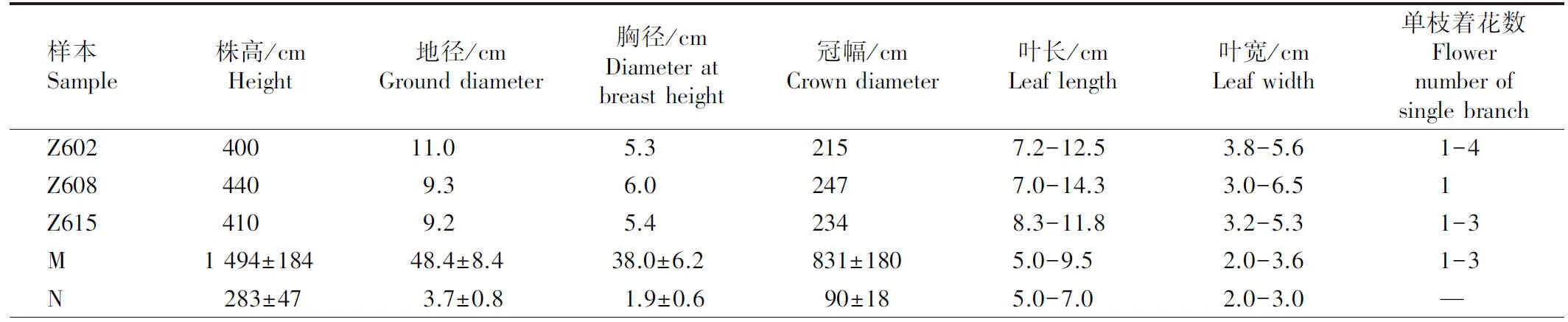
表1 ‘中山含笑’与台湾含笑母树及其表型无变异子代的形态特征差异1)
2.2 ‘中山含笑’与台湾含笑母树及其表型无变异子代的遗传变异分析
2.2.1 基于SSR分子标记的多态性分析 对‘中山含笑’与台湾含笑母树及其表型无变异子代进行SSR标记分析,5对引物扩增条带的多态性分析见表2。由表2可见:5对SSR引物从22株单株基因组DNA中共检测出16个等位基因,其中,引物MMA72、M02和MA3-7的观测等位基因数均为4,引物M23和MA3-12的观测等位基因数均为2;有效等位基因数为1.4~2.4,平均值为1.9。观测杂合度为0.364~0.818,5个引物的观测杂合度由大到小依次为MMA72和MA3-7、M02、M23、MA3-12;期望杂合度为0.304~0.589,由大到小依次为MA3-7、MMA72、M02、M23、MA3-12。Shannon’s多样性指数为0.474~1.031,平均值为0.777。Nei’s基因多样性指数为0.298~0.575,平均值为0.446。总体上看,引物MA3-12的遗传变异指标均最小,而引物MA3-7的遗传变异指标均最大。
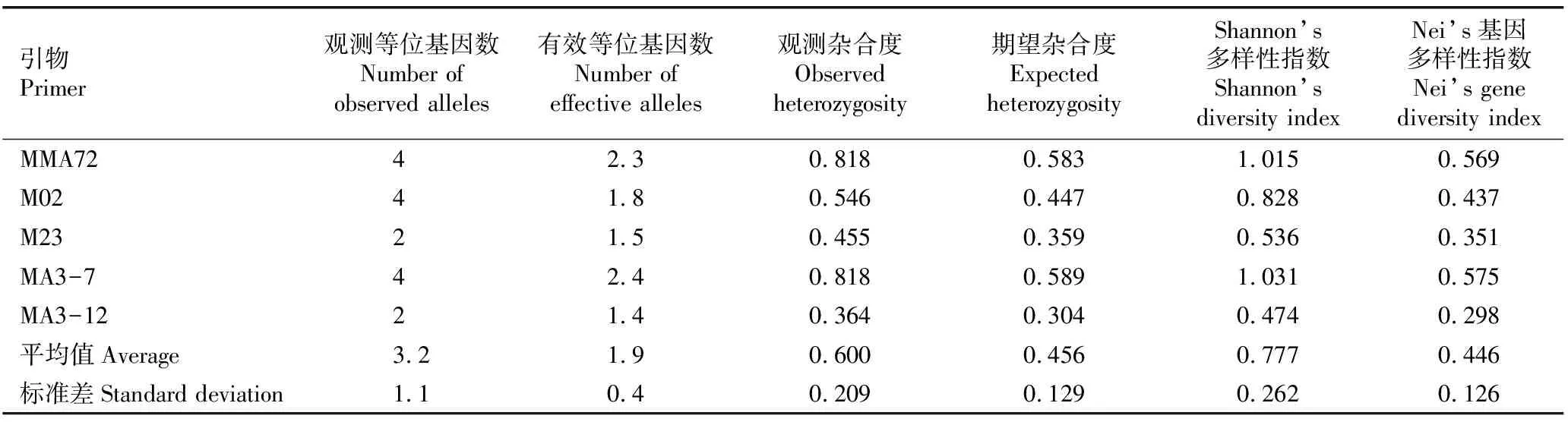
表2 5对SSR引物扩增条带的多态性分析
2.2.2 基因分型分析 对‘中山含笑’单株与台湾含笑母树及其表型无变异子代进行SSR标记分析,5对SSR引物在22株样株中的扩增条带长度见表3。
母树和表型无变异子代的3株单株的扩增结果完全一致,但与‘中山含笑’18株单株的扩增结果存在一定差异。其中,引物MMA72、M02、M23、MA3-7和MA3-12在表型无变异子代中检测到的等位基因数分别为1、2、1、1和1,但在‘中山含笑’18株单株中检测到的等位基因数分别为4、3、2、4和2,表明‘中山含笑’的等位基因数高于表型无变异子代。
MMA72和MA3-7引物对应的位点在‘中山含笑’18株单株中为杂合位点;M02引物对应的位点在‘中山含笑’8株单株中为杂合位点,M23引物对应的位点在‘中山含笑’10株单株中为杂合位点,MA3-12引物对应的位点在‘中山含笑’8株单株中为杂合位点。
引物MMA72、M23、MA3-7和MA3-12在母树和表型无变异子代中的扩增产物长度分别为212、181、187和182 bp,而在‘中山含笑’18株单株中除均可扩增出长度一致的条带外,还可扩增出长度分别为214~228、174、211~226和158 bp的另一条带。引物M02在母树和表型无变异子代的扩增产物长度均为140和150 bp,而在‘中山含笑’18株单株中除均可扩增出长度140 bp的条带外,其中8株单株还能扩增出长度为142或159 bp的另一条带。
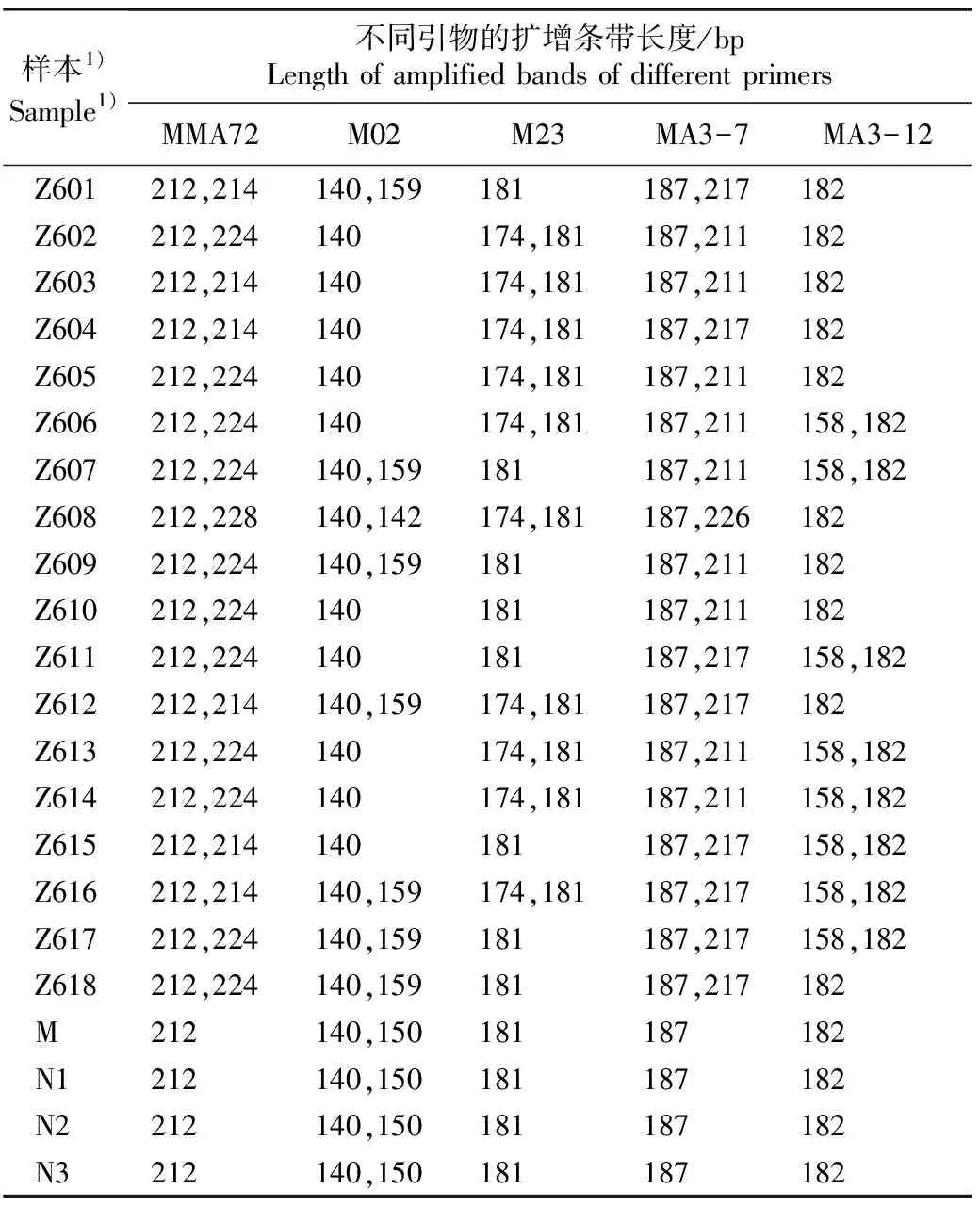
表3 5对SSR引物在‘中山含笑’与台湾含笑母树及其表型无变异子代中的扩增条带长度
总之,除含有与母树相同的等位基因外,‘中山含笑’18株单株还含有来源于母树之外的等位基因。
2.2.3 遗传多样性分析 ‘中山含笑’与台湾含笑表型无变异子代的遗传多样性分析见表4。结果表明:‘中山含笑’的观测等位基因数、有效等位基因数、观测杂合度和期望杂合度分别为表型无变异子代的2.50、1.67、3.44和4.06倍,Shannon’s多样性指数是表型无变异子代的5.73倍,Nei’s基因多样性指数是表型无变异子代的4.74倍。总之,‘中山含笑’的遗传多样性明显高于表型无变异子代。
2.2.4 遗传一致度和遗传距离分析 对‘中山含笑’与台湾含笑母树及其表型无变异子代进行遗传一致度和遗传距离分析,结果见表5。
结果表明:母树和3株表型无变异子代单株的遗传一致度均为1.000、遗传距离均为0.000,3株表型无变异子代间的遗传一致度也均为1.000、遗传距离也均为0.000,表明母树与表型无变异子代间无遗传差异。
‘中山含笑’18株单株间的遗传距离变化范围为0.000~0.539,平均值为0.241;其中,Z602与Z605、Z606与Z613和Z614间的遗传一致度均为1.000,遗传距离均为0.000,说明Z602与Z605、Z606与Z613和Z614间均无遗传差异;Z607与Z608、Z608与Z617间的遗传距离最大(0.539),说明这2组单株间的遗传差异最大。
‘中山含笑’18株单株与母树的遗传距离变化范围为0.192~0.399,平均值为0.288;其中Z610与母树间的遗传距离最小,Z616与母树间的遗传距离最大。‘中山含笑’各单株与母树间的遗传距离总体上小于‘中山含笑’单株间的遗传距离,说明‘中山含笑’与母树具有部分相近的遗传组成;其中,Z610与母树的遗传差异最小,Z616与母树的遗传差异最大。

表4 ‘中山含笑’和台湾含笑表型无变异子代的遗传多样性分析
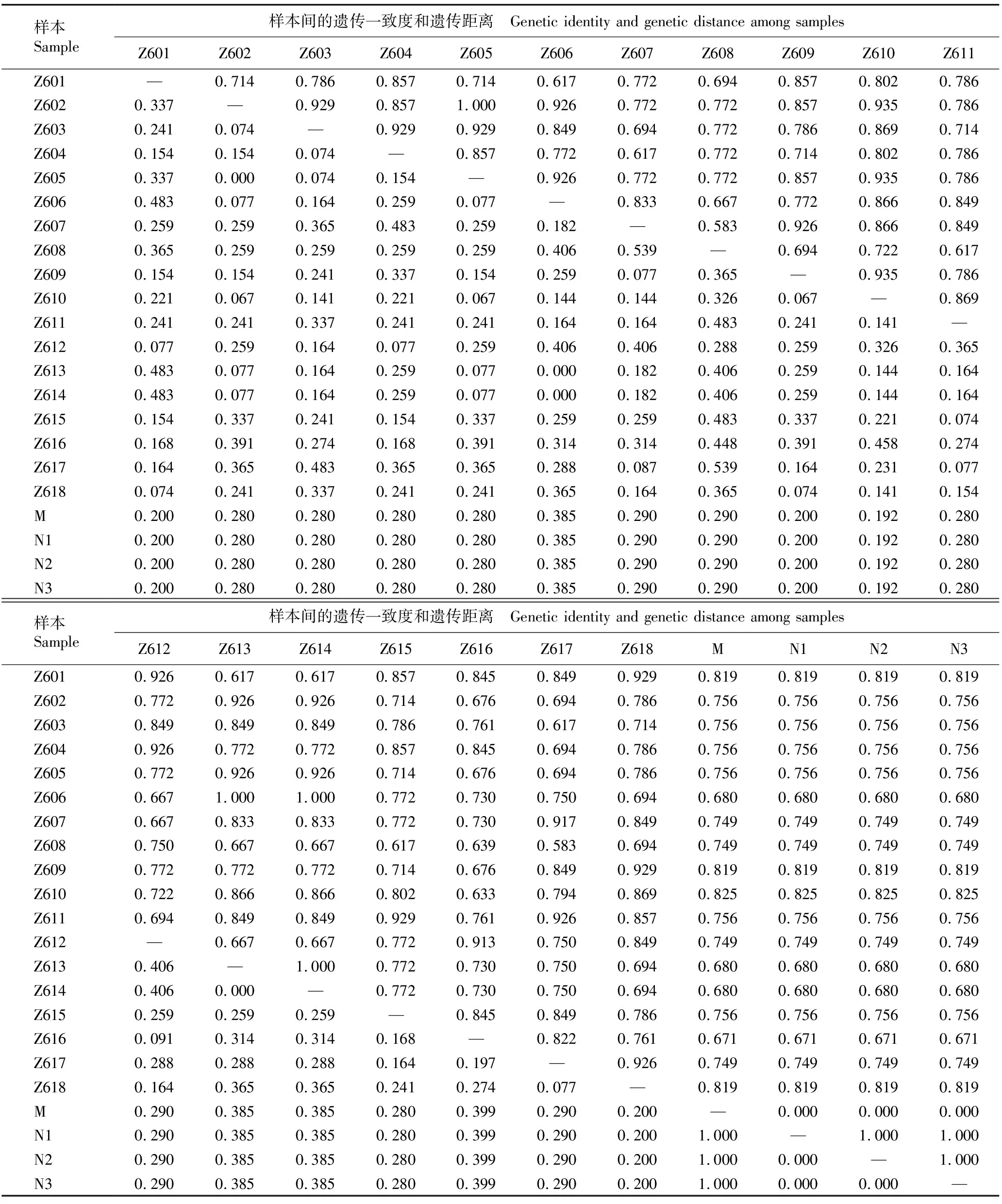
表5 ‘中山含笑’与台湾含笑母树及其表型无变异子代间的遗传一致度和遗传距离1)
2.3 ‘中山含笑’与台湾含笑母树及其表型无变异子代的遗传关系分析
为进一步探讨‘中山含笑’与台湾含笑母树及其表型无变异子代的遗传关系,根据上述22份样本的遗传一致度采用UPGMA法进行聚类分析,结果见图2。在遗传一致度为0.50处,供试的22份样本分为2组,其中,母树和3个表型无变异子代单株聚为Ⅰ组,‘中山含笑’18个单株聚为Ⅱ组。在遗传一致度为0.64处,Ⅱ组分为4个亚组,其中,‘中山含笑’Z608单独聚为Ⅱ1亚组;Z602、Z605、Z603、Z606、Z613、Z614和Z610聚为Ⅱ2亚组;Z607、Z617、Z609、Z618、Z611和Z615聚为Ⅱ3亚组;Z601、Z612、Z604和Z616聚为Ⅱ4亚组。
由此可见,母树和表型无变异子代具有极为紧密的遗传关系,而‘中山含笑’18个单株与母树和表型无变异子代的遗传关系较远;在‘中山含笑’18个单株中,Z608与其他17株单株的遗传关系较远。
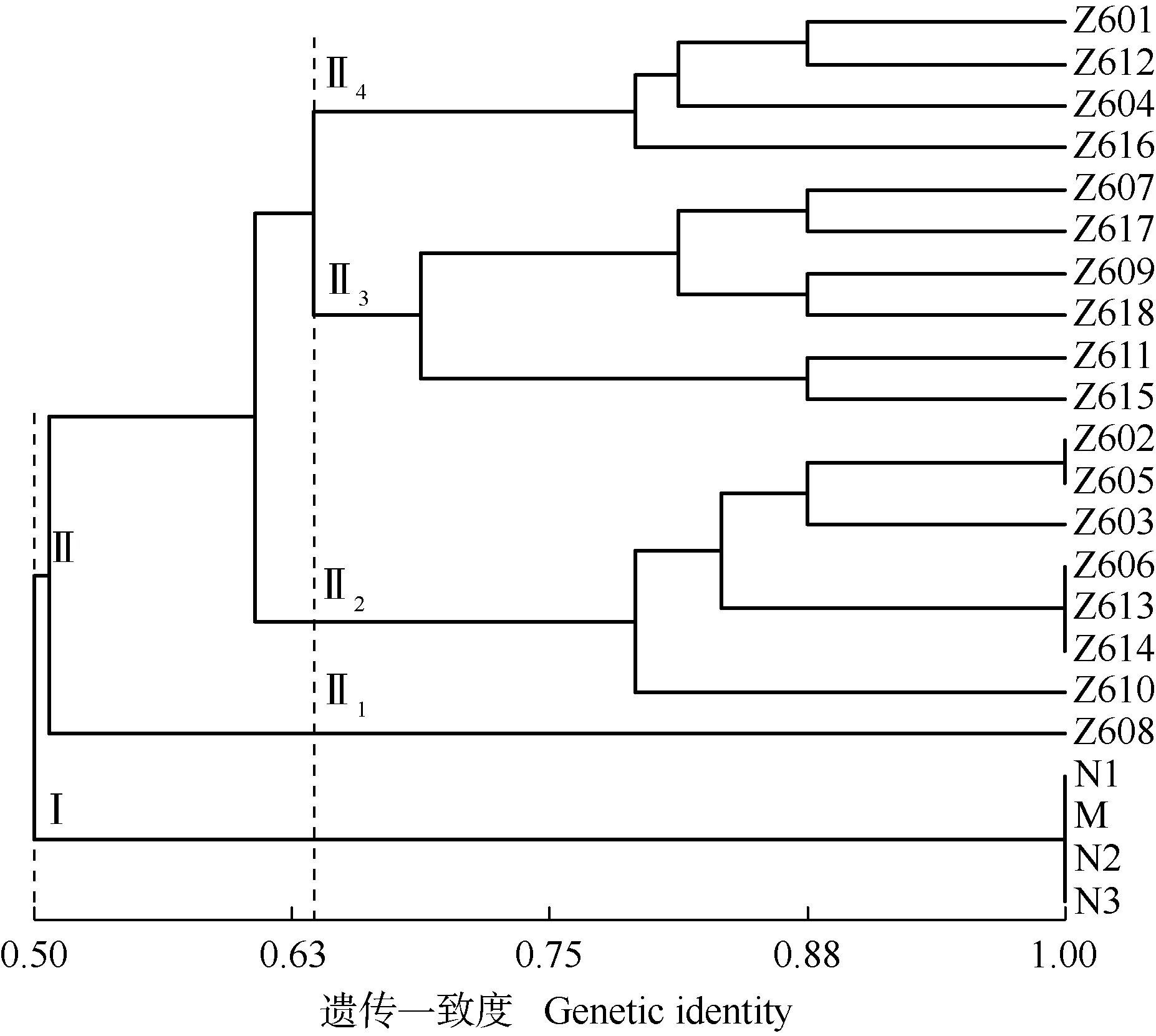
Z601-Z618: ‘中山含笑’单株Individuals of Michelia ‘Zhongshanhanxiao’; M: 台湾含笑母树Mother tree of M. compressa (Maxim.) Sarg.; N1-N3: 台湾含笑表型无变异子代单株Individuals of progeny without phenotypic variation of M. compressa.
3 讨论和结论
SSR标记分析结果表明:台湾含笑3个表型无变异子代在5个位点上与台湾含笑母树的基因分型完全一致,表明母树与表型无变异子代拥有高度相似的遗传基础。由于供试的母树是由同一株台湾含笑实生苗经采穗嫁接繁殖的无性系,携带完全相同的遗传信息,其不同单株之间花粉传播并授粉产生的子代属于同一基因型的自交子代;而表型无变异子代的叶片形态与母树高度相似,因而,推测表型无变异子代为母树通过自由授粉产生的自交后代。在母树的SSR标记分析中,5个位点中有4个为纯合位点,其自交子代在这4个位点上不会产生遗传分化,因此,表型无变异子代单株也具有这4个纯合位点;但M02引物对应的位点在母树和表型无变异子代单株中均为杂合位点,由于取样单株数量较少,并不能确定该位点是否存在遗传分化,因此,后续将通过扩大表型无变异子代样本的数量,进一步确定该位点的遗传分化程度。
从2万余株台湾含笑自由授粉子代中仅发现少数表型明显变异的单株(即‘中山含笑’),产生这种变异的概率较低,仅0.09%,推测由台湾含笑母树自交产生这种变异的可能性不大。通过SSR标记分析,5个SSR引物在‘中山含笑’不同单株中的扩增产物呈现等位基因的杂合性,即‘中山含笑’18株单株除携带母树的遗传信息外,还各自含有来源于母树之外的遗传信息;加之在表型特征上‘中山含笑’供试单株的叶片和花明显大于母树,且长势也明显高于同龄的表型无变异子代,开花的株龄早于表型无变异子代,因此,推测‘中山含笑’为台湾含笑与木兰科其他植物的种间杂交后代。
聚类分析结果显示:‘中山含笑’18株单株可以分成4个亚组,其中Z608独立成为1个亚组,另外17株单株聚为另3个亚组;其中,在Ⅱ2亚组的7株单株中,Z602与Z605、Z606与Z613和Z614单株间的遗传一致度均为1.000,说明Z602与Z605、Z606与Z613和Z614间除具有相同的母本台湾含笑的遗传信息外,也各自具有相同父本的遗传信息。‘中山含笑’18株单株与母树和表型无变异子代可以明显聚为2组,说明‘中山含笑’与台湾含笑有较远的遗传关系,且‘中山含笑’18株单株聚为不同的亚组,说明有些单株的父本可能属于木兰科不同种类,特别是Z608的父本可能更为特殊。有关‘中山含笑’不同单株父本的研究将通过杂交实验进一步验证。
在本研究中,从62对来自木兰科其他植物的SSR标记中筛选出5对SSR引物,分别来自深山含笑、灰木莲和阿希氏木兰,应用于本研究中均具有优良的通用性,加之本研究选用高分辨率的荧光毛细管电泳基因分型技术,使用5对SSR引物共扩增出16个等位基因,表现出较高的多态性。因此,使用这5对SSR引物基本能反映‘中山含笑’与母树和表型无变异子代的遗传差异。
台湾含笑在江苏地区具有良好的耐寒性和生态适应性,是值得大力推广应用的园林绿化树种[11-13,28-30]。‘中山含笑’是台湾含笑在迁地保育条件下产生的变异子代,不仅其生态适应性得到进一步加强,而且在生长和观赏特征上表现出明显的超亲优势,具有广阔的应用前景,因此,从品种创新的目的出发,应进一步弄清其遗传背景,全面了解其生物学特征,并开展繁育和栽培技术等方面的研究。

