长期腹膜透析伴糖尿病及包裹性腹膜硬化一例
张红梅,赵云妍,吕爱清
(北京市中关村医院 放射科,北京 100080)
0 前言
包裹性腹膜硬化是慢性肾脏衰竭患者长期腹膜透析之后出现的罕见且能危及生命的并发症,EPS的临床特点是长期腹膜透析后患者的小肠部分或全部被一层较厚的蚕茧样纤维薄膜包裹,进而累及小肠周围以及远处的腹腔内其他脏器。早期诊断难,可出现肠梗阻,预后差,甚至在改为血液透析(hemo dialysis,HD)或肾移植后也可能发生。目前常规治疗方法为药物治疗,手术治疗主要是针对伴有严重肠梗阻的患者,国内外均有报道,发病率虽然较低,但总体呈上升趋势,病死率及发病率与透析时间呈正相关。糖尿病是一种慢性代谢疾病,容易并发外周血管钙化等并发症。EPS的发生与糖尿病可能存在一些潜在的关系,未见相关报道,现报道一例维持性腹膜透析患者伴有糖尿病及EPS,虽然不能通过这一例来确定EPS与糖尿病之间的内在联系,但二者之间是否存在共同的作用机制需要进一步探讨。
1 临床资料
患者,男性,61岁,维持性腹膜透析30余年,糖尿病二十余年,因纳差、食欲差,双足反复破溃2个月,于2021年3月11日入院。患者1991年因外伤导致双肾挫伤,后诊断为双肾功能衰竭,之后进行长期腹膜透析,曾在刚开始透析不久出现过腹膜炎(具体不详)。2001年诊断为2型糖尿病,患者长期胰岛素注射,自述血糖控制可,现患者每日注射精蛋白重组胰岛素控制血糖,每日注射总量为130单位。入院查体:血压126/80mmHg,精神状态呆滞。腹膜透析出口无分泌物,隧道无压痛,腹部饱满,未见明显胃肠型,无明显压痛,左侧下腹部可见透析导管在位。患者三年前摔倒后右小腿骨折,未行手术治疗,骨折一直未愈合。
患者入院以来食欲减退,低蛋白血症、近两个月双足再次出现破溃,有明显异味,保守治疗效果不佳,最终截肢,伤口愈合困难。化验:血常规白细胞9.51X109/L,红细胞2.07X1012/L,血红蛋白65.0g/L。生化检验报告:总蛋白56.50g/L,白蛋白-溴甲酚绿23.60g/L,总钙1.84mmol/L,无机磷0.86mmol/L,钠126mmol/L,钾2.90mmol/L。免疫检验报告:白介素674.42pg/mL,降钙素原0.64ng/mL。空腹血糖8.75mmol/L,餐后2小时血糖7.10mmol/L,糖化血红蛋白7.20%。腹部计算机断层扫描(CT)显示腹膜增厚,肠壁弥漫性钙化、增厚,并局部包裹,部分层面可见“眼镜征”改变,伴腹水,双肾体积减小,肾动脉严重钙化(图1-3)。
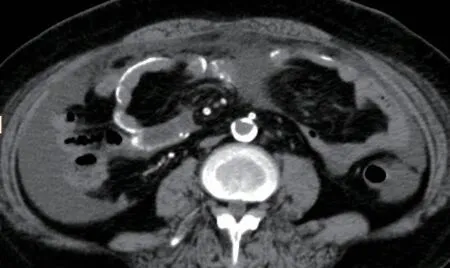
图1 全腹CT平扫轴位图像
住院期间,患者间断出现憋闷气促,皮肤瘙痒。化验检查:N端-B型钠尿肽前24887.0pg/mL,肌钙蛋白T0.152ng/mL,肌红蛋白测定127.30ng/mL。与心内科会诊提示:心功能不全考虑为血液透析不充分所致,为进一步加强血液透析治疗,决定实施半永久性中心静脉插管更换术,手术成功。
2021年3月28日化验检查:白细胞计数14.46×109/L,红细胞1.89×1012/L,血红蛋白55.0g/L,红细胞压积18%,中性粒细胞绝对值11.32×109/L。2021年3月30日出现言语不利表现,夜间血压85/54mmHg,予以多巴胺血压升至105/75mmHg,复查血常规提示:血色素降到55g/L,故申请悬浮红细胞2u并透析补液1300mm,期间未述明显不适。于次日15时59分患者突发血压下降,血压最低70/50mmHg,凝血酶原时间延长,白细胞计数明显升高,红细胞及血红蛋白减少等中毒感染的表现,同时出现凝血功能障碍,脓毒性休克,最终出现呼之不应,呼吸频率明显变慢,紧急实施抢救治疗,直至16:58分患者自主心率消失,心电监护呈直线,宣布临床死亡。
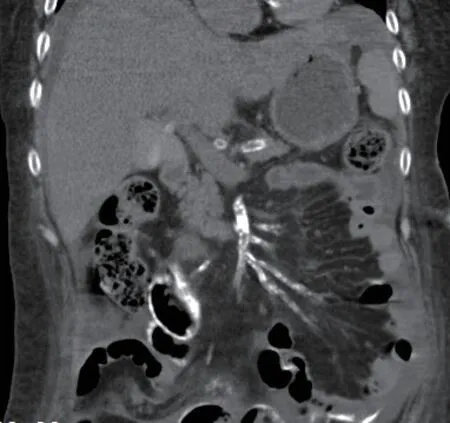
图2 全腹CT平扫冠状位重建图像
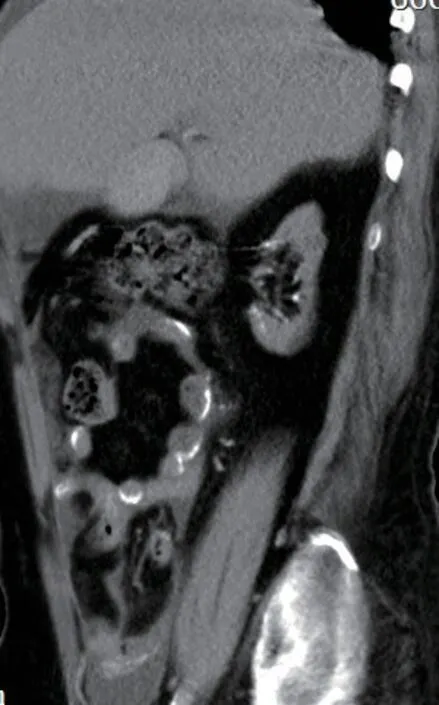
图3 全腹CT平扫矢状位重建图像
2 讨论
EPS是长期进行腹膜透析出现的少见严重并发症,特征是腹膜纤维胶原纤维的沉积,导致腹膜增厚、超滤损失、小肠梗阻及营养不良[1-2]。最早于1980年Gandhi首先在腹膜透析人群中报道,并称之为硬化包裹性腹膜炎(sclerosis encapsulating peritoneal,SEP)[3]。2000年,国际腹膜透析学会(ISPD)建议统称为EPS,并确定它是一种临床综合征[4]。关于EPS发病机制尚不明确,研究认为是以腹膜损伤和纤维化为基础的“双重打击学说”[5]。如果不治疗,它的病死率高达93%,但若规范化治疗,病死率可降至25%左右[6]。临床上EPS早期发现困难,主要是非特异的胃肠症状为主,后期主要是由于腹膜包裹所致的肠梗阻改变[7],确诊需要依靠手术,影像检查可以提示辅助诊断。本例患者胃肠道症状主要是纳差,可能与腹膜增厚、小肠聚拢所致的胃肠功能紊乱相关,未见明显梗阻征象。因此,针对长期腹膜透析患者,一旦出现胃肠道症状,应及时警惕EPS及相关并发症的发生。
糖尿病是严重危害人类健康的全身性代谢疾病,关于糖尿病的病因,有一种学说认为糖尿病是由炎症因子介导的慢性低度炎症性疾病,即一种慢性、亚临床性、非特异性免疫介导的不同于感染、损伤等应激因素作用下的炎症反应,属于广义的先天性免疫反应(innate immune response,IIS)。有研究表明白细胞介素6与糖尿病的进展密切相关[8-9]。本报道中患者双足反复破溃,最终截肢,且愈合不佳,感染控制困难,入院化验检查白细胞介素6高于正常范围,患者身体长期处于慢性炎症状态,由于长期消耗,合并有严重的低蛋白血症改变。有研究表明,除了长期腹膜透析,EPS的发生和发展还与药物、腹膜结核、手术、全身炎症性疾病等相关[10-11],EPS患者糖尿病的患病率可以达到39%或更高[1]。
本例报道中患者的腹部CT征象主要包括腹膜弥漫性增厚,局部小肠被包裹、聚集,且肠壁出现广泛的短线状、轨道状钙化,并伴有腹水,与文献中提到的EPS的CT征象基本一致[12-13],但腹水并非特异征象,图像可见“眼镜征”(图1)。另外本病例的腹主动脉、双肾动脉、髂动脉、股动脉、肠系膜上动脉等血管的管壁可见到明显钙化,这与相关研究显示的糖尿病的透析患者易出现血管重度钙化相一致,且这种概率明显高于非糖尿病患者[14]。还有报道表明血管钙化是慢性肾脏病矿物质代谢异常(CKD-MBD)表现的一部分[15]。且都是异位钙化,腹膜钙化与血管钙化之间没有相关性[16]。而血液透析患者中很少发现腹膜钙化,推测腹膜的钙化与透析患者全身的钙磷代谢紊乱无明显关系,可能主要与腹膜局部的因素有关。其中,本例患者的双肾动脉显著钙化,也不能排除同时患有糖尿病肾病的可能,由于临床现有的资料欠完整,没有得到证实。但我们有理由推测本例患者的这种异位钙化是维持性腹膜透析与糖尿病双重作用的结果,EPS与糖尿病之间有可能存在某种共同的作用机制,值得我们进一步探究证实。
关于EPS治疗,目前主要是药物和手术两种,药物主要是糖皮质类固醇类药物,治疗效果不佳者,最终要手术治疗。由于长期透析,腹膜有钙化,全身状况较差,不适合手术治疗,入院后及时改腹膜透析为血液透析,但由于患者严重的低蛋白血症、反复感染,最终出现脓毒性休克,抢救无效死亡。

