基于网络药理学探讨白芍治疗系统性红斑狼疮的分子机制
郭子琳,夏聪敏,唐晓颇✉
(1.中国中医科学院广安门医院,北京 100053;2.北京中医药大学,北京 100029)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种慢性自身免疫病,患者体内产生异常的自身抗体、补体和免疫复合物[1-2],常攻击多器官、多系统[3]。SLE 在我国患病率达30~70/10 万[4],其发病机制尚无定论,临床症状复杂多样,病势迁延,威胁着众多育龄期女性[5-6]。糖皮质激素、免疫抑制剂是临床常用药[7],但由于远期疗效及安全性欠佳、价格昂贵等问题,本病治疗始终存在瓶颈[8]。
中医对SLE 的认识历史悠久,《内经》云:“风雨寒热不得虚,邪不能独伤人。此必因虚邪之风……乃客其形”,点明其发病核心在于本虚;《金匮要略》专篇首次以“阴阳毒”命名,认为病机属虚实夹杂,邪盛正虚贯穿始终[9]。近年来,中医药治疗SLE 崭露头角,在增效减毒、调节免疫、控制疾病活动、促进激素撤减等方面优势突出[10]。白芍作为风湿免疫科常用中药,临床疗效确切[11-12],不仅能明显改善SLE 患者实验室指标,降低血清免疫因子水平[13-14],还能控制疾病活动,激活低表达免疫细胞[15]。但其发挥作用的具体物质基础和分子机制尚待阐明。
网络药理学是在疾病-靶点-药物的多层次网络基础上研究起效机制,与中医整体观念相呼应,应用十分广泛[16-17]。本研究借助此方法,挖掘白芍治疗SLE的深层机制,探讨其科学内涵。
1 材料与方法
1.1 白芍活性成分筛选和靶点预测
基于TCMSP平台[18](http://lsp.nwu.edu.cn/tcmsp.php)检索并筛选出口服利用度(oral bioavailability,OB)≥30%、类药性(drug likeness,DL)≥0.18[19]的白芍活性成分,结合文献补充完善筛选结果。从PubChem[20](https://pubchem.ncbi.nlm.nih.gov/)数据库查找对应的标准化 SMILES 格式导入SwissTargetPrediction[21](http://www.swisstargetprediction.ch/)平台,得到活性成分对应的靶标,与TCMSP所预测靶标汇总去重后,利用Uniprot(https://www.uniprot.org/)数据库进行基因标准化处理。
1.2 白芍“活性成分-靶点”网络构建
利用Cytoscape3.7.2[22]软件将上述结果构建为“白芍-活性成分-潜在靶标”网络图,其中药物、活性成分、潜在靶标以“节点”(node)表示,三者关联情况由“边”(edge)呈现。
1.3 疾病相关靶点确定
以“systemic lupus erythematosus”为关键词,从TTD[23]、OMIM[24]、GeneCards[25]、DrugBank[26]、CTD[27]等数据库检索、筛选疾病靶点,去重后导入Uniprot 数据库实现基因标准化,获得SLE 相关靶点,再通过Venny(https://bioinfogp.cnb.csic.es/tools/venny/)平台提取出白芍和SLE的交集靶点。
1.4 蛋白互作网络构建及关键靶点筛选
将白芍与SLE 相关靶点分别导入BisoGenet 插件中,得到各自的蛋白互作(protein protein interaction,PPI)网络,利用Merge 功能获取二者交集部分,结合拓扑分析插件CytoNCA[28]及相关研究文献,将交集网络中各节点的属性值逐一进行分析。算出连接度的中位数并提取所有大于其2 倍值的节点,得到“Hit hubs”网络。接着提取所有大于连接度(degree centrality,DC)2 倍中位数的节点,以及所有大于紧密度(closeness centrality,CC)、介度(betweenness centrality,BC)、特征向量(eigenvector centrality,EC)、网络中心性(network centrality,NC)和局部边连通性(local average connectivity,LAC)中位数的节点,作为核心靶点。
1.5 通路富集分析
数量庞大的基因、蛋白生物功能注释信息都可通过检索DAVID 数据库[29](https://david.ncifcrf.gov/)获得。将白芍与SLE 的共同靶点录入DAVID 数据库,勾选GO 插件中的生物过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)选项,以及Pathway插件中的KEGG 选项,完成富集分析。提取GO 中P值<0.1、KEGG 中P值<0.05 的结果,经微生信(http://www.bioinformatics.com.cn/)平台绘制气泡图,P值展示为节点颜色变化,气泡大小表示基因数。
2 结果
2.1 白芍活性成分筛选与ADME分析
TCMSP 数据库共检索出白芍相关成分85 个,经OB 和DL 筛选出13 个,查询靶点及相关文献后剔除4个,最终纳入有效活性成分9个,见表1。

表1 白芍活性成分表
2.2 “活性成分-靶点”网络构建
利用靶点预测技术得到80 个相关靶点,经Cytoscap 3.7.2绘制白芍“活性成分-靶点”网络,网络中共存在90 个节点(包含80 个靶点和9 个活性成分)和138 条关系,见图1。节点面积越大表示度值越大,生物学功能和重要性相应提升。

图1 白芍“活性成分-靶点”网络图
2.3 疾病相关靶点获取
检索TTD、OMIM、GeneCards、DrugBank、CTD 数据库,分别得到疾病靶点133、545、29、67、100 个,汇总去重后共计793 个。绘制Venn 图,见图2,可视化展示二者交集,可见白芍治疗SLE的潜在靶点有20个。

图2 白芍治疗SLE的潜在靶点Venn图
2.4 PPI网络构建和关键靶点分析
利用BisoGenet插件分别构建白芍和SLE的PPI网络,发现白芍可通过2 989 个靶点发挥作用,其间相互关系达70 169 条;SLE 潜在靶点有7 476 个,关联达176 712条,二者交集网络见图3。

图3 白芍与系统性红斑狼疮的PPI交集网络
为进一步扩充节点连接信息、提升传递效率、明确关键作用靶点,对PPI网络进行了2次拓扑属性筛选,得到关键靶点278个,筛选策略和最终结果见图4~5。
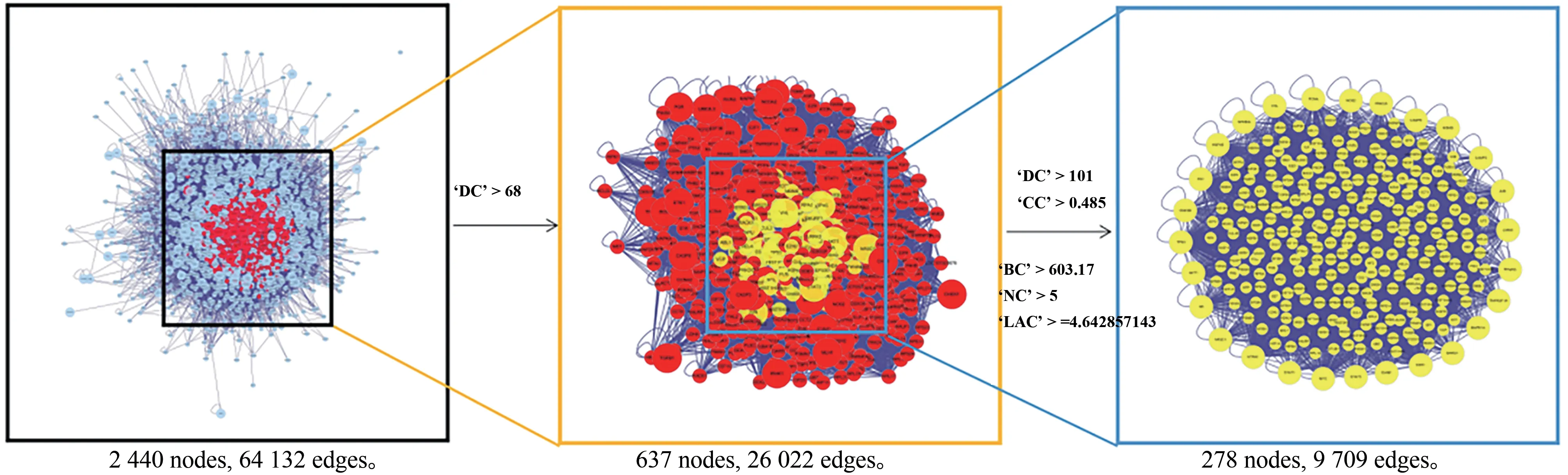
图4 白芍干预SLE关键节点的筛选策略
2.5 白芍“活性成分-靶点-疾病”生物学功能和通路分析
运用DAVID 数据库进行富集分析,并根据所涉及的信号通路推测潜在作用机制。取GO 富集BP 模块中P值<0.1、KEGG 中P值<0.05 的结果绘制气泡图,结果见图6。其中,横轴为通路基因在总体中所占的比率,纵轴为富集名称,气泡颜色由红到绿表示-log10(P)值依次减小,气泡大小代表该通路所包含的基因数。
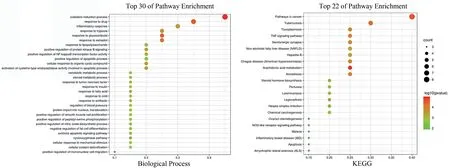
图6 白芍治疗系统性红斑狼疮作用靶点富集分析气泡图

图5 白芍核心靶点PPI网络
GO 富集得到127 个结果,其中BP 94 个,CC 6 个,MF 27 个,KEGG 富集得到34 条通路。分析结果提示:白芍调控SLE主要涉及炎症反应、转录因子调控、细胞因子合成、氧化应激抵抗、激素药物反应和细胞增殖、分化、凋亡等生物学过程,以及TNF、花生四烯酸代谢、Nod 样受体(NOD-like receptor signaling pathway,NLR)、Toll 样受体(toll-like receptor signaling pathway,TLR)、癌症、细菌感染、激素合成等多条信号通路。
2.6 “成分-靶点-通路”网络构建
根据KEGG 及其映射的显著差异基因,构建“成分-靶点-通路”网络,包括22条信号通路、17个基因靶点、7个成分和119条关系,见图7。据图推测,白芍干预SLE 的关键靶基因可能为Degree 值较大的TNF、CASP3、IL6、CASP8、TGFB1、NOS2。
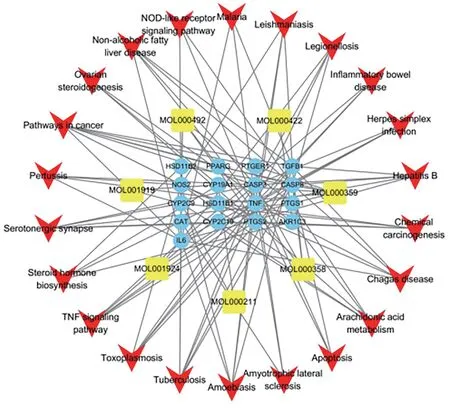
图7 “成分-靶点-通路”网络图
3 讨论
SLE 可归属“痹病”“阴阳毒”“红蝴蝶疮”等范畴[30]。临床医家多认为SLE 证属本虚标实,毒蕴血瘀是病理关键,故以扶正祛邪为治疗大法[31]。白芍是毛茛科植物芍药的干燥根,性微寒,味苦而酸,入肝、脾经,可养血柔肝止痛、敛阴平抑肝阳,是风湿免疫病组方常用中药。药理学研究证实[32],白芍具有明显的抗炎、镇痛、保肝、抗氧化等功效。临床从气、血、水辨治SLE,取白芍滋阴利水、扶脾胃、解药毒之效,疗效确切[33]。网络药理学与中医整体观念高度重合,故笔者选用这一方法探索白芍治疗SLE的起效机制。
本研究共筛选出芍药苷、儿茶素、山柰酚在内的白芍核心成分9 个,涉及60 个靶点,富集结果分布在NF-κB、TNF、Toll 样受体、Nod 样受体及花生四烯酸代谢、癌症、雌激素等信号通路,充分展现出了白芍多成分、多靶点、多通路治疗SLE的特点。
研究显示[34-35],芍药苷可通过NF-κB和ERK通路相关机制阻碍TNF-α 诱导趋化因子的产生和白细胞迁移,从而发挥体外抗炎作用;还可抑制免疫调节因子及组织蛋白mRNA表达、调节细胞免疫以治疗疾病[36];同时能促进骨髓造血以增强免疫功能[37],与扶正固本的中医思想不谋而合。目前广泛应用的白芍总苷复合制剂含40%以上芍药苷成分,具有抗炎和双向免疫调节等作用[38-39],且疗效温和、适用性强、安全性佳,已成为临床优选用药方案[40-41]。儿茶素凭借对Th17/Treg特异性转录因子ROR-γt mRNA/Foxp3 mRNA 表达的双重调节作用,使机体恢复免疫平衡状态[42]。山柰酚可使免疫抑制细胞Treg 活化,实现免疫耐受和免疫稳态[43]。
根据富集结果推测白芍治疗SLE 的起效机制,可概括为以下两种:
(1)直接调控TLRs、NLRs、NF-κB、TNF 等信号通路。TLRs通路以NF-κB活化和免疫应答基因转录为主,TLR 属于模式识别受体(pattern recognition receptor,PRR),可特异性识别病原体并启动炎症信号通路[44]。研究发现[45-46],B 细胞中固有的TLR7 缺失可抑制自身免疫;相反TLR9缺失则促使免疫复合物(IC)沉积,加剧系统性炎症;TLR9激活是SLE常见并发症狼疮肾炎发生的重要原因[47]。多效应细胞因子TNF-α由T 细胞和单核-巨噬细胞分泌,通过影响机体免疫应答参与SLE 发病过程[48];还能加剧组织相容性抗原之间的免疫反应,导致疾病进展[49]。NLR 家族同属天然免疫PRR,在病原和损伤相关分子模式的识别中举足轻重[50]。家族中的NOD 蛋白和配体结合后,可通过下游受体蛋白的相互作用激活NF-κB 通路,诱导促炎细胞因子及趋化因子转录上调,介导炎症反应[51-52],还能催化凋亡相关细胞因子的表达以及参与1 型糖尿病等适应性免疫反应的启动[53]。白芍或许能直接调控上述通路,从而改善SLE。
(2)间接调控信号通路和多系统代谢靶点。花生四烯酸通过COX 酶代谢生成前列腺素,引起疼痛、血管扩张(肿胀和红肿)和发热等症状[54-55];5-LO 酶与激活蛋白结合推动花生四烯酸转化形成白三烯,促使中性粒细胞趋化[56]。雌激素促炎和抗炎双向作用分别由受体ER-α、β介导,其表达量分别同SLE患者病情活动度呈正、负相关[57]。雌激素可选择性激活或抑制miR-145、miR-125a和miR-146a等SLE相关miRNA,影响基因表达[58]。白芍可能通过干预上述通路,间接发挥对SLE的治疗作用。
另外GO 富集分析网络覆盖细胞色素P450 酶代谢、细胞凋亡、神经营养、脂肪细胞因子和卵巢类固醇合成、癌症、肌萎缩侧索硬化症、2 型糖尿病等信号通路,说明白芍可调控多个系统和多种代谢途径靶点,从而影响自身免疫状态、干预SLE病理过程。
4 结语
本研究基于网络药理学技术,拟深挖白芍物质基础和对SLE 的起效机制,研究结果与已知文献报道吻合,验证了靶点预测技术的准确性,也为中医新药研发、临床应用及后续研究提供了新的依据。但囿于这一手段的局限性和机体反应的非单一性,仅就白芍的药理成分进行预测探讨,具体机制仍需进一步挖掘和验证。

