基于倾向性评分匹配的血清维生素A、D、E 水平与早产儿早发型败血症的关系
张寅英 纪小艺 李 晔
1.浙江省嘉兴市妇幼保健院临床药学室,浙江嘉兴 314000;2.浙江省嘉兴市妇幼保健院儿科,浙江嘉兴 314000
新生儿早发型败血症(early-onset sepsis,EOS)是新生儿出生72 h 内发生的全身感染性疾病,可伴或不伴菌血症[1],全球每年超过300 万新生儿发病[2]。EOS起病隐匿,临床表现无特异性,且进展迅速,严重感染可使新生儿死亡率增加9%~20%[3]。
维生素A(vitamin A,Vit A)、Vit D 和Vit E 均为脂溶性维生素,其代谢物是几种转录因子的重要配体,参与机体免疫调节[4]。已有研究表明,Vit D 缺乏可能会增加儿童败血症的风险[5],但关于血清Vit A、Vit D、Vit E 水平与早产儿EOS 之间关系的研究较少。本研究以早产儿EOS 为研究对象,通过倾向性评分匹配(propensity score matching,PSM)均衡组间混杂因素,探讨早产儿血清Vit A、Vit D、Vit E 水平与EOS之间的关系,以期为疾病早期预防、诊断和治疗提供依据。
1 资料与方法
1.1 一般资料
选取2019 年1 月至2020 年12 月浙江省嘉兴市妇幼保健院收治的54 例诊断为EOS 早产儿为EOS组。另设127 名同期未发生败血症的早产儿为对照组。本研究为非干预性的回顾性研究,经浙江省嘉兴市妇幼保健院伦理委员会同意免除伦理审查。
纳入标准:①胎龄≤35 周;②生后24 h 内入院并完善血清Vit A、25-羟基维生素D[25-hydroxylvitamin D,25(OH)Vit D]、Vit E 检测;③获得监护人知情同意;④病例资料完整。排除标准:①严重先天遗传代谢疾病,畸形或合并肝、肾、甲状腺功能异常;②孕母存在肝、肾、甲状腺功能异常,骨代谢疾病或服用抗惊厥、癫痫、结核病药等。
1.2 研究方法
1.2.1 数据收集 收集入组对象的母婴一般资料,包括早产儿性别、单双胎、出生胎龄、出生体重、出生季节、Apgar 评分;孕母年龄、体重指数(body mass index,BMI)、生产方式、胎膜早破情况、妊娠并发症情况等。血清维生素水平数据为早产儿出生24 h 内的外周血样本,采用质谱分析法检测所得。
1.2.2 诊断标准 新生儿EOS 诊断标准符合《新生儿败血症诊断及治疗专家共识(2019 年版)》[6]。参考相关协会标准[7-8],将Vit A<200 ng/ml、25(OH)Vit D<20 ng/ml、Vit E<5 μg/ml 分别定义为Vit A、Vit D、Vit E 缺乏。
1.3 统计学方法
采用SPSS 22.0 软件进行PSM 和数据分析,采用最邻近匹配法进行1∶1 的PSM,logistic 回归计算倾向性评分,匹配容差为0.02。符合正态分布的计量资料用均数±标准差(±s)表示,两组间比较采用t 检验;不符合正态分布的采用中位数(M)和四分位数(P25,P75)表示,两组间比较采用Mann-Whitney U 检验。计数资料用例数或百分率表示,组间比较采用χ2检验或Fisher 确切概率法。logistic 回归分析早产儿EOS与维生素水平的关系。以P <0.05 为差异有统计学意义。
2 结果
2.1 PSM 前后两组一般资料比较
PSM 前两组出生体重、胎龄、出生季节、1 min 及5 min Apgar 评分比较,差异有统计学意义(P <0.05);PSM 后共有33 对匹配成功,两组一般资料比较,差异无统计学意义(P >0.05)。见表1。
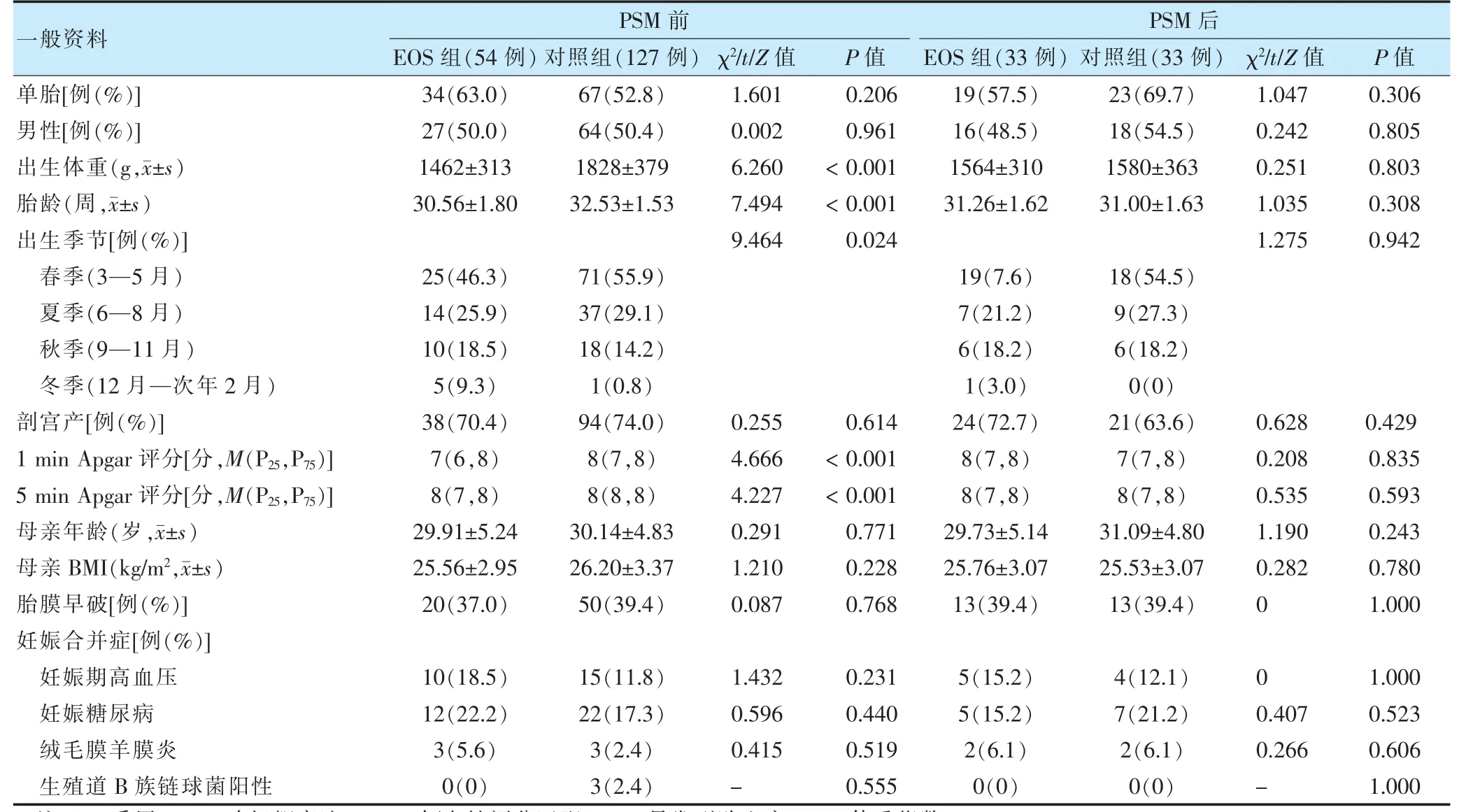
表1 PSM 前后两组一般资料比较
2.2 PSM 后两组维生素水平比较
两组血清Vit A、Vit E 水平比较,差异无统计学意义(P >0.05);EOS 组血清25(OH)Vit D 水平低于对照组,差异有统计学意义(P <0.05)。见表2。
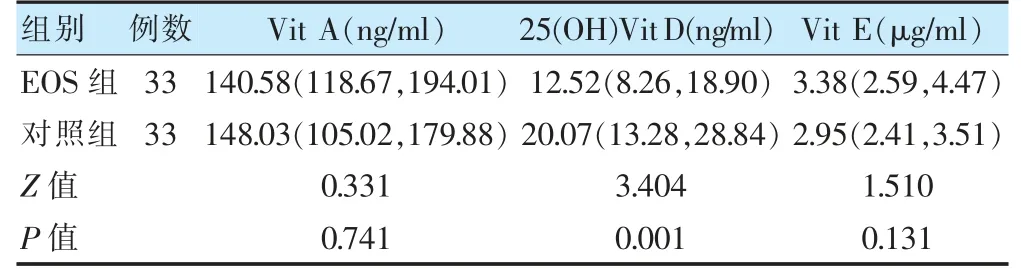
表2 PSM 后两组维生素水平比较[M(P25,P75)]
2.3 PSM 后两组维生素缺乏率比较
两组血清Vit A、Vit E 缺乏率比较,差异无统计学意义(P >0.05)。EOS 组血清25(OH)Vit D 缺乏率高于对照组,差异有统计学意义(P <0.05)。见表3。
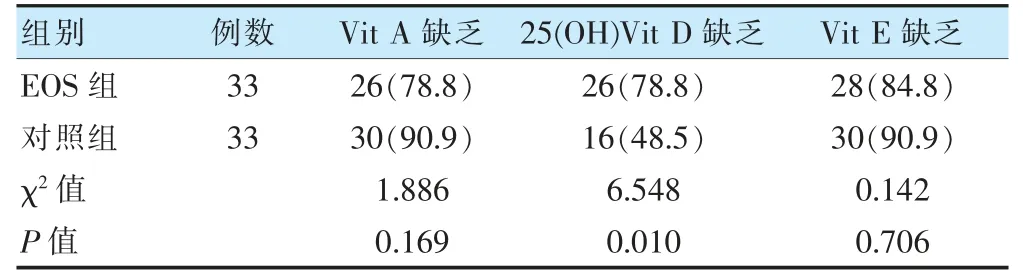
表3 PSM 后两组维生素水平及缺乏率比较[例(%)]
2.4 logistic 回归分析血清维生素水平对EOS 的影响
以25(OH)Vit D、Vit A、Vit E 水平为协变量,EOS为因变量(0=是,1=否)进行二元logistic 回归,结果显示,校正Vit A、Vit E 的干扰后,高水平25(OH)Vit D是早产儿EOS 发生的保护因素(β=-0.143,Wald χ2=9.96,OR=0.867,95%CI:0.793~0.947,P=0.002)。
3 讨论
虽然随着产科和新生儿护理水平的提高,EOS 发病率已较前降低,但其仍是新生儿死亡的重要原因,约占全球五岁以下儿童死亡率的46%[9]。EOS 的病因涉及母婴多方面因素,包括男性、早产、低出生体重、低Apgar 评分,母亲器械分娩、B 族链球菌定植、胎膜早破和绒毛膜羊膜炎等[10]。PSM 是一种可实现在协变量分布均衡的匹配组内进行效应值分析的统计学方法[11]。本研究将上述已知的可致EOS 的风险因素作为协变量进行PSM 以排除干扰。结果显示,PSM 后两组母婴基线资料实现了均衡化,具有可比性。
25(OH)Vit D 是体内Vit D 的主要贮存形式,可稳定反应体内Vit D 的水平,故临床上常以25(OH)Vit D 水平表征机体Vit D 的营养状态[12]。本研究结果显示,EOS 组25(OH)Vit D 水平明显降低,且低水平25(OH)Vit D 是早产儿EOS 的独立危险因素,这与Singh 等[13]对足月儿EOS 与VitD 水平相关性的研究结果一致。提示对于早产儿,Vit D 缺乏可能同样与EOS 的发生有关。已有研究表明,Vit D 可刺激增强物理上皮屏障连接的基因[14];诱导编码抗菌肽和防御素的基因表达[15];激活淋巴细胞亚群并增强T 淋巴细胞活化[16];抑制炎症细胞因子表达水平[17],调节先天性和适应性免疫。早产儿本身通过母体获得的免疫球蛋白G 更少,免疫系统较足月儿更不成熟,故低Vit D 水平导致的免疫功能减弱和炎症因子水平增加可能由此进一步加大其EOS 发生的风险。
此外,目前研究认为,Vit A 有抗氧化作用,还能维持黏膜上皮的完整性[18],参与巨噬细胞、中性粒细胞的分化成熟,抑制促炎T 细胞并促进抗炎T 细胞分化,调节细胞和体液免疫[19]。Vit E 也是抗氧化剂,可维持生育与免疫功能[20]。氧化应激介导的细胞损伤是败血症的病理生理学基础[21],虽然Vit A 和Vit E 的抗氧化和免疫调节作用,被认为有可能降低败血症的发生率或改善其临床结局[22-23],但本研究的结果却并未发现其血清水平与早产儿EOS 有关。这可能与研究样本量太小及PSM 后部分数据丢失导致的结果偏倚有关。另外可能的解释是:一方面,血液中与细胞内的抗氧化剂水平不能等同,危重疾病可能会导致体内抗氧化剂的重新分布[24];另一方面,血液中的抗氧化剂既可直接清除自由基,又可提高红细胞清除过氧化氢的能力,由此反而可能削弱血液的杀菌潜力[25],增大败血症的风险,故血清抗氧化剂对败血症的影响存在争议,低血清抗氧化剂水平可能并不一定会增加败血症的发生。
综上所述,EOS 早产儿血清Vit D 水平明显降低,Vit D 水平是早产儿EOS 发生的重要因素,但并未发现血清Vit A 和Vit E 与早产儿EOS 有关。

