基于网络药理学和代谢组学的苦参乌梅汤对HepG 2.2.15 细胞模型抗乙型肝炎病毒作用机制研究
郑 蕊 郭 朋 刘 宇 孔 伟 陈 艳
中国中医科学院西苑医院药学部,北京 100091
乙型肝炎病毒(hepatitis B virus,HBV)在世界范围内广泛流行。持续感染HBV 可引起肝硬化、肝功能衰竭甚至诱发肝癌[1]。据世界卫生组织报道的数据显示,截至2015 年,全球约有2.57 亿人感染HBV[2]。我国属于HBV 中度流行区[3]。目前,我国共有HBV 感染者约8600 万例,人群感染HBV 流行率为5%~6%[4]。鉴于HBV 携带者人群规模较大,开发一种有效抗HBV 药物迫在眉睫。
我国传统中医药为开发有效抗HBV 药物提供了一个重要途径。中国中医科学院西苑医院肝病科在前辈岳美中、关茂会、尚尔寿等老先生长期治疗慢性乙型肝炎经验总结的基础上,用苦参乌梅汤抗HBV 取得了良好的临床疗效。苦参乌梅汤由苦参、乌梅两味中药组成,多年临床实践证实,疏肝健脾治法加用苦参乌梅汤清热利湿养阴,对乙型肝炎患者HBV 标志物乙型肝炎E 抗原(Hepatitis Be antigen,HBeAg)、乙型肝炎病毒基因(Hepatitis B virus gene,HBVDNA)具有显著的干预作用[5]。课题组前期工作研究发现,苦参乌梅汤能够显著抑制HBV 转基因小鼠血清中乙型肝炎表面抗原(Hepatitis Bs antigen,HBsAg)的表达[6-7];体外细胞实验显示,其能抑制HepG 2.2.15 细胞HBsAg、HBeAg 的分泌和HBVDNA的复制[8]。尽管苦参乌梅汤抗HBV 的疗效确切,但尚缺乏其药效作用机制方面的系统研究。
中药及其复方成分复杂,常通过多途径、多靶点协同发挥治疗作用,传统的中药作用机制研究可以整体分析有效成分、生物靶标及代谢物之间的相互作用。网络药理学是在系统生物学理论指导下衍生出的以药物多成分、多靶点为切入点研究中药治疗疾病作用机制的研究学科[9],代谢组学技术是以代谢物组分析为基础,借助高通量检测和多元化数据处理手段,整合多维生物信息系统,阐明中药复方的药效物质基础和作用机制[10]。这两种研究方法符合中医药系统性和整体性的思维模式。张云龙等[11]将网络药理学和代谢组学技术相结合应用于解毒化瘀汤改善阿尔茨海默病(Alzheimer disease,AD)小鼠认知功能的机制的研究,分析实验结果得出,解毒化瘀汤通过调控NMDA/ATPase/AMPK 信号通路上调AD 模型小鼠海马腺苷和肠道Dorea 菌属水平,显著改善AD 模型小鼠的学习、记忆障碍,重塑大脑和肠道的沟通。因此,本研究基于系统生物学的整体观思想,结合网络药理学和代谢组学技术,探究苦参乌梅汤抑制HepG 2.2.15 细胞HBVDNA 的作用机制,为探索中药作用机制提供研究方法和策略。
1 材料与方法
1.1 试剂与仪器
DIONEX Ultimate 3000 超高效液相色谱仪、Thermo Q Exactive 质谱仪(Themo Fisher 公司);十万分之一电子天平(XP-205 型,Mettler Toledo公司);离心机(Allegra X-30R 型,美国Beckman 公司);-80℃冰箱(Thermo Fisher 公司);超纯水仪(Milli-Q Advantage A10型,美国Millipore公司);超声波清洗器(KQ-250型,昆山市超声仪器有限公司);CO2培养箱(Thermo Forma 3111 型,Thermo Fisher公司)。
HepG 2.2.15 细胞株(广州吉妮欧生物科技有限公司);DMEM 培养基(HyClone 公司);精品胎牛血清、G418、胰酶(Solarbio 公司);苦参饮片(批号:1806011,厂家:河北百草康神药业有限公司);乌梅饮片(批号:1806012,厂家:河北百草康神药业有限公司);乙腈(LC/MS 级,Merck 公司)、甲醇(色谱级,Merck 公司);甲酸(色谱级,CNW 公司);其他试剂均为市售分析纯;实验用水为屈臣氏蒸馏水。
1.2 研究方法
1.2.1 苦参乌梅汤的制备
称取苦参、乌梅饮片各400 g,加水煎煮两次,每次30 min,煎液滤过,滤液合并,以离心半径12 cm、3500 r/min 离心20 min,上清减压浓缩至0.5 g/ml,再以离心半径12 cm、20000 r/min 离心30 min,去除残渣,上清液冷冻干燥,得浸膏粉(每克含生药5.78 g),置干燥器中备用。
1.2.2 细胞培养及给药
配制混合高糖培养基(含10%胎牛血清、400 μg/ml G418、1%青霉素、链霉素),将HepG 2.2.15 细胞接种其中,置于37℃,5%CO2培养箱中培养。取对数生长期的细胞,按照1×106/ml 接种于96 孔板中,每孔100 μl,培养箱孵育24 h;细胞贴壁后,弃上清液,给药组分别加入含有不同药物浓度(156、313、625、1250、2500 μg/ml)的完全培养基,空白组加入等量完全培养基,每组3 个复孔,继续培养12 h;弃上清液,每孔加入10% CCK-8 完全培养基,继续培养2 h。每个孔的吸光度值(OD)在450 nm 下测量[12]。计算细胞存活率,以最大无毒剂量应用于后续实验。HepG 2.2.15 细胞长满培养瓶后,取出,胰酶消化2 min,弃去消化液,加培养液轻轻吹打。细胞数调整为6×105/ml,接种于6 孔板,每孔2 ml,37℃,5% CO2培养;细胞贴壁后,给药组加入最大无毒剂量的药物,空白组加入等量培养基,培养48 h,收集样品。
1.2.3 样品收集与处理
细胞培养完成后,收集上清液,采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)测定HBVDNA 拷贝数。收集细胞,加入500 μl 含0.1%甲酸的甲醇-水(1∶1)反复吹打,超声破碎细胞,以离心半径13.5 cm、10 000 r/min 离心10 min 后上清液50 μl 加入450 μl 沉淀剂(甲醇∶乙腈=1∶1)沉淀蛋白,涡旋20 s,4 ℃下静置10 min,以离心半径13.5 cm、10 000 r/min 离心10 min 后,取5 μl 进样,进行UPLC/LTQ-Orbitrap-MS 分析。
1.2.4 代谢组学检测
1.2.4.1 色谱条件 色谱柱ACQUITY UPLC BEH C18(50 mm×2.1 mm,1.7 μm,Waters 公司);流动相A 为水溶液(含2 mmol/l 甲酸铵和0.1%甲酸),B 为乙腈。梯度洗脱:0~1 min,5% B;1~5 min,5%~60% B;5~8 min,60%~100% B;8~11 min,100% B;11~14 min,100%~60% B;14~15 min,60%~5% B;15~18 min,5%B。流速0.25 ml/min,样品室温度保持在4℃,柱温40℃,进样量5 μl。
1.2.4.2 质谱条件 离子源为ESI(±)源,负离子检测模式,喷雾电压2.80 kV,正离子检测模式,喷雾电压3.50 kV,离子传输管温度350℃,S-lens 电压50%,离子源温度350℃,鞘气流速35 arb,辅助气流速10 arb,吹扫气流速1 arb。
1.2.5 代谢组学数据处理
利用Trace Finder 软件自行建立数据库对UPLC/LTQ-Orbitrap-MS 数据进行预处理,获得保留时间-质荷比、分子量、观察量(样本)和峰强。利用Metabo-Analyst 4.0 软件将编辑后的数据矩阵进行过滤及归一化后,进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA),筛选OPLS-DA 分析中VIP 值>1 的化合物,利用MetaboAnalyst 4.0 软件和京都基因和基因组数据库(Kyoto encyclopedia of genes and genomes,KEGG)网站进行相关的代谢通路分析。
1.2.6 生物靶标的网络构建
分别以“苦参”“乌梅”为检索词,在中医药综合数据库(traditional Chinese medicine integrated database,TCMID)数据库检索各中药的主要活性成分,筛选口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18 的活性候选成分,并获取其相应的靶点,同时删除不含有靶点的活性成分。将筛选的化合物导入PubChem 数据库,转化为对应的SMILES 文件,并输入到Swiss Target Prediction 数据库,筛选其中Probability*>0.12 的靶标作为中药活性成分对应的潜在作用靶点。通过GeneCard 数据库、OMIM 数据库和DisGeNET 数据库获取乙型肝炎相关疾病靶标。使用Cytoscape 3.7.2 软件绘制苦参乌梅汤治疗乙型肝炎的“药物-成分-靶点-疾病”网络图[13]。通过DAVID 数据库将网络图中筛选出来的核心靶点进行基因本体(gene ontology,GO)功能和KEGG 通路富集分析,选择物种“Homo sapiens”,筛选出苦参乌梅汤治疗乙型肝炎的潜在信号通路。GO 富集分析包括分子功能(molecular function,MF)、生物过程(biological process,BP)和细胞组分(cellular components,CC)三个部分。
2 结果
2.1 基于HepG 2.2.15 细胞的苦参乌梅汤抗HBV 研究
不同浓度苦参乌梅汤(156、313、625、1250、2500 μg/ml)作用于HepG 2.2.15 细胞后,细胞存活率分别为(99.2±3.7)%、(89.4±8.4)%、(78.5±5.8)%、(71.2±4.1)%和(63.5±5.0)%。与空白组比较,1250 μg/ml 组和2500 μg/ml 组细胞存活率更低,差异有统计学意义(P <0.05),见图1A。与空白组比较,2500 μg/ml 组HBVDNA 含量更低,差异有统计学意义(P <0.05),见图1B。因此,本研究选择无毒剂量下具有显著抗HBV 作用的剂量2500 μg/ml 进行苦参乌梅汤抗HBV 作用的代谢组学研究。

图1 苦参乌梅汤对HepG 2.2.15 细胞的细胞毒性及HBVDNA 含量的影响
2.2 苦参乌梅汤抗HBV 的代谢组学研究
PCA 分析,空白组与给药组有效分离,且相同给药组数据聚集性较好(图2A);OPLS-DA 分析(图2B),基于VIP>1.0,| P(corr)|≥0.5 且(P <0.05,| log2FC |>0)的标准,筛选出组间具有显著性差异的代谢物40 个,见表1。从KEGG 中得到40 种差异代谢物进行代谢通路分析(图3),将影响值>0.10 且-log(P)>2 的代谢通路作为潜在的靶标代谢通路,发现这些代谢物主要影响苯丙氨酸、酪氨酸和色氨酸生物合成、苯丙氨酸代谢、鞘脂代谢、精氨酸和脯氨酸代谢等代谢途径。

图2 正、负离子模式下的多元统计分析

图3 差异代谢物相关代谢通路

表1 潜在生物标志物
2.3 苦参乌梅汤抗HBV 的生物靶标网络分析
苦参、乌梅中符合条件(OB≥30%,DL≥0.18)的化合物共78 个,潜在靶点416 个。乙型肝炎相关的靶点976 个,两者取交集,最终获得苦参乌梅汤候选活性成分的潜在治疗乙型肝炎靶点共115 个。苦参乌梅汤治疗乙型肝炎的“药物-成分-靶点-疾病”网络图见图4。degree 值排名前3 位的活性成分分别是kusukactone(苦参内脂)、kosamolA(考萨莫A)、kaempferol(山奈酚),可认为是苦参乌梅汤治疗乙型肝炎的关键成分。苦参乌梅汤治疗乙型肝炎的115 个靶点蛋白质-蛋白质相互作用网络见图5,degree 值排名前5 位的靶点依次为:蛋白激酶B、人体表皮生长因子受体、原癌基因酪氨酸蛋白激酶Src、肿瘤坏死因子和血管内皮生长因子A,可认为是靶点互作网络中的关键靶点。GO 功能共富集到679 个条目,包括BP 2162个,主要涉及氧化应激反应、肽基酪氨酸磷酸化、肽基酪氨酸修饰等方面;CC 56 个,涉及膜筏、膜微区、膜区、转移酶复合物等;MF 133 个,涉及蛋白丝氨酸/苏氨酸激酶活性、蛋白酪氨酸激酶活性、磷酸酶结合、激素受体结合等。排在前20 位的富集条目进行可视化分析,见图6。KEGG 通路富集分析中,P 值排名前20 位的通路主要有PI3K-Akt、乙型肝炎、卡波西氏肉瘤相关疱疹病毒感染等信号通路,见图7。
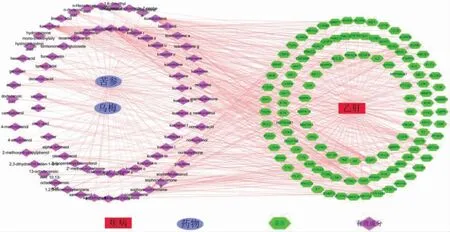
图4 “药物-成分-靶点-疾病”网络图

图5 蛋白质-蛋白质相互作用网络图
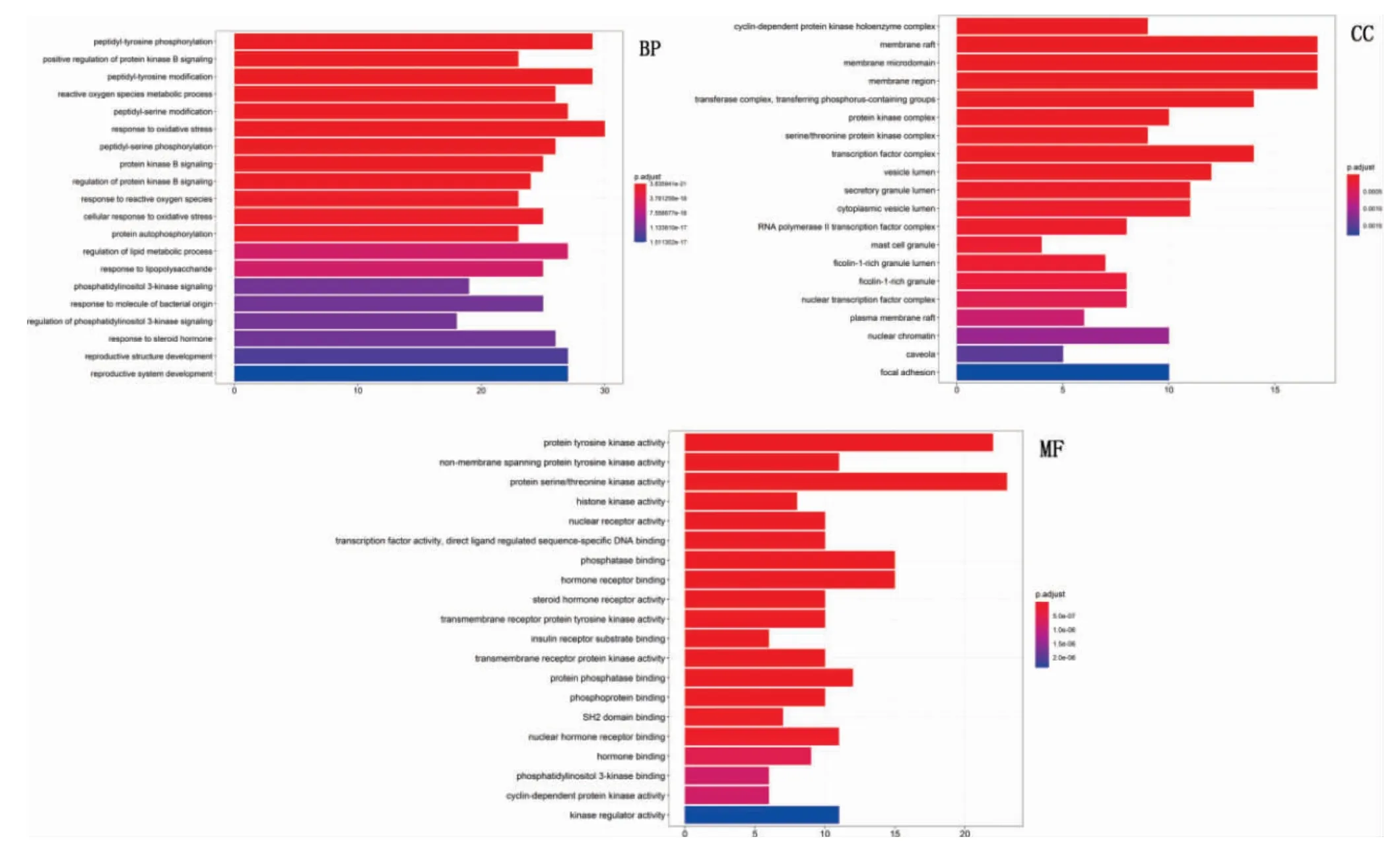
图6 基因本体富集分析
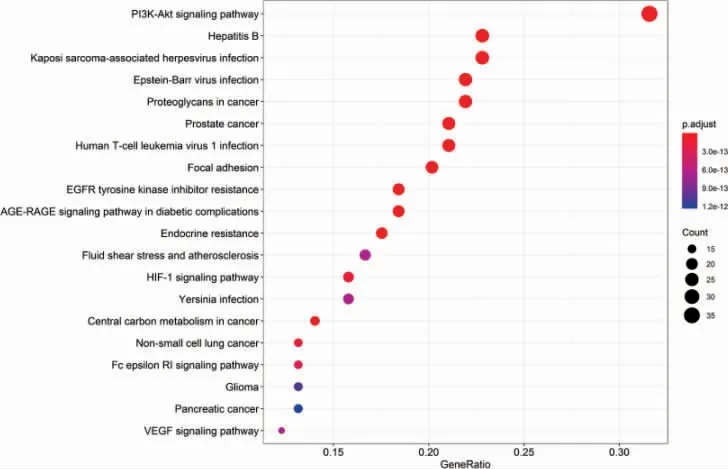
图7 京都基因和基因组数据库富集分析
3 讨论
HBV 感染是病毒与宿主细胞之间进行相互作用的复杂过程,HBV 的复制和表达依赖宿主细胞的能量和代谢过程[14-16]。本研究结果显示,苦参乌梅汤能够显著抑制HepG 2.2.15 细胞分泌HBVDNA,对HepG 2.2.15 细胞代谢物具有显著的调节作用。因此,推断中药干预后影响了宿主细胞的代谢,进而抑制HBV 的表达和复制。
磷脂是组成生物膜的主要成分,参与信号传导等过程。有研究表明,HBV 感染能引起小鼠肝脏中磷脂酰胆碱的组成发生改变[17],同时,HBV 感染的HBsAg阳性患者血清中鞘磷脂的含量显著降低[16],由此推断磷脂在HBV 感染和复制及致病的过程中发挥重要作用。本研究代谢组学结果显示,苦参乌梅汤干预HepG 2.2.15 细胞能够显著回调部分差异代谢物鞘磷脂的含量,调节鞘脂代谢通路。
氨基酸是蛋白质的重要组成部分,氨基酸代谢在氨基酸的生物合成和代谢中发挥着重要作用,是细胞增殖、生存和发育的必经途径[18-19]。苯丙氨酸是人体必需的芳香族氨基酸之一,在正常情况下可以作为氨基酸残基在人体组织细胞中参与合成各种蛋白质,可在肝脏中产生酪氨酸,而酪氨酸可促进某些酶、激素和神经递质的分泌[20],苯丙氨酸代谢的稳定状态有助于人体正常生长发育和生理机能的维持[21]。本研究显示,苦参乌梅汤干预HepG 2.2.15 细胞后,L-苯丙氨酸水平显著降低,提示其可通过作用于苯丙氨酸、酪氨酸和色氨酸的生物合成及苯丙氨酸代谢通路发挥抗HBV 的作用。
此外,本研究采用网络药理学方法构建“中药-成分-靶点-疾病”相互作用网络,该网络的关键作用靶点有蛋白激酶B、人体表皮生长因子受体、原癌基因酪氨酸蛋白激酶Src、肿瘤坏死因子和血管内皮生长因子A 等,所富集的关键相关通路为PI3K/Akt,是调节细胞增殖、凋亡、分化和葡萄糖转运等功能的重要通路[22-24],代谢组学筛选出组间具有显著性差异的代谢物40 个,其中包括葡萄糖含量显著改变,与网络药理学结果相吻合。研究表明,HBV 感染患者随着病情的不断发展,其肝脏损伤会不断加重,进而影响其机体葡萄糖代谢,容易出现血糖升高,诱发糖尿病[25-26]。因此,网络药理学与代谢组学的联用,对中药干预的机体代谢组群进行整合分析,更有益于揭示中药治疗疾病机制[27-29]。
综上所述,本研究采用代谢组学和网络药理学相结合的策略,更加全面地解释了苦参乌梅汤在抗HBV 方面的可能机制。该方法为进一步研究中药抗HBV 潜在的治疗靶点提供线索,为药物作用机制研究与阐释提供了新思路。

