内镜下钳夹活检诊断胃息肉病变性质及与病理诊断的差异
杨 宏,周 敏,王治东,任宏飞,张铭光
四川大学华西医院消化内科,四川 成都610041
临床大部分胃息肉属于良性病变且在早期并无明显临床症状,但个别类型的胃息肉癌变风险较高,当胃黏膜进一步发展为糜烂、溃疡时会表现出相应的不适症状,影响患者的生活质量[1-2]。在胃息肉的病理分型中,腺瘤性息肉的癌变风险最高,仅次于慢性萎缩性胃炎,且可与胃癌共存,因此一经发现胃息肉,应进行及时的诊疗[3-4]。内镜下钳夹活检术是目前用于胃息肉病变性质诊断的常用方法,但国内外相关研究报道,内镜下钳夹活检术因获得的标本微小,并不能提供完整的病变信息,其病理诊断结果与内镜下切除术后病理诊断结果并非完全一致[5-6]。随着内镜技术的不断发展完善,诸多内窥镜技术如圈套高频电切术、内镜下黏膜切除术、剥离术等逐渐被应用于胃息肉的临床诊疗,临床以内镜下电切术后获得的组织学结果作为诊断胃息肉的“金标准”[7]。现有研究均表明内镜下钳夹活检诊断胃息肉病变性质及与病理诊断的存在差异性,但对于具体影响内镜下钳夹活检诊断与病理诊断胃息肉差异的影响因素并无系统性的研究结果,且研究结论存在争议性:有研究发现胃息肉大小≥15 mm是活检钳低估病变性质的独立预测因素[8],而有研究表明胃息肉大小与诊断一致率之间并无明显相关性[9]。基于此,本研究对内镜下钳夹活检诊断胃息肉病变特征进行分析,并探究影响内镜下钳夹活检诊断与病理诊断胃息肉差异的影响因素,结果总结如下。
1 资料与方法
1.1 一般资料
选取2021年2月~2022年2月于本院行内镜下钳夹活检诊断及内镜下胃息肉切除术患者的临床资料进行回顾性分析。纳入标准:均于本院行胃息肉活检夹术及内镜下电切术;胃息肉直径≥0.5 cm;生命体征平稳者;内镜下钳夹活检诊断及内镜下胃息肉切除术的病例诊断结果完整。排除标准:合并遗传性胃息肉、P-J综合征者;合并胃癌者;合并胃出血者。本研究最终共纳入145例患者,其中男57例,女88例,年龄28~74(51.33±11.57)岁。本研究经医学伦理学审查通过。
1.2 研究方法
所有患者均行内镜下钳夹活检,记录内镜下胃息肉部位、数量、山田分型以及形态,利用活检钳评估息肉大小,并在每个息肉表面黏膜可疑处夹取2~4块组织送检。待明确病理检查结果后,依据胃息肉病变特征选择合适的内镜下切除术进行治疗,并对切除后的息肉组织进行病理学化验,参考《诊断病理学》[10]对胃息肉进行组织学评价与分类,记录病理诊断结果并进行分析比较。
1.3 统计学分析
利用SPSS22.0软件进行数据分析,采用Kappa指数进行一致性检验,Kappa指数≥0.75表示一致性良好,Kappa指数<0.4表示缺乏一致性,0.4≤Kappa指数<0.75表示一致性尚可;计数资料以n(%)表示,组间比较行卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 内镜检查结果及特征形态分析
145例患者中单发息肉124例(85.52%),多发息肉21例(14.48%),共检出171枚息肉,其中61枚(35.67%)位于胃体,68枚(39.77%)位于胃窦,32枚(18.71%)位于胃底,10枚(5.85%)位于贲门。息肉大小0.5~0.9 cm的106枚(61.99%),1.0~1.9 cm的51枚(29.82%),≥2.0 cm的14枚(8.19%)。山田分型Ⅰ型21枚(12.28%),Ⅱ型87枚(45.03%),Ⅲ型58枚(33.92%),Ⅳ型5枚(8.77%)(表1)。
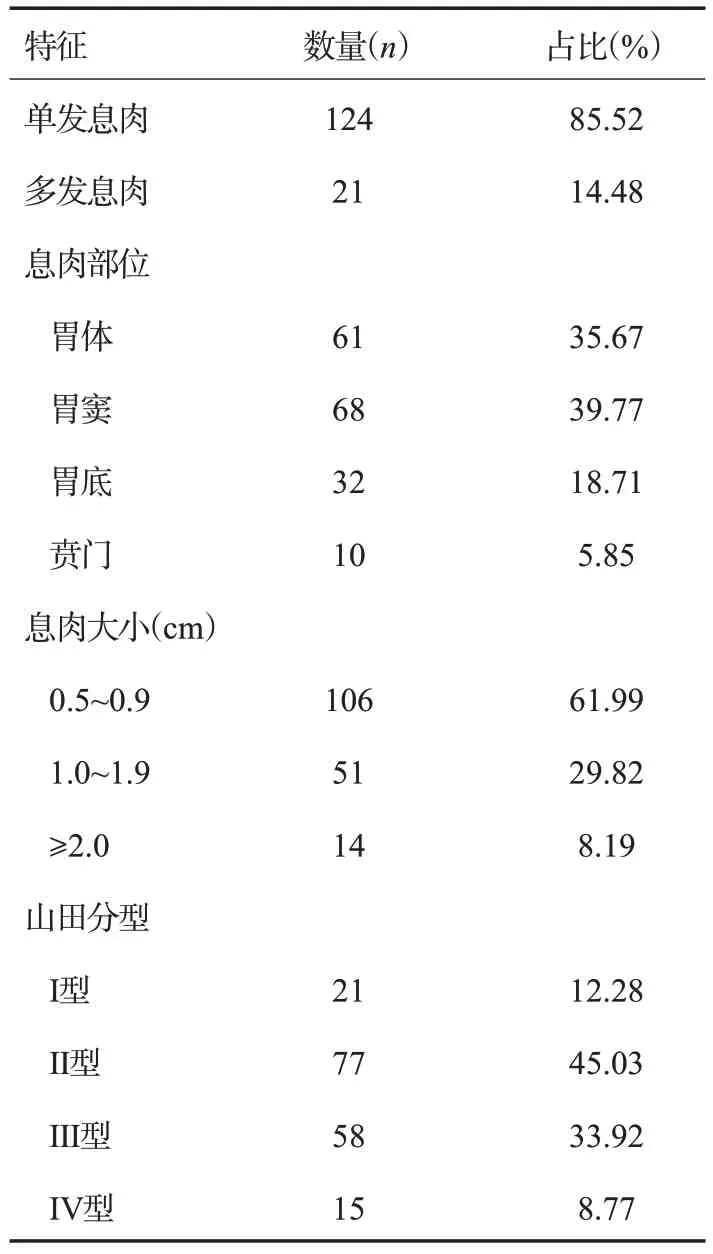
表1 胃息肉内镜下特征Tab.1 Endoscopic features of gastric polyps
胃息肉患者胃底皱襞呈脑回状,黏膜光滑,粘液呈湖清亮;十二指肠降部黏膜光滑,未见溃疡及新生物;胃体粘膜呈橘红色,胃黏膜下静脉清楚;胃窦粘膜红白相间,红疹样变(图1)。
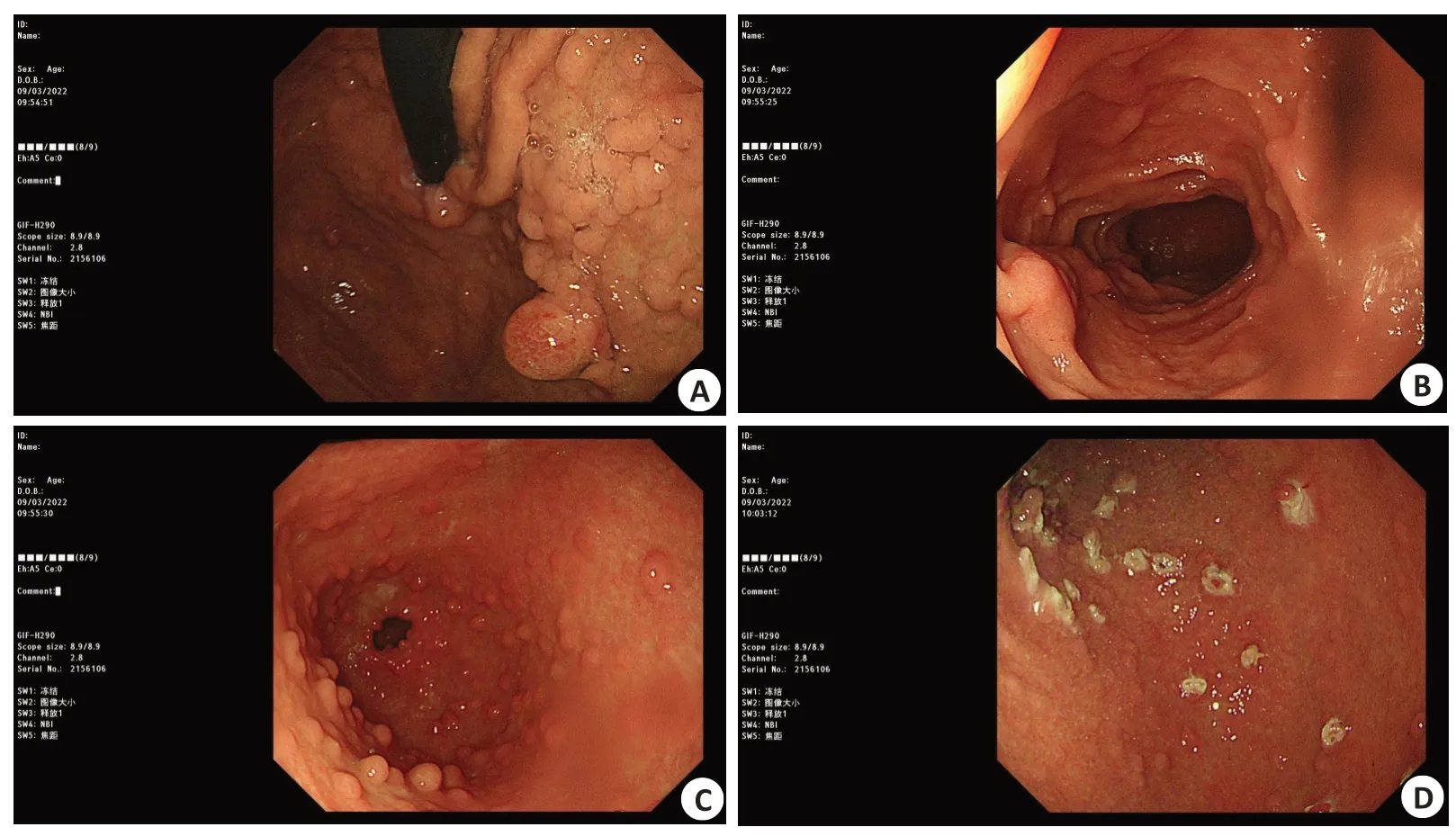
图1 胃息肉内镜下形态Fig.1 Endoscopic morphology of gastric polyps.
2.2 内镜下钳夹活检诊断与电切术后病理学诊断结果比较
在171枚息肉中,内镜下钳夹活检诊断与电切术后病理学诊断结果一致的共119枚(69.59%),不一致的共52枚(30.41%)。两种诊断的病理学诊断结果经Kappa一致性检验,所得Kappa值为0.182,差异有统计学意义(P<0.05,表2)。
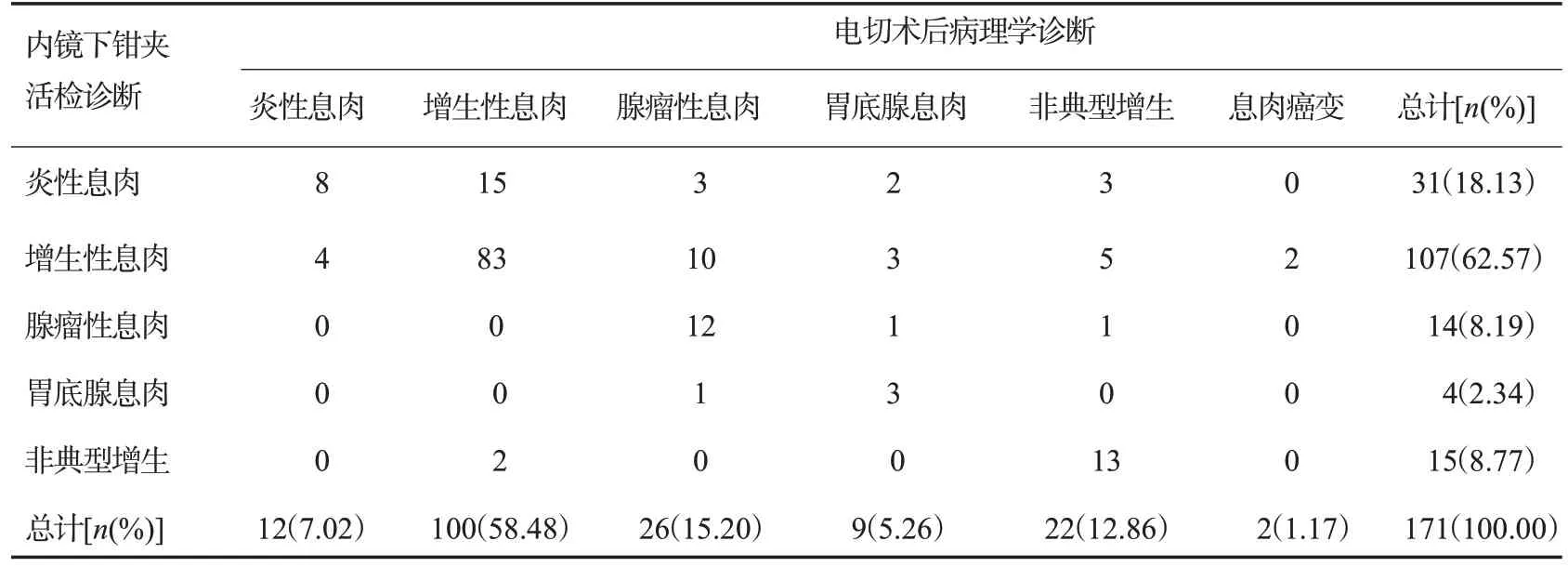
表2 内镜下钳夹活检诊断与病理学诊断结果的一致性检验Tab.2 Consistency test of endoscopic clamp biopsy diagnosis and pathological diagnosis(n)
2.3 内镜下钳夹活检与电切术后病理学诊断间组织学差异的单因素分析
单因素分析结果显示,年龄≥60岁患者的病理诊断不一致率高于年龄<60岁患者,息肉大小≥2.0 cm患者的诊断不一致率明显高于息肉大小0.5~0.9 cm和1.0~1.9 cm的患者,差异有统计学意义(P<0.05)。患者性别、息肉部位、山田分型病理诊断结果差异无统计学意义(P>0.05,表3)。
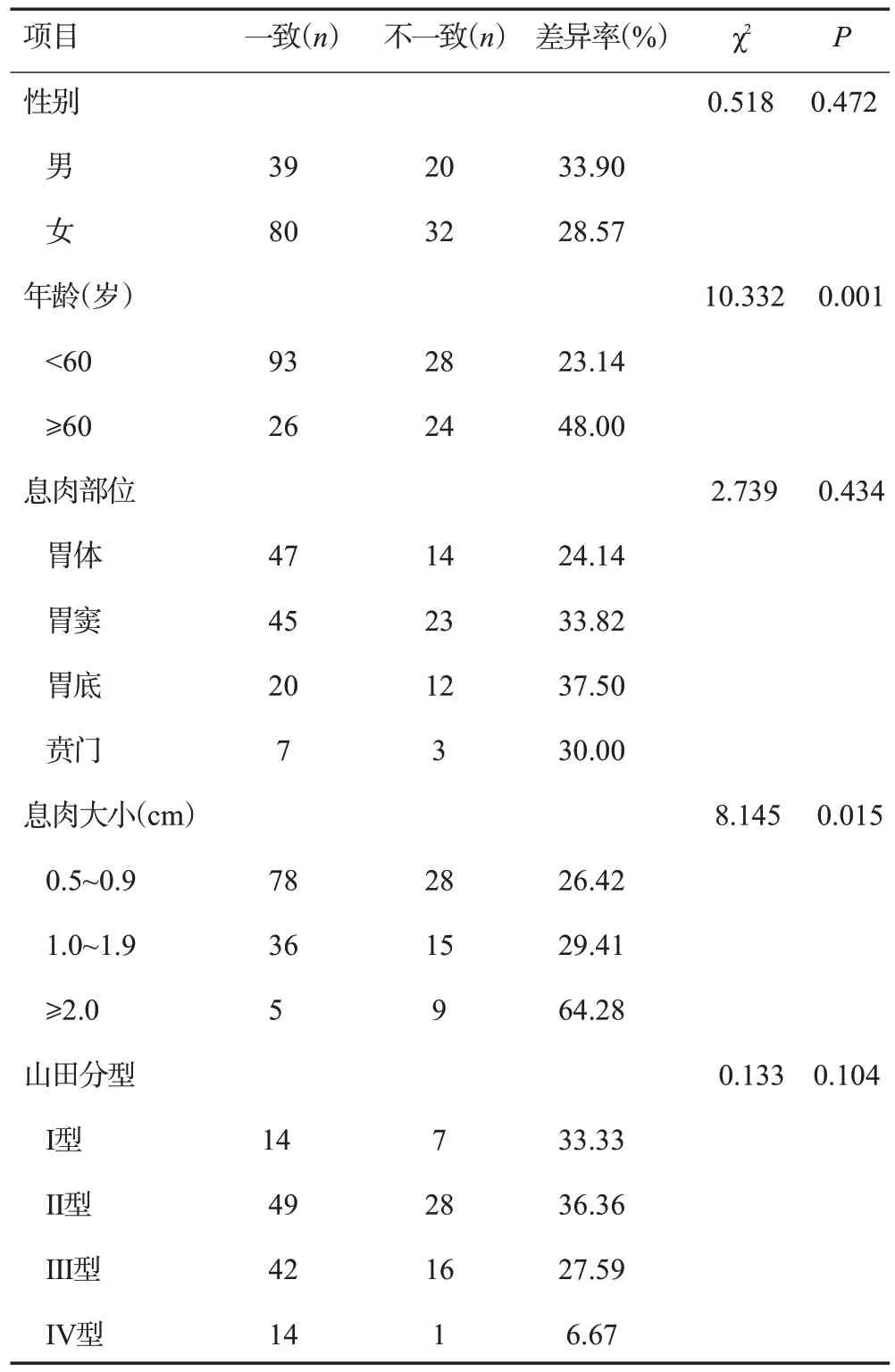
表3 内镜下钳夹活检与电切术后病理学诊断间组织学差异的单因素分析Tab.3 Univariate analysis of histological differences between endoscopic clamp biopsy and postoperative pathological diagnosis
2.4 内镜下钳夹活检与电切术后病理学诊断间组织学差异的多因素分析
Logistic多因素分析结果显示,患者年龄≥60岁、息肉大小≥2.0 cm是影响内镜下钳夹活检与电切术后病理学诊断间组织学差异的独立影响因素(P<0.05,表4)。
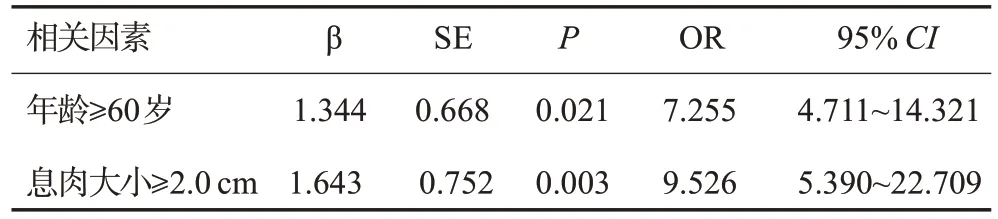
表4 内镜下钳夹活检与电切术后病理学诊断间组织学差异的多因素分析Tab.4 Multi-factor analysis of histological differences between endoscopic clamp biopsy and postoperative pathological diagnosis
3 讨论
有研究指出,除炎性和胃底腺息肉之外的其他所有胃息肉均有发展为胃癌的可能性,尤其是腺瘤性和增生性息肉引起胃癌的风险较高[11]。作为癌前疾病的胃息肉也应受到临床医师的广泛关注和重视。有研究表明,胃息肉癌变受其大小、数量、病理分型等因素的影响,对于多发性、直径较大、周边黏膜色泽异常、上皮异型改变等胃息肉,会增加癌变或出血风险[12]。对胃息肉病变性质的准确诊断将有利于准确预判癌变风险,为临床采取进一步对症治疗措施提供数据支持。内镜下钳夹活检是目前常用的胃镜下诊断胃息肉方法,但容易出现诊断结果误判[13]。一项研究对268枚行内镜下钳夹活检与病理诊断的胃息肉分析比较,发现内镜下钳夹活检与病理诊断差异为39.2%[14]。本研究中,内镜下钳夹活检与电切术后病理诊断结果的不一致性为30.41%,与既往报道[15-16]结果相差不大;而另一项研究发现活检标本与整体切除胃息肉的病理诊断结果不一致性仅为10%[17]。推测可能与患者个体差异、操作者技术、经验以及活检数量、病理诊断医师的诊断标准及经验等因素相关。
本研究结果显示,胃息肉多为单发性,且多发生胃窦、胃体,胃息肉大小多为0.5~0.9 cm,以山田分型Ⅱ、Ⅲ最为常见,与既往研究结果一致[18-19]。本研究中内镜下钳夹活检与病理诊断胃息肉结果所得的Kappa值为0.182,提示两种诊断方法存在显著的不一致性。因此,探究预测内镜下钳夹活检与病理诊断胃息肉不一致性的影响因素对改善临床医师诊断时对病变胃息肉样的管理可能会有积极意义。本研究经单因素分析发现,年龄≥60岁患者的病理诊断不一致率高于年龄<60岁患者,息肉大小≥2.0 cm患者的病理诊断不一致率明显高于息肉大小0.5~0.9 cm和1.0~1.9 cm患者,提示年龄、胃息肉大小与组织学诊断差异性相关;进一步Logistic多因素分析结果显示,年龄≥60岁、胃息肉大小≥2.0 cm是影响内镜下钳夹活检与电切术后病理学诊断间组织学差异的独立影响因素。原因可能为年龄较大患者其胃息肉表面粘膜易受药物、慢性疾病等因素影响,引起组织学结构变化较大;较大胃息肉所含组织成分较多,内镜下钳夹活检时选取标本大小有限,从而导致组织学差异较大,这与既往研究[8]结果一致,但该研究并未分析患者年龄对差异性的影响。另一项研究表明,胃息肉大小与诊断一致率之间并无明显相关性,可能因为不同研究中样本来源存在差异,受到地域、个体差异、样本数量、选取标本差异等因素影响[9]。也有研究表明,病变直径>2 cm,病变部位在近端胃、粘膜表面发红、表面溃疡或存在凹陷是影响内镜切除术后病理与术前活检病理差异的因素[20]。
综上所述,内镜下钳夹活检与电切术后病理学诊断结果存在差异,年龄≥60岁、胃息肉大小≥2.0 cm是影响内镜下钳夹活检与电切术后病理学诊断间组织学差异的独立影响因素,临床取样及诊断时应格外注意此类患者。此外,医院也应加强临床医师与病理学专家的沟通协作,制定更加符合国际标准的诊断流程和标准,以提高临床诊断胃息肉的准确性,减少误诊、漏诊风险。

