两种栽培型广藿香内生真菌群落组成变化
王利国 肖晶晶 邓月婷 崔业旋 刘志芬

摘要:為探索内生真菌与广藿香互作间对宿主活性成分形成机制的影响,该研究以成分差异较大的牌香和湛香为对象,采用传统形态学方法对所获菌株归类,通过真菌通用引物ITS1/ITS4扩增菌株rDNAITS序列,鉴定其分类地位并研究其多样性。结果表明:(1)用PDA和LBA培养基对苗期、分枝期和成株期广藿香茎叶组织块进行内生真菌分离,共获得3 070株菌株,其中牌香(PX)分离出1 624株,鉴定出1 319株,分属于36属;湛香(ZX)分离出1 446株,鉴定出994株,分属于33属。牌香分离出7种特有内生真菌,分别为香柱菌(Epichloe typhina)、盘长孢状刺盘孢菌(Colletotrichum gloeosporioides)、座腔孢菌(Botryosphaeria sp.)、丝核菌(Rhizoctonia sp.)及截盘多毛孢菌(Truncatella sp.),并首次分离到疫霉菌(Phytophthora sp.)和指疫霉菌(Sclerophthora sp.),这2种菌属于卵菌门内生菌。湛香分离出拟青霉菌(Paecilomyces sp.)和尾孢菌(Cercospora sp.)2种特有内生真菌。(2)牌香和湛香优势内生真菌相同,均为链格孢菌(Alternaria sp.)和刺盘孢菌(Colletotrichum sp.),其中牌香中相对分离频率为9.48%和7.81%,湛香为10.16%和8.65%。(3)从苗期到成株期,牌香和湛香内生真菌定殖率逐渐增高,依次为牌香8月(97.78%)>7月(72.50%)>5月(55.28%);湛香8月(91.11%)>7月(63.06%)>5月(46.67%)。平均定殖率为牌香75.19%,湛香66.95%。(4)随着生长期延长,牌香和湛香内生真菌多样性呈递增趋势,同时2种广藿香内生真菌平均相似性系数为0.86。可见,牌香和湛香内生真菌种类丰富,各有独特的内生真菌,且不同生长期内生真菌种群组成不同。该研究结果为筛选活性内生真菌菌株,探究内生真菌影响广藿香活性成分合成与积累奠定了基础。
关键词: 广藿香, 栽培型, 牌香, 湛香, 内生真菌, 群落组成
中图分类号:Q949; R282.2
文献标识码:A
文章编号:10003142(2022)05075309
Community composition changes of endophytic fungi
from two cultivated species of Pogostemon cablin
Abstract:In order to explore the effects of the interaction between endophytic fungi and patchouli on the formation mechanism of active components, a laboratory experiment was conducted for investigating the endophytic fungi of Pogostemon cablin cv. shipaiensis and P. cablin cv. zhanjiangensis with chemical component difference. The strains were classified by traditional morphological methods firstly, and then the rDNAITS sequences of the strains were amplified by the common fungal primer ITS1/ITS4 to identify their taxonomic status and their diversities. The results were as follows: (1) A total of 3 070 strains were isolated from the stem and leaf tissues of patchouli in seedling, branching and adult stages by PDA and LBA culture media. The 1 624 strains of endophytic fungi from P. cablin cv. shipaiensis were isolated and 1 319 strains were identified, which belonged to 36 genera. Seven endemic endophytic fungi were isolated from P. cablin cv. shipaiensis, including Epichloe typhina, Colletotrichum gloeosporioides, Botryosphaeria sp., Rhizoctonia sp., Truncatella sp.,Phytophthora sp., and Sclerophthora sp., and the later two belonging to Oomycete were isolated for the first time. There were 1 446 strains isolated from P. cablin cv. zhanjiangensis, and 994 strains were identified, which were belonging to 33 genera. Among them, there were two endemic endophytic fungi in P. cablin cv. Zhangjiangensis, including Paecilomyces sp. and Cercospora sp. (2) The dominant endophytic fungi were Alternaria sp. and Colletotrichum sp. in two kinds of cultivated patchouli. The relative separation frequencies of the Alternaria sp. and Colletotrichum sp. were 9.48% and 7.81% in P. cablin cv. shipaiensis, and were 10.16% and 8.65% in P. cablin cv. zhanjiangensis. (3) The colonization rates of endophytic fungi gradually increased with the growth of patchouli from seedling to adult stages, which were Aug.(97.78%) > Jul.(72.50%)> May(55.28%) in P. cablin cv. shipaiensis, and Aug.(91.11%) > Jul.(63.06%) > May(46.67%) in P. cablin cv. zhanjiangensis. The average colonization rates were 75.19% and 66.95%. (4) There were a positive correlation between the growth periods and the Shannon index, which increased with the growth of patchouli. The average sorenson similarity index was 0.86. Obviously, P. cablin cv. shipaiensis and P. cablin cv. Zhangjiangensis had a large population of endophytic fungi and had their own endemic endophytic fungi, but the community structure was significantly different. These results lay a foundation for screening active strains and exploring the effect of endophytic fungi on the synthesis and accumulation of active components of patchouli.C657C382-18B4-494A-8042-F7973D3AA0B0
Key words: Pogostemon cablin, cultivated type, P. cablin cv. shipaiensis, P. cablin cv. zhanjiangensis, endophytic fungi, community composition
广藿香(Pogostemon cablin)为唇形科刺蕊草属一年生芳香性草本植物,是广东省道地药材,著名“四大南药”之一,具有芳香化湿、和胃止呕、祛暑解表的功效(李薇和徐鸿华,2003)。广藿香不仅是多种中成药的主要原料,可用来提取广藿香油,还是轻化工业的重要辅料。传统上,广藿香分4种栽培型:牌香(广州产)、枝香(肇庆产)、湛香(湛江产)和南香(海南产),4种广藿香形态差异明显,尤以牌香和湛香为甚。徐颂军等(2003)通过超薄等电聚焦电泳技术得出4个产地的广藿香分为3个栽培品种,即石牌广藿香[简称牌香(P. cablin cv. Shipaiensis),用PX表示]、高要广藿香[简称湛香(P. cablin cv. Gaoyaoensi),用ZX表示]和湛江广藿香(P. cablin cv. Zhanjiangensis)。牌香和枝香是广藿香药材的主要来源,而湛香和南香多用于提取精油。罗集鹏等(2001,2003)研究发现4种广藿香中,牌香和枝香的广藿香酮含量明显高于湛香和南香,牌香最高。根据成分差异,通过叶绿体基因组蛋白编码基因中保守的18S rRNA基因和进化速率较快的matK基因序列比较,进一步将4种广藿香分成两种化学型,即广藿香酮化学型广藿香,包括牌香和枝香;广藿香醇化学型广藿香,包括湛香和南香。刘玉萍等(2002)通过16S rRNA序列分析证明牌香和湛香广藿香基因序列存在差异。
植物内生真菌因长期定殖于宿主组织内部,与宿主植物协同进化,二者形成了一种非常复杂的共生关系,并影响着宿主植物各种成分的积累和对胁迫的应激反应(Clay & Schardl, 2002)。目前,几乎所有被研究过的植物中都能检测到内生真菌的存在,其分布广、种类多,具有丰富的生物多样性。同时,内生真菌也存在宿主偏好或专一性,不同的宿主或不同的生长环境对内生真菌种群组成和定殖有明显影响。药用植物是挖掘活性内生真菌资源的重要宝库,其与宿主互作间产生的小分子次生代谢物对宿主的生长发育、系统防御以及次级代谢产物的合成具有关键调控作用(Jia et al., 2016)。广藿香作为广东省道地药材,目前已从牌香筛选出有活性的内生真菌并对其化学成分(王沫等,2016a)、抗青枯病(谢华蓉等,2017)、抗肿瘤(王沫等,2016b)、抗逆性(吴瑕,2013)等进行了相关研究,由于未考虑广藿香栽培型差异以及广藿香生长期不同,因此分离出的活性内生真菌差异较大。牌香和湛香作为广东省栽培面积最大的2种广藿香,其成分差异明显,由于活性成分形成机理尚未明确,因此影响了广藿香品种的选育。广藿香药物成分多属于倍半萜类,合成过程遵循类异戊二烯代谢途径中的甲羟戊酸(MVA)途径。彭淑萍等(2021)研究地黄(Rehmannia glutinosa)茉莉酸合成发现,丙二烯氧化物合酶(allene oxide synthase, AOS)和1 2-氧代植二烯酸还原酶(1 2oxophytodienoate reductase, OPR)基因的表达受内生真菌调控,不同器官基因表达量不同。前期中药种质资源与分子鉴定研究团队(PI)对广东省和云南省阳春砂(Amomum villosum)内生真菌多样性研究发现,生长环境影响着两地阳春砂内生真菌的群落组成,推断出“土壤环境-内生真菌定殖共生-宿主成分积累”形成模式(肖晶晶等,2020)。牌香和湛香因长期种植于不同地理区域,其外观形态及内生真菌群落组成发生了明显变化。为此,本研究以牌香和湛香为材料,探究2种广藿香不同生长期内生真菌的群落组成以及种群的动态变化,为深入了解内生真菌在广藿香药物合成机理中的作用奠定基础。
1材料与方法
1.1 样品采集与处理
牌香采自广州市萝岗区(现黄埔区萝岗镇)广州市香雪制药股份有限公司广藿香GAP基地;湛香采自湛江市遂溪县乌塘镇广藿香种植合作社,按照苗期、分枝期和成株期3个生长阶段采样。牌香采样时间为苗期(5月10日,PX1)、分枝期(7月14日,PX2)、成株期(8月20日,PX3);湛香采样时间为苗期(5月21日,ZX1)、分枝期(7月5日,ZX2)和成株期(8月7日,ZX3),各采样30株。采样方式按照5点取样法随机挖取健康植株带回,剪短分装于密封袋中冰箱保存。材料經广州中医药大学贺红教授鉴定为广藿香。从材料中随机选取茎枝5段,摘取叶后用水洗净,茎剪成长度5 cm, 叶剪成2.5 cm × 2.5 cm的组织块。组织块置于含75%乙醇的烧杯中浸泡3 min、无菌水冲洗3次后,置于加入Tween20的0.1%升汞浸泡,茎浸泡2 min,叶浸泡3 min。浸泡期间不断搅动,让组织块与杀菌液充分接触,取出用无菌水冲洗3次,每次2 min、用无菌滤纸吸干水分,无菌条件下将组织块剪成大小约0.5 cm × 0.5 cm备用。
1.2 培养和分离
分阶段从处理后的组织块中随机选取120个贴于PDA和利马豆(LBA)平板中,LBA配置参照左豫虎(2004)的方法。以各组织块正反面滚动或平铺培养基表面2 min后取出为对照,平板置于25 ℃恒温恒湿下暗培养,隔天观察,当组织块周围有菌丝长出时,将其挑出培养,单孢分离纯化,纯化后的菌株编号后接种于试管中,2~5 ℃下冷藏保存,用于菌株的分类鉴定。实验重复3次。
1.3 内生真菌鉴定
按照魏景超(1979)的《真菌鉴定手册》进行形态学鉴定。形态学鉴定主要包括菌落形态、菌丝特征、分生孢子梗形态、孢子形态、产孢结构及产孢方式等。不产孢的菌株参考Sutton(1980)的方法,首先进行促孢培养,产孢后按上述方法进行鉴定。分子鉴定参考Barnett & Hunter(1987)和Ellis(1988)的方法确定所获菌株的分类地位。总DNA提取选用改良的十六烷基三甲基溴化铵(CTAB)法(王桂娥,2015),引物对为ITS1(5′TCCGTAGGTGAACCTGCGG3′)和ITS4(5′TCCTCCGCTTATTGATATGC3′),扩增产物用1%的琼脂糖凝胶电泳检测,合格后送广州擎科生物有限公司测序。所获序列与NCBI上的已知序列进行比对,根据序列的相似度和覆盖率,接合菌株的形态学特征确定其分类地位。C657C382-18B4-494A-8042-F7973D3AA0B0
1.4 数据处理
定殖率常用来衡量植物中内生真菌的丰度,而相对分离频率(isolation frequency, IF)则用来衡量植物中某一类内生真菌的优势度。分别按此公式计算:定殖率=(内生真菌感染的组织块数/总组织块数)SymboltB@
100%;相对分离频率=(分离到的某属或种的菌株数/分离到的总菌株数)SymboltB@
100%(Yuan et al., 2011)。
利用SPSS 21.0软件的皮尔森相关系数(Pearson correlation coefficient)法对2种广藿香内生真菌定殖率和相对分离频率相关性进行分析,若方差齐性,则采用单因素方差分析(oneway anova)中的Turkey HSD检验进行差异显著性分析(P<0.05)。方差齐性采用levene检验。当P<0.05时,差异显著。
Shannon指数(H′)反映了植物内生真菌的物种多样性,计算公式为H′= -∑ki=1Pi×InPi。式中:Pi指某一种类内生真菌的数量占全部内生真菌数量的百分比。
相似性系数(Sorenson index)(Cs)常用来比较两种植物之间内生真菌组成的相似程度,计算公式为Cs=2j / (a + b) 。式中: j指牌香和湛香共有的内生真菌种类;a和b则指每种广藿香所有的内生真菌种类(Spellerberg & Fedor, 2003)。
2结果与分析
2.1 内生真菌的定殖率和分离株数
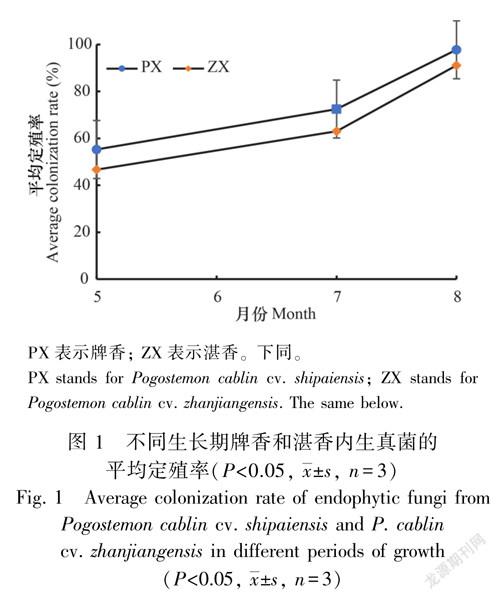
3个生长阶段,从牌香和湛香茎叶的2 160个组织块中,共获得内生真菌菌株3 070株,鉴定出2 203株。其中,牌香获得1 319株,湛香994株。牌香内生真菌的平均定殖率为75.19%,湛香为66.95%。从实验结果看出:随着广藿香从苗期到成株期,内生真菌定殖率逐渐增高,牌香依次为8月(97.78%)>7月(72.50%)>5月(55.28%);湛香为8月(91.11%)>7月(63.06%)>5月(46.67%),卡方检验呈显著性差异(P < 0.05)(图1)。3个采样阶段,牌香内生真菌的定殖率均高于湛香。从分离出的菌株数发现,随着广藿香生长期延长,牌香和湛香内生真菌的菌株数均呈递增趋势,其中,从牌香获得的菌株数依次为8月(702株)>7月(574株)>5月(348株);从湛香获得内生真菌菌株数为8月(662株)>7月(478株)>5月(306株)。从苗期到成株期,牌香内生真菌获得菌株数均高于湛香(图2)。
2.2 内生真菌的分类地位
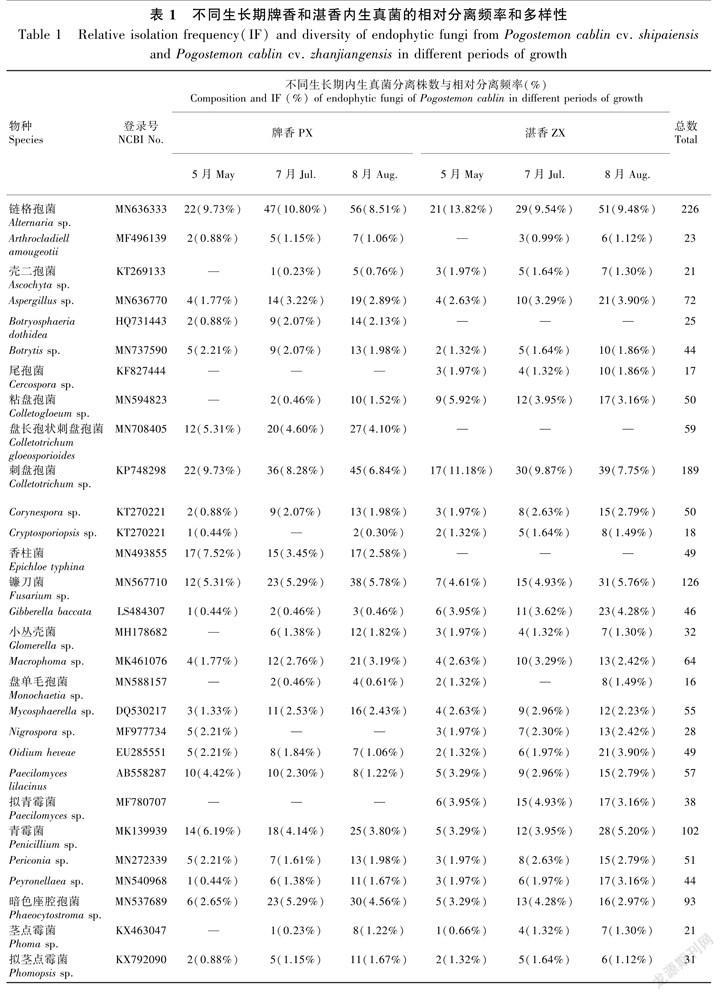
所有经过分子鉴定的菌株ITS序列已提交到GenBank。结合形态学特征,从牌香获得的1 624株菌株中鉴定出1 319株,从湛香1 446株中鉴定出994株,属于40个种属(表1)。牌香中特有的内生真菌有香柱菌(Epichloe typhina)、盘长孢状刺盘孢菌(Colletotrichum gloeosporioides)、座腔孢菌(Botryosphaeria sp.)、絲核菌(Rhizoctonia sp.)、截盘多毛孢菌(Truncatella sp.)。通过LBA培养,从牌香中分离到卵菌门(Oomycota)疫霉菌属(Phytophthora sp.)内生菌53株和指疫霉菌属(Sclerophthora sp.)内生菌32株。湛香有2种特有的内生真菌,分别为拟青霉菌(Paecilomyces sp.)和尾孢菌(Cercospora sp.)。
牌香和湛香的优势内生真菌种类相差不大,但相对分离频率差异明显。优势内生真菌均为链格孢菌和刺盘孢菌,占已鉴定菌株数的9.77%和8.17%。其中,链格孢菌和刺盘孢菌在牌香的相对分离频率为9.48%和7.81%,在湛香为10.16%和8.65%。其次,镰刀菌(Fusarium sp.)、青霉菌(Penicillium sp.)、暗色座腔孢菌(Phaeocytostroma sp.) 与木霉菌(Trichoderma sp.)内生真菌也较多,相对分离频率远超过其他内生真菌(表1)。
2.3 内生真菌的多样性和相似性
5—8月,随着广藿香从苗期到成株期的生长,牌香和湛香内生真菌多样性均呈递增的趋势。牌香Shannon指数依次为5月3.17、7月3.28、8月3.42;湛香Shannon指数为5月3.21、7月3.30、8月3.35,2种广藿香呈现出丰富的内生真菌群落组成多样性(表1)。同时,牌香和湛香内生真菌相似性系数不完全相同。牌香3个采样时间段,内生真菌群落组成的相似性系数为0.87~0.97,湛香为0.97~0.98,而牌香与湛香内生真菌群落组成相似性系数介于0.75~0.86之间。相似性系数最高的是湛香内生真菌,5月份与8月份是0.97,7月份与8月份为0.98。内生真菌相似性系数最低的是5月份的牌香与湛香,为0.75(表2)。表明牌香和湛香不同生长阶段内生真菌群落组成相对稳定,但同一生长期牌香与湛香内生真菌的群落组成差异明显,尤以苗期为甚。
3讨论与结论
内生真菌群落的组成结构与宿主关系密切,不同属宿主内生真菌群落组成差异性较大,甚至同属植物之间内生真菌也不完全一样(Chen et al., 2013)。一方面,宿主内生真菌呈现丰富的物种多样性,另一方面,宿主对内生真菌的定殖往往具有一定的选择性和偏好性。Arnold(2007)研究指出,高纬度地区内生真菌丰富度远高于低纬度地区,高纬度地区以粪壳菌纲(Sordariomycetes)为主,低纬度地区以座囊菌纲(Dothideomycetes)真菌较多。一些常见的粪囊菌纲内生真菌,如刺盘孢菌、茎点霉菌(Phoma sp.)、拟茎点霉菌(Phomopsis sp.)和炭角菌目(Xylariales)在植物茎叶内均能分离到,但叶点霉菌(Phyllosticta sp.)只分布在叶中,镰刀菌不能从叶中分离得到(Herrera et al., 2010;Márquez et al., 2010)。从本研究对牌香和湛香的分离结果可以看出,82.23%的内生真菌属于粪囊菌纲,10.04%属于座囊菌纲,另有7.73%属于卵菌门卵菌纲(Oomycetes)内生真菌。2种广藿香优势内生真菌均为刺盘孢菌和链格孢菌,但刺盘孢菌在牌香中相对分离频率远高于湛香,其中,牌香获得162株,湛香86株。链格孢菌是较例外的内生真菌,该菌属于座囊菌纲真菌。Rosa等(2009) 从南极发草(Deschampsia antarctica)中分离出1株链格孢属内生真菌,认为座囊菌纲下的格孢菌目(Pleosporales)鲜受环境影响,是草本植物中较为普遍的内生真菌。本研究从牌香中获得125株链格孢菌,湛香中获得101株,差异不大,表明链格孢菌受纬度的影响较小,应普遍存在于草本植物中。除2种优势内生真菌外,镰刀菌、青霉菌、暗色座腔孢菌及木霉菌相对分离频率也较高,这些次优势内生真菌多属于子囊菌门(Ascomycota)粪囊菌纲或有丝分裂真菌(mitosporic fungi),这些腐生菌常存于各类植物组织间营腐生生活。药用植物各有不同的入药部位,且不同部位药效差异较大。周仁超等(2014)研究认为不同内生真菌有各自喜好的组织部位,不同部位间内生真菌群落构成并非完全一样。本研究发现在广藿香整个生长过程中,叶组织块分离到的内生真菌种类和数量明显多于茎,叶内生真菌群落丰度高于茎器官。C657C382-18B4-494A-8042-F7973D3AA0B0
不同生长期宿主内生真菌群落组成并不相同,内生真菌与宿主生长之间处在一种动态平衡之中。依牌香和湛香来看,苗期牌香中未分离获得的壳二孢菌(Ascochyta sp.)、粘盘孢菌(Colletogloeum sp.)、小丛壳菌 (Glomerella sp.)、盘单毛孢菌(Monochaetia sp.)、茎点霉菌及轮枝孢菌(Verticillium sp.),在7月和8月样品中分离获得,且分离频率逐渐增高,此时,牌香正处于从分枝期到成株期的生长阶段,也是广藿香药物成分积累的重要时间节点。同样,湛香中的穆氏节丝壳菌
(Arthrocladiella mougeotii)只在7—8月生长期间获得,苗期未有定殖。这些受温度影响晚定殖的“温敏性内生真菌”,其同属中的一些种甚至可以造成植物病害,属于病原真菌。这些“温敏性内生真菌”相对分离频率比其它内生真菌低,但在影响广藿香成分积累中的作用不可忽视。除了牌香和湛香共有的内生真菌外,我们从3 070株菌株中也获得了2种广藿香各自特有的一些内生真菌,其中,
牌香分离出7种特有内生真菌,包括香柱菌(Epichloe typhina)、座腔孢菌(Botryosphaeria sp.)、盘长孢状刺盘孢菌(Colletotrichum gloeosporioides)、丝核菌(Rhizoctonia sp.)、截盘多毛孢菌(Truncatella sp.)4种属于子囊菌门的内生真菌以及疫霉菌(Phytophthora sp.)和指疫霉菌(Sclerophthora sp.)2種卵菌门卵菌。湛香中分得尾孢菌(Cercospora sp.)和拟青霉菌(Paecilomyces sp.)2种特有内生真菌。香柱菌是存在于野生禾草类植物中较常见的内生真菌,其代谢物影响着宿主植物种子萌发及活性成分的积累(乌日罕等,2018)。进一步研究这些“温敏性内生真菌”和特有内生真菌在宿主活性成分合成机制中的作用有特别的意义。
除宿主本身外,宿主的生活环境也影响着宿主内生真菌群落构成及丰度。3个生长阶段的牌香与湛香,无论从定殖率、分离株数、多样性指数比较,牌香内生真菌丰度高于湛香,但2种广藿香变化趋势基本相同,随着生长期延长,内生真菌定殖率夏季高于春季,且Shannon指数(H′)逐渐增加,呈现出成株期>分枝期>苗期。这一结果与吕立新等(2014)研究草本药用植物茅苍术(Atractylodes lancea)内生真菌群落随季节变化一致。而Gao等(2005)研究拐枣(Hovenia acerba)内生真菌群落变化发现春季拐枣内生真菌种类多于夏季,这从一个侧面反映出一年生草本植物可能与木本植物内生真菌群落变化并不完全一样。 本研究结果表明牌香和湛香中含有丰富的内生真菌,牌香的丰度更高。这两种栽培型广藿香内生真菌群落构成受到宿主、生长期、气候等因子影响。牌香和湛香内生真菌群落组成及变化特征为进一步了解牌香和湛香药性差异奠定了基础。
参考文献:
ARNOLD AE, 2007. Understanding the diversity of foliar endophytic fungi: progress, challenges, and frontiers[J]. Fung Biol, 21: 51-66.
BARNETT HH, HUNTER BB, 1987. Illustrated genera of imperfect fungi[M]. New York: Macmillan Publishing Company: 1-863.
CHEN J, ZHANG LC, XING YM, 2013. Diversity and taxonomy of endophytic xylariaceous fungi from medicinal plants of Dendrobium (Orchidaceae)[J]. PLoS ONE, 8(3): 1-11.
CLAY K, SCHARDL C, 2002. Evolutionary origins and ecological consequences of endophyte symbiosis with grasses [J]. Am Nat, 160(4): S99-S127.
ELLIS MB, 1988. Dematiaceous hyphomycetes[M]. London: International Mycological Institute: 1-576.
GAO XX, ZHOU H, XU DY, et al., 2005. High diversity of endophytic fungi from the pharmaceutical plant,Heterosmilax japonica Kunth revealed by cultivationindependent approach[J]. FEMS Microbiol Lett, 249(2): 255-266.
HERRERA J, KHIDIR HH, EUDY DM, et al., 2010. Shifting fungal endophyte communities colonize Bouteloua gracilis: effect of host tissue and geographical distribution[J]. Mycologia, 102(5): 1012-1026.
JIA HF, ZHANG C, PERVAIZ T, et al., 2016. Jasmonic acid involves in grape fruit ripening and resistant against Botrytis cinerea [J]. Funct Integr Genom, 16(1): 79-94.C657C382-18B4-494A-8042-F7973D3AA0B0
LI W, XU HH, 2003. Standardized cultivation techniques of Pogostemon cablin [M]. Guangzhou: Guangdong Science and Technology Press: 11.[李薇, 徐鸿华, 2003. 广藿香规范化栽培技术 [M]. 广州: 广东科技出版社: 11.]
LIU YP, LUO JP, FENG YF, et al., 2002. DNA profiling of Pogostemon cablin chemotypes diffing in essential oil composition[J]. Acta Pharm Sin, 37(4): 304-308.[刘玉萍, 罗集鹏, 冯毅凡, 等, 2002. 广藿香的基因序列与挥发油化学型的相关性分析 [J]. 药学学报, 37(4): 304-308.]
LUO JP, LIU YP, FENG YF, et al., 2003. Two chemotypes of Pogostemon cablin and influence of region of cultivation and harvesting time on volatile oil composition[J]. Acta Pharm Sin, 38(4): 307-310.[罗集鹏, 刘玉萍, 冯毅凡, 等, 2003. 广藿香的两个化学型及产地与采收期对其挥发油成分的影响 [J]. 药学学报, 38(4): 307-310.]
L LX, WANG HW, LIANG XF, et al., 2014. Effects of different chemotypes and the species diversity of endophytic fungal communities harbored in Atractylodes lancea [J]. Acta Ecol Sin, 34(24): 7300-7310.[吕立新, 王宏伟, 梁雪飞, 等, 2014. 不同化学型和季节变化对茅苍术内生真菌群落多样性的影响 [J]. 生态学报, 34(24): 7300-7310.]
MRQUEZ SS, BILLS GF, ACUA LD, 2010. Endophytic mycobiota of leaves and roots of the grass Holcus lanatus [J]. Fungal Divers, 41: 115-123.
PENG SP, DONG CM, ZHU YH, 2021. Cloning and expression analysis of two key genes of jasmonic acid synthesis in response to endophytic infection from Rehmannia glutinosa [J]. Bull Bot Res, 41(2): 294-301.[彭淑萍, 董诚明, 朱畇昊, 2020. 响应内生菌侵染的两个地黄茉莉酸合成关键基因的克隆与表达分析 [J]. 植物研究, 41(2): 294-301.]
ROSA LH, VAZ ABM, CALIGORNE RB, et al., 2009. Endophytic fungi associated with the antarctic grass Deschampsia antarctica Desv.(Poaceae)[J]. Polar Biol, 32: 161-167.
SPELLERBERG IF, FEDOR PJ, 2003. A tribute to claude shannon (1916-2002) and a plea for more rigorous use of species richness, species diversity and the ShannonWiener index[J]. Global Ecol Biogeogr, 12(3): 177-179.
SUTTON BC, 1980. The coelomycetes. Fungi imperfecti with pycnidia, acervuli and stromata[M]. London: Commonwealth Mycological Institute: 1-358.
WANG GE, CHAO QF, LIANG JF, et al., 2015. Extraction of genomic DNA from dry leaves of Artemisia rupestris by modified CTAB methods[J]. Chin J Exp Trad Med Form, 21(12): 19-22.[王桂娥, 晁群芳, 梁建芳, 等, 2015. 改良CTAB法提取新疆一枝蒿干葉基因组DNA [J]. 中国实验方剂学杂志, 21(12): 19-22.]
WANG M, CHEN YC, LI HH, et al., 2016a. A new cochlioquinone from endophytic fungus Bipolaris sorokiniana derived from Pogostemon cablin and its bioactivity[J]. Chin Trad Herb Drugs, 47(15): 2601-2605.[王沫, 陈玉婵, 李浩华, 等, 2016a. 广藿香内生真菌索氏平脐蠕孢中1个新旋孢腔菌醌类化合物及其生物活性 [J]. 中草药, 47(15): 2601-2605.]C657C382-18B4-494A-8042-F7973D3AA0B0
WANG M, CHEN YC, SUN ZH, et al., 2016b. Study on cytotoxic secondary metabolites of endophytic fungus Diaporthe longicolla A616 from Pogostemon cablin [J]. Chin J Chin Mat Med, 41(11): 2112-2117.[王沫, 陈玉婵, 孙章华, 等, 2016b. 广藿香内生真菌Diaporthe longicolla A616细胞毒活性次级代谢产物研究 [J]. 中国中药杂志, 41(11): 2112-2117.]
WEI JC, 1979. Identification manual of fungi[M]. Shanghai: Shanghai Science and Technology Press: 1-780.[魏景超, 1979.真菌鉴定手册 [M]. 上海: 上海科学技术出版社: 1-780.]
WU RH, LIU H, WU M, et al., 2018. Effects of Epichloe endophytes of Achnatherum sibiricum on spore germination of arbuscular mycorrhizal fungi [J]. Chin J Appl Ecol, 29(12): 4145-4151.[乌日罕, 刘慧, 吴曼, 等, 2018. 感染羽茅的香柱菌属内生真菌对丛枝菌根真菌孢子萌发的影响 [J]. 应用生态学报, 29(12): 4145-4151.]
WU X, 2013. Ecological distribution of endophytic fungi associated with Pogostemon cablin and effects on plant growth stress tolerance and disease resistance[D]. Guangzhou: South China Agricultural University.[吴瑕, 2013. 广藿香内生真菌生态分布规律及其对植株生长和抗逆性的影响 [D]. 广州: 华南农业大学.]
YUAN ZL, RAO LB, CHEN YC, et al., 2011. From pattern to process: species and functional diversity in fungal endophytes of Abies beshanzuensis [J]. Fung Biol, 115(3): 197-213.
XU SJ, WANG XF, XU XH, et al., 2003. The classification of cultivas of Pogostemon cablin cultivated in Guangdong Province of China[J]. J S Chin Norm Univ (Nat Sci Ed), 35(1): 82-86.[徐頌军, 王晓峰, 徐祥浩,等, 2003. 药用植物广藿香的品种分类探讨 [J]. 华南师范大学学报(自然科学版), 35(1): 82-86.]
XIE HR, XU ZC, LIU J, et al., 2017. Diversity and the antagonistic activities of endophytic fungi from patchouli against Ralstonia solanacearum [J]. Microbiology, 44(5): 1171-1181.[谢华蓉, 徐在超, 刘军, 等, 2017. 广藿香内生真菌多样性及其对青枯菌的拮抗活性 [J]. 微生物学通报, 44(5): 1171-1181.]
XIAO JJ, WANG LG, CUI YX, et al., 2020. Study on molecular identification of endophytic fungi from Amomum villosum of different habitats[J]. J Guangzhou Univ Trad Chin Med, 37(9): 742-747.[肖晶晶, 王利国, 崔业旋, 等, 2020. 不同产地阳春砂内生真菌的分子鉴定研究 [J]. 广州中医药大学学报, 37(7): 742-747.]
ZHOU RC, HUANG J, LI ZE, et al., 2014. Diversity and tissue distribution of fungal endophytes in Alpinia officinarum: an important SouthChina medicinal plant[J]. Chin J Chin Mat Med, 39(16): 3023-3029.[周仁超, 黄娟, 李泽恩, 等, 2014. 南药植物高良姜内生真菌群体多样性及其组织分布 [J]. 中国中药杂志, 39(16): 3023-3029.]
ZUO YH, 2004. Inheritance and infection process of Phytophthora sojae [D]. Yangling: Northwest A & F University.[左豫虎, 2004. 大豆疫霉菌遗传特性及侵染过程研究 [D]. 杨凌: 西北农林科技大学.]
(责任编辑李莉)
收稿日期:2021-02-10
基金项目:国家自然科学基金(81373901); 国家中医药管理局全国中药资源普查项目(GZYKJS2018004,GZYKJS2019003);国家公共卫生服务补助资金项目(财社[2016]44号) [Supported by National Natural Science Foundation of China(81373901); National Survey on Chinese Materia Medica Resources of State Administration of Traditional Chinese Medicine (GZYKJS2018004,GZYKJS2019003); Special Subsidy Fund for National Public Health Service(CS[2016] No. 44) ]。
第一作者: 王利国( 1966-) ,博士,主要从事药用植物资源与开发研究,( Email)wanglg@gzucm.edu.cn。C657C382-18B4-494A-8042-F7973D3AA0B0

