红色红菇Russula rosea微生物菌群鉴定及分析
李史仪 陆显格 鲁国东 余文英*
(1福建农林大学园艺学院,福建福州 350002;2福建农林大学生命学院,福建福州 350002;3福建农林大学植物保护学院,福建福州 350002)
红色红菇Russula rosea,是一种纯天然的大型珍贵野生食用菌,夏秋季多群生或散生于冷杉针阔混交林地上[1]。红色红菇营养丰富,富含多种人体必需常量元素和微量元素,具有高蛋白、低脂肪的特点[2],有较高的食用及药用价值。红菇内含有蛋白质、多肽、多糖、甾类、萜类、有机酸和酚类等多种生理活性物质,可为农业、林业病虫害的生物防治提供研发资源,但目前尚不能人工栽培。国内外有不少关于野生红菇的报道,如我国野生红菇的生态、资源、分类、分离纯化和应用研究,红菇的化学成分分析、子实体多糖提取等,为进行人工栽培研究提供了科学依据。但到目前为止,由于红菇生长所需的条件及生理的特殊性,国内外至今也未见其人工栽培成功的报道[3]。
当今食用菌微生态多样性研究已成为热点。研究微生物群落多样性,主要采取传统微生物的分离及分类鉴定方法(主要是平板分离、形态学的观察)与现代分子生物学(主要采用高通量测序技术等)相结合手段[4]。笔者采用平板分离培养方法和现代高通量测序技术相结合手段,分析红菇生境土壤的微生物种群及特征,旨在揭示红菇生境微生物优势菌群等特征,为人为大幅度提高红菇产量和品质提供技术支撑,实现红菇大规模以及大范围人工栽培。
1 材料与方法
1.1 材料采集及处理
将采集的福建省古田县红色红菇新鲜子实体(去除表面泥沙杂物)及子实体根际土带回实验室后,分别分成两份于4℃冷藏保存备用。其中一份用于直接分离培养微生物,另一份用于后续宏基因组的提取。
1.2 试验方法
1.2.1 微生物的分离
红菇子实体微生物分离:分离部位选取菌柄中间的组织块,并采用添加腐殖土PDA培养[5]。根际土微生物分离:真菌用PDA培养基(添加氯霉素以去除细菌的干扰),细菌用NA培养基。
1.2.2 总基因组DNA提取及高通量测序
子实体基因组提取参照YU等[6]方法,子实体根际土的微生物基因组提取参照余文英等[7]方法。分别以子实体基因组或根际土的基因组为模板,采用真菌特异引物对ITS1F(TCCG TAGG TGAA CCTG CGG)和ITS4(TCCTCCGC TTAT TGAT ATGC)进行PCR扩增真菌ITS1−ITS4区域。以宏基因组为模板,采用引物338F(ACTCCTACGGGAGGCAGCA)和806R(GGACTACHVGGGTWTCTAAT)扩 增 细 菌16 sRNA的V3—V6高变区域。PCR条件为:95℃预变性5 min,95℃变性1 min,50℃退火1 min,72℃延伸1 min,共15个循环,最后72℃延伸7 min,4℃保存。真菌和细菌PCR扩增片段分别用Illumina HiSeq高通量测序。
1.2.3 分离培养细菌16sRNA、真菌ITS片段的PCR扩增,克隆测序
将所分离纯化的子实体及根际土壤微生物参照余文英等[7]方法提取DNA。以提取的基因组为模板,真菌采用引物对ITS1F和ITS4 PCR扩增ITS1—ITS4片段,细菌采用细菌的通用引物27F(AGAGTTTGATCCTGGCTCAG)和1492R(TACGGYTACCTTGTTACGACTT)PCR扩增16 sRNA片段。PCR反应条件同1.2.2。将PCR产物电泳纯化后克隆到大肠杆菌,将阳性克隆菌液交由上海生工生物工程有限公司测序,最后将测序的序列与NCBI数据库比对,鉴定。
1.2.4 测序数据处理
将Illumina HiSeq高通量测序的结果在BioEdit 7.0.8中手动更正,去除singleton的物种级操作分类单元OTU(Operational Taxonomic Untis),以97%的序列相似性聚类为OTU进行物种定界。利用NCBI,Silva,UNITE数据库比对OTU[8−9],当比对结果相似度≥90%则鉴定到属,相似度在80%~89%鉴定到科[10]。对可培养菌的阳性克隆测序序列的结果用BioEdit编辑,相似度≥97%且碱基差异5个以内的归为一个种。
1.2.5 数据分析
采用VENNY方法对主要微生物菌群(Core microbiome)进行在线分析(http://bioinfogp.cnb.csic.es/tools/venny/index.html)。通过spearman检验方法对选取所有样本绝对丰度前10的OTU进行微生物之间的互作关系(NetWork)分析,对spearman计算所得结果过滤掉P值大于0.05的或相关值|R|<0.4。
2 结果与分析
2.1 红色红菇子实体微生物多样性分析
通过高通量检测,红色红菇子实体的真菌和细菌的OTU,分别为369.67及109.33。进一步分析了真菌及细菌的chao1、shannon指数,结果表明子实体微生物无论是物种丰富度还是生物多样性都比较高,而真菌的物种丰富度比细菌高,但是细菌的多样性比真菌高(表1)。

表1 子实体中OTU及alpha多样性指数
2.2 红色红菇子实体微生物组成分析
对红菇的子实体进行了真菌和细菌的微生物扩增子高通量测定,从而分析真菌和细菌的组成。
2.2.1 真菌核心菌群及优势种群分析
子实体样本的真菌种类,按0.5%的阈值,包括5门,15纲,54目,75科,覆盖157属,通过韦恩分析(Venns)核心菌群,发现真菌属水平上3个子实体样本中有83个共有属,占全部真菌属的22.6%。进一步对占比前20的真菌属进行Venns分析,发现3个子实体样本中,有16个共有属即子实体的核心真菌(Core microbiome),分别为Russula,Chrysosporium,Mortierella,Fusarium,Trichoderma,Aspergillus,Thielavia,Chaetomium,Stachybotrys,Saitozyma,Co⁃niochaeta,Tuber,Geminibasidium,Trechispora,Podos⁃pora,Alternaria(这些为核心菌群)。其中绝对优势真菌属为红菇属Russula,占比83%;其次是金孢菌属Chrysosporium,占比2.3%,是除红菇属外的优势真菌属(图1)。
2.2.2 细菌核心菌群及优势种群分析
红色红菇子实体细菌种类按0.5%的阈值已鉴定3门,6纲,11目,20科,104属。Venns分析核心菌群,在细菌种水平上3个子实体样本有11个共有种(Core microbiome),分别为Duganella,Pseudomo⁃nas,Luteibacter,Stenotrophomonas,Pandoraea,Burk⁃holderia-Paraburkholderia,Mucilaginibacter,Rhizobi⁃um,Variovorax,Dyella,Acidibacter。另外占比前20的细菌属进行分析,发现3个子实体样本有7个共有属:Duganella,Pseudomonas,Luteibacter,Burkhold⁃eria-Paraburkholderia,Mucilaginibacter,Rhizobium,Dyella(这些属为优势属)。其中杜檊氏属Duganella和假单胞菌属Pseudomonas为绝对优势属,占比分别达32%和20%(图2)。

图2 红色红菇子实体分离培养的前20种细菌属组成
2.3 红色红菇子实体微生物菌群之间的互作分析
2.3.1 真菌菌群之间的互作分析
OTU_1,OTU_2,OTU_3是红色红菇。表2中红色红菇OUT_1与OUT_6、OTU_13(g_Chrysosporium;s_Chrysosporium_undulatum)和OUT_2、OTU_3(Rus⁃sula_rosea)呈负相关关系,其他均为正相关,正相关最强是OUT_9。红色红菇OUT_1与OUT_6、OUT_13(金孢属Chrysosporium)负相关外,与其他属均呈正相关。

表2 红色红菇子实体丰度前10 OTU_中真菌微生物菌群之间的相互关系
2.3.2 细菌微生物菌群之间的互作分析
OTU_2和OTU_6是红色红菇子实体中的优势细菌属,然而这两种优势细菌呈负相关,相关系数达−0.96。由表3可知,OTU_2与OTU_19、OTU_9、OTU_3、OUT_6呈负相关关系,但与OUT_7正相关。OUT_6与OUT_7负相关,与OTU_19、OTU_9、OTU_3正相关。可见在红色红菇子实体中的微生物菌群中,以Duganella为优势的OUT_6和OTU_19、OTU_9,OTU_3处于一种功能群;而以Enterobacteriaceae为优势的OTU_2、OUT_7则处于另一类功能群。
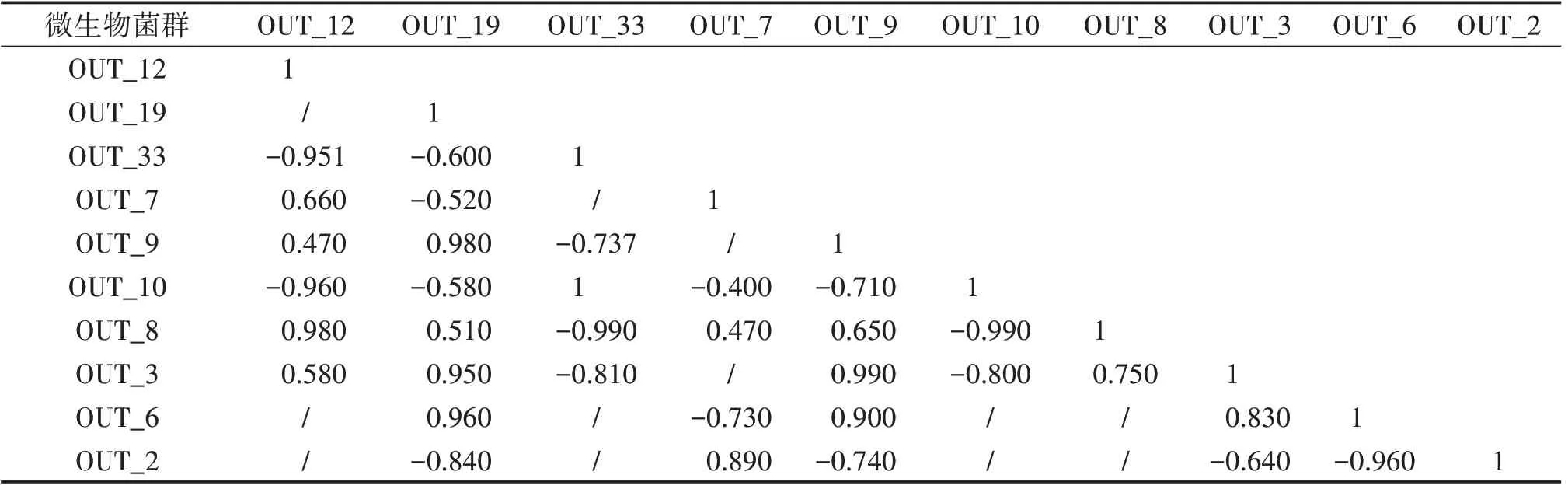
表3 红菇子实体丰度前10 OTU中细菌微生物菌群之间的相互关系分析
2.4 红色红菇子实体及子实体根际土壤微生物的分离
将从子实体及根际土分离纯化的微生物克隆测序的序列与NCBI数据库比对,鉴定分离培养菌的种类。由表4可见,红色红菇子实体中分离并鉴定3株真菌,其中2株为木霉属Trichoderma,另1株为拟盘多毛孢属Pestalotiopsis,但是没有分离到R.rosea。子实体根际土壤中分离并鉴定的5株真菌,其中1株只比对到目,为被孢霉目Mortierellales;另外4株鉴定到属,分别为Aspergillusparvulus,Chaunopycnissp.,Apiotrichum porosum,被孢霉Mor⁃tierellalessp.。从菌根土壤中分离并鉴定出细菌2个属,分别为Burkholderiasp.和Paraburkholderiasp.这些真菌和细菌分别为R.rosea菌根根际土壤的优势菌株。

表4 红色红菇子实体及根际土壤中分离鉴定的真菌、细菌菌株
3 小结与讨论
红菇及其共生树红椎CastanopsishystrixMiq.等所在生态系统影响着子实体与菌根,及其菌根根际土壤的微生物活动,因此,研究红菇微生物菌群多样性对其野生资源的保护及可持续发展具有重要现实意义。
首次通过高通量测序方法探讨了红色红菇R.rosea微生物多样性,初步了解R.rosea菌群种类组成和数量,子实体中真菌比细菌种类多。子实体真菌菌群中,绝对优势属为红菇属Russula,优势种为R.rosea,其次是金孢菌属Chrysosporium(是除红菇属外的另一优势真菌属);子实体细菌菌群中,Duganella和Pseudomonas为绝对优势属,Burkholderia-Paraburkholderia等为优势属。另外,在福建省古田县首次发现了Tuber,但是在红菇林中并没有采集到Tuber子实体,此项工作还有待进一步研究。在R.ro⁃sea菌群中,TOP10真菌OTU中,R.rosea与大部分OTU都成正相关,而与Chrysosporium_Chrysosporium呈负相关;TOP10细菌OTU中,发现呈拮抗作用的两种功能群,一种以Enterobacteriaceae为代表,另一种以Duganella为代表。R.rosea微生物分析对促进红菇子实体形成有重要作用,也为分离这些有益微生物并施入土壤提供可能,这些都将为提高红菇产量提供理论依据。
红菇属真菌为外生菌根真菌,分离培养困难,目前虽有红菇属分离成功的报道,但获得真红菇属菌丝体的极少[5,11−12],而且目前还无法人工栽培红菇[13]。刘斌[11]等培养观察红菇的分离物时发现,红菇菌肉的生殖菌丝是由球状胞(孢囊状菌丝)组成,埋在管状联络菌丝中,再生能力较低,因而采用菌肉组织作为分离菌株材料成功率低。因此红菇分离部位应选取菌柄中间的组织块。蔡小玲等[5]开展野生红菇的分离培养试验,采用PDA添加腐殖土培养基培养,分离培养正红菇子实体组织获得正红菇菌丝,并用该培养基扩大培养和保存。
笔者研究遗憾之处在于没有从子实体中分离培养出红菇菌株,仅培养出Trichoderma(木霉属)和Pestalotiopsis(拟盘多毛孢属);有可能是培养基未添加红菇所需的相关生长因子,即没找到合适的培养基,有必要进一步筛选合适的培养基。另外,从高通量测序也表明Trichoderma和Pestalotiopsis这两种微生物是R.rosea的优势菌,或者它们也和白木耳的伴生菌一样,有可能是红菇的伴生菌,该种推测是否准确还有待进一步研究。
红菇菌株未能成功分离,还有可能是在培养时红菇菌丝生长比较慢,木霉属和拟盘多毛孢属这两种真菌在现有的培养基中长势比红菇菌丝强,抢占了生长的时空生态位。因此可以考虑添加特异的抑制剂把快速生长的菌除去,生长比较慢的红菇菌丝才有可能生长,这也有待于进一步研究。
目前微生物菌剂备受关注,但国内对于红菇菌剂研究的报道很少,这可能也是国内红色红菇无法仿生栽培的原因之一。黄福常等[14]发现红菇可以在添加有正红菇菌剂RL的椎苗根际土壤中繁殖;赵志鹏[15]研究21种外生菌根菌在温湿度和寄主等不同生态条件下的耐受度以及它们之间的拮抗作用时,筛选出固体菌剂S.grevillei,从菌根土壤中培养出真菌Aspergillusparvulus,Chaunopycnissp.,Apiotri⁃chum porosum,Mortierellalessp.;菌根土壤中培养出细菌Burkholderiasp.,Paraburkholderiasp.,这些都是菌根土壤高通量分析出的优势菌。另外对菌根土壤分离并鉴定出的4个真菌和2个细菌优势菌株,由于培养基及培养条件等的限制,培养的菌株有限,尚待进一步鉴定到种的水平。张彤彤等[16]报道菌根微生物影响根际土磷和钾等矿质元素的吸收,另外,根际土酸碱平衡发生改变,pH的变化会进一步影响根际土微生物群落的变化,从而影响共生树木对土壤全磷、全钾养分的吸收。对这些菌应做初步生物学测定,探索其是否促进根系生长以及混合生长,为进一步开发混合菌剂,测试和推广奠定基础。添加一些益生菌,可能更有利于菌根的营养吸收和形成,促进红菇产量,保障利用红菇自然资源的可持续性。

