粪菌移植对肺炎克雷伯菌所致小鼠肝脓肿感染的抑制作用
王子逸儒,朱冬青,付金文,程宝乾,凌宗欣,陈楠
(1. 河北大学 基础医学院,河北 保定 071000;2.河北医科大学 临床学院,河北 石家庄 050031;3.浙江大学 医学院,附属第一医院,传染病诊治国家重点实验室,浙江 杭州 310003)
研究发现引起KLA感染的高致病性K.pneumoniae菌多为K1或K2血清型[3-4],该菌可能通过肠道异位引起KLA感染[5].本课题组研究发现K1型K.pneumoniae菌经口灌胃后引起小鼠KLA感染,而非K1或K2型K.pneumoniae菌采用同样的方法无法引起小鼠KLA感染[6],并且K1型K.pneumoniae菌经口灌胃后显著改变了小鼠肠道菌群结构,包括Lactobacillus在内的多个益生菌菌属所占比例显著下降[7].肠道菌群是抑制肠道外来病原菌入侵的重要屏障,而K1型K.pneumoniae菌所致肠道菌群结构的改变与KLA感染的发生密切相关.
粪菌移植(fecal microbiota transplantation,FMT)是将健康供体粪便中的肠道菌群移植到受体的胃肠道内从而改变受体肠道菌群组成,已被用于多种与肠道菌群紊乱相关的疾病治疗中[8].FMT在肠道病原菌所致感染的治疗中也取得了良好效果.研究报道FMT在肠道病原菌艰难梭菌所致感染(Clostridiumdifficileinfection,CDI)的临床治疗中取得了良好效果,尤其是对于复发难治型CDI感染,FMT治疗效果优于万古霉素等抗生素,显著降低了严重CDI感染患者的死亡率[9].本研究采用小鼠KLA感染模型,旨在探讨FMT对于高致病性K1型K.pneumoniae菌所致KLA感染的抑制作用,并对小鼠肠道菌群组成和肠道免疫防御分子进行检测分析,以明确其可能的作用机制.
1 材料与方法
1.1 主要试剂和仪器
成年雄性C57BL/6小鼠,5周龄,购自北京维通利华公司,动物合格证号:SCXK(京)2016-0006,于实验室喂养1周后进行实验;TRIzolTMReagen(Invitrogen,美国);逆转录实时定量PCR试剂盒(Promega,美国);MUC2抗体和TNF-α抗体(Santa Cruz Biotechnology,美国)用于Western blot检测;RIPA裂解液和辣根过氧化酶标记山羊抗小鼠IgG(上海碧云天生物技术公司,中国);酶联免疫吸附测定(ELISA)试剂盒(上海酶联生物科技有限公司,中国)用于检测胃肠黏液黏蛋白、防御素以及血清炎症因子的浓度;其余均为国产或进口分析试剂或材料,肠道菌群测序由上海美吉生物有限公司完成.
全波长Gen5酶标仪(BioTek Instruments,美国),7300Real Time PCR System(Applied Biosystems,美国),DYY-7C型电泳仪电源、DYCZ-25D型垂直电泳槽、DYCZ-40D型转印电泳槽均购自北京六一仪器厂.
1.2 方法
1.2.1动物模型与分组
SPF级C57BL/6雄性小鼠30只,随机分为3组:对照(Healthy)组、肺炎克雷伯菌(Kp)组、干预(FMT)组,每组10只.Kp组、FMT组经口灌胃给予106CFU K1血清型K.pneumoniae菌悬液;FMT组在给予Kp菌24h后经口灌胃0.3mL300mg/mL(活菌含量约为9.27×107CFU/mL)新鲜自制粪菌悬液,粪菌悬液来源于正常小鼠,参照文献[10]的方法制备;相同条件下,Healthy组和Kp组灌胃等体积生理盐水.于FMT处理24h后收集3组小鼠的血清、肠组织、胃肠黏液及盲肠内容物.
1.2.2肠道菌群测序
学校需要更新办学理念,在校企合作过程中最大程度地发挥企业的作用,通过企业掌握更多市场信息,进一步调整专业结构,改进教学方法和评价方法,培养出更多更好的实用型和技能型人才。要改变目前校企合作中“学校热、企业冷”的状况,进一步发挥政府统筹、协调作用,重视企业利益诉求,制定出有利于促进校企合作的政策,建立起一套较为合理的校企合作利益分配机制、动力驱动机制、奖励激励机制和沟通协调机制,使企业在校企合作中获得利益。
将小鼠盲肠内新鲜粪便放入无菌冻存管中立即置于液氮保存,随后提取粪便样品DNA,在Illumina MiSeq PE300平台进行肠道菌群16S rRNA测序,序列递交到NCBI的SRA数据库(序列号:PRJNA717064).使用UPARSE软件根据97%的相似度对序列进行OTU(operational taxonomic units)聚类并剔除嵌合体.对获得OTU进行生物信息统计分析,包括Alpha多样性指数Shannon、Simpson、Ace和Chao,其中Shannon和Simpson指数反映微生物多样性,Ace和Chao指数反映微生物丰度;采用主成分分析(principal coordinate analysis,PCoA)对β多样性进行分析,比较不同组间肠道菌群差异性;采用线性判别分析(linear discriminant analysis effect size,LEfSe)对差异组分进行分析.
1.2.3ELISA检测血清炎症因子和胃肠黏液免疫防御分子
眼球取血后,离心取上清液用于ELISA检测肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)、白介素1β(interleukin-1β,IL-1β)浓度.取胃、肠内容物于1.5mL无菌EP管中置于冰上,加等体积的无菌PBS,涡旋混匀,12000r/min4℃离心10min,取上清液用于ELISA检测黏蛋白1(mucin1,MUC1)、MUC2和防御素分子浓度.依照ELISA试剂盒说明书进行检测,根据标准曲线得出检测样品浓度.
1.2.4实时定量PCR检测肠组织TNF-α、MUC2的mRNA表达
TRIzol法提取肠组织mRNA,检测浓度后依据反转录试剂盒说明书操作,将提取的mRNA逆转录为cDNA.以β-actin作为内参,采用实时定量PCR法检测目的基因TNF-α、MUC2的mRNA表达.
1.2.5 Western blot检测肠组织TNF-α、MUC2蛋白表达
使用RIPA法提取肠组织总蛋白,采用BCA法进行蛋白定量,依次进行电泳、转膜、封闭、洗涤、一抗孵育过夜、洗涤、二抗室温孵育、洗涤、显影,以β-actin作为内参,检测目的蛋白TNF-α、MUC2蛋白表达情况.
1.2.6 统计学分析
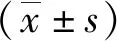
2 结果
2.1 FMT处理对小鼠KLA感染率和盲肠内菌群整体结构影响
在小鼠经口灌胃K1型K.pneumoniae菌48 h后,与Kp组相比,FMT处理组小鼠KLA感染率显著下降(P<0.05)(图1a).在本课题组先前的研究中发现K1型K.pneumoniae经口灌胃48 h后引起了约30%小鼠出现KLA病理改变,但所有小鼠的肠道菌群在K1型K.pneumoniae菌经口灌胃后均发生了明显改变[7].为了明确FMT处理小鼠是否改变了K1型K.pneumoniae菌导致的小鼠菌群组成变化,随机选取了Kp组和FMT处理组中未出现明显病理改变的小鼠各5只与Healthy组一起进行盲肠内容物菌群16S rRNA高通量测序.
图1 小鼠KLA感染率(a)和β多样性PCoA分析(b)(*P<0.05)Fig.1 KLA infection rate in mice (a) and PCoA analysis for β diversity (b)(*P<0.05)
3组小鼠每组5只共获得757 475条高质量序列,对3组序列进行生物信息学分析.α多样性指数Shannon、Simpson、Ace和Chao在3组之间无统计学差异(P>0.05)(表1).β多样性采用PCoA分析,结果表明3组之间存在明显差异(P<0.05)(图1b).
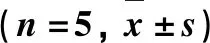
表1 3组小鼠肠道菌群α多样性分析Tab.1 α diversity of intestinal microbiota in three group mice
2.2 FMT对K1型K.pneumoniae 菌所致小鼠菌群组成变化的影响
为了进一步明确FMT处理对K1型K.pneumoniae菌所致小鼠菌群组分改变的影响,采用LEfSe对Kp组和FMT组小鼠菌群差异组分进行进一步的分析,且LDA(Linear discriminant analysis)评分相差2倍以上组分被列出(图2).
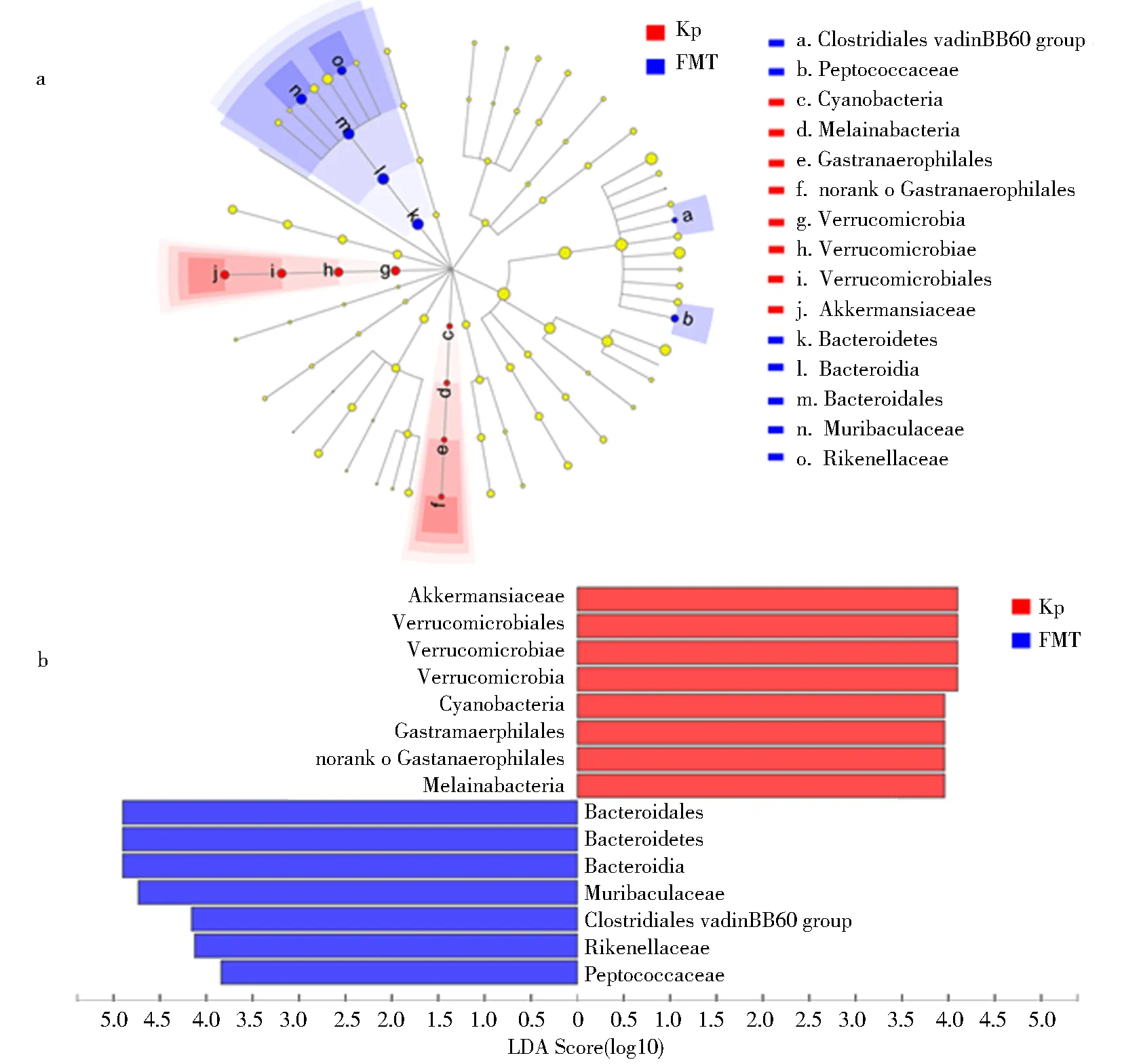
a.LEfSe分析得出Kp组()和FMT组()小鼠肠道菌群主要差异组分;b.LDA评分大于2的菌群组分.图2 Kp组和FMT组小鼠肠道菌群主要组分差异Fig.2 Taxonomic cladogram showed enriched taxa in Kp and FMT group
与Kp组相比,在门的水平上,FMT组Bacteroidetes丰度显著增加;在科的水平上,FMT组Muribaculaceae和Rikenellaceae的丰度显著增高(P<0.05)(图3a-b).在属的水平上,着重比较了2组中主要的菌属(在总DNA序列占比>1%)差异.结果表明,与Kp组相比,FMT组中Lachnospiaceae_UCG_006、Alloprevotella、Alistipes和norank_f_Muribaculaceae菌属丰度显著增加,Akkermansia菌属丰度显著降低(P<0.05)(图3c).
为了明确FMT处理是否完全恢复了K1型K.pneumoniae菌导致的小鼠菌群失衡,比较了FMT组和Healthy组小鼠盲肠内容物菌群组成差异.结果表明,2组在门水平丰度上没有明显差异.与Healthy组相比,在纲的水平上,FMT组Bacilli丰度明显降低;在科的水平上,FMT组Rikenellaceae丰度明显增加;在属的水平上(在总DNA序列的菌属占比>1%),FMT组Ruminiclostridium_9、Bacteroides和Alistipes菌属丰度明显增加,同时Lactobacillus菌属丰度显著降低(P<0.05)(图3d-f).
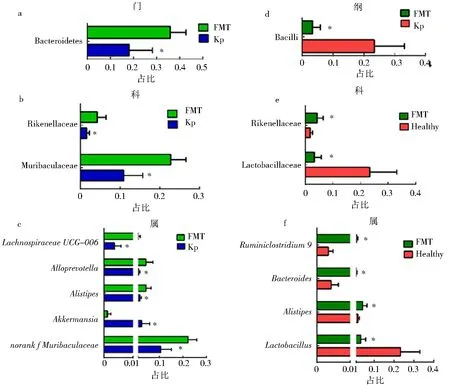
a,b,c.Kp组()和FMT组()在门、科和属的水平上差异显著的组分;d,e,f.FMT组()和Healthy组()在纲、科和属的水平上差异显著的组分(* P<0.05).图3 在不同门类水平比较小鼠肠道菌群组分差异Fig.3 Comparison of the relative abundant bacterial sequences at the different levels
2.3 FMT对K1型K.pneumoniae 菌所致小鼠免疫防御因子改变的影响
本课题组先前研究发现K1型K.pneumoniae菌灌胃后导致小鼠胃肠道免疫防御因子发生了明显改变[11].为了进一步明确FMT处理是否纠正了K1型K.pneumoniae菌导致的小鼠胃肠道免疫防御因子改变,采用ELISA法比较了免疫防御因子的表达水平.结果显示,与Kp组相比,FMT处理组小鼠血清TNF-α、肠防御素β-defensin 1和α-defensin 6、胃防御素β-defensin 1水平显著下降(P<0.05);同时肠黏蛋白MUC2水平显著增高(P<0.05)(图4).进一步比较了肠组织TNF-α和MUC2 mRNA与蛋白的表达,结果显示与Kp组相比,FMT处理组TNF-αmRNA(图5a)表达明显下降(P<0.05),同时TNF-α蛋白表达也下降(图5b);而MUC2mRNA(图5c)表达显著增高(P<0.05),并且MUC2蛋白表达增多(图5d).
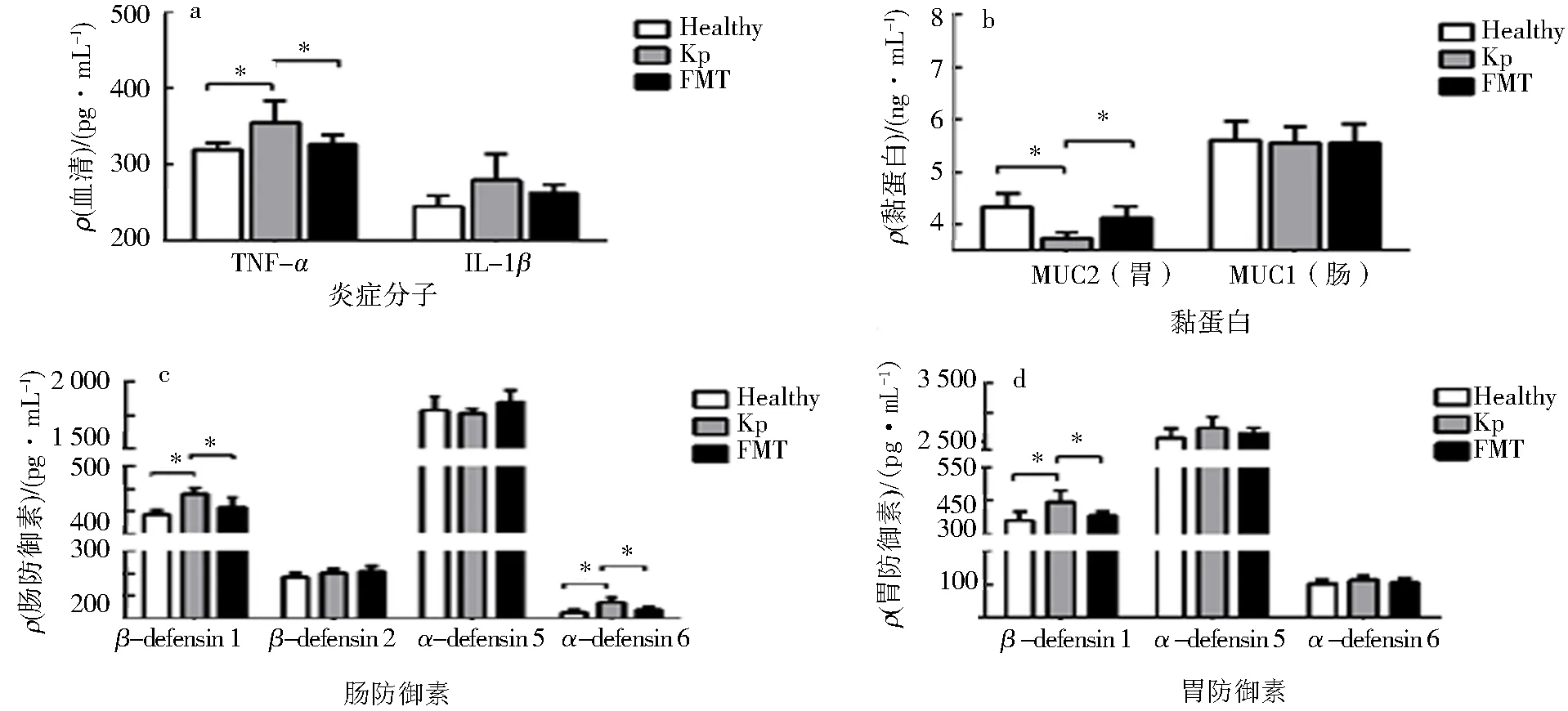
a.血清免疫炎症分子;b.胃、肠黏蛋白;c.肠防御素;d.胃防御素.*P<0.05.图4 FMT处理对小鼠免疫防御分子水平的影响Fig.4 Effect of FMT treatment on levels of immune defense factors in mice
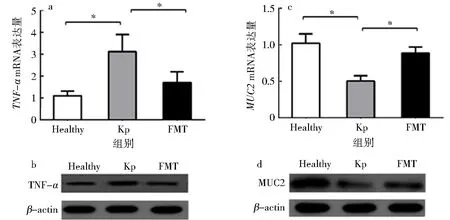
a.TNF-α mRNA;b.TNF-α蛋白;c.MUC2 mRNA;d.MUC2蛋白(*P<0.05).图5 FMT处理对小鼠肠组织TNF-α、MUC2表达的影响Fig.5 Effect of FMT treatment on the expression of TNF-α and MUC2 in intestine
3 讨论
研究表明,FMT可以有效消除耐药病原菌的肠道定植[12],且FMT也被用于肠道病原菌异位感染的临床治疗中.临床病例报道,广谱β-内酰胺酶耐药K.pneumoniae菌株肠道异位后引起肾移植病人反复尿路感染,采用FMT治疗取得了良好的效果[13].本研究也证实应用FMT显著降低了K1型K.pneumoniae菌肠道异位后引起的小鼠肝脏KLA感染率.
研究显示,FMT通过有效恢复肠道菌群失衡从而达到治疗疾病的目的[8].在CDI感染患者的FMT治疗中,研究发现FMT处理1 d后患者肠道菌群显著恢复且与正常肠道菌群组成最为相似[14].本课题组先前研究发现K1型K.pneumoniae菌经口灌胃后引起小鼠肠道菌群发生明显改变[7].本研究也比较了FMT处理1 d后小鼠肠道菌群的改变情况.结果表明,FMT处理1 d后显著改变了高致病性K1型K.pneumoniae菌所致小鼠肠道菌群组成的变化,明显增加了Alloprevotella、Lachnospiraceae_UCG_006等菌属的丰度.益生菌Alloprevotella已被证明可以产生短链脂肪酸,维护肠道菌群屏障[15-16].在阿霉素诱导的心脏中毒小鼠模型中,FMT处理后增加了Alloprevotella的丰度,改变了肠道菌群组成[17].Lachnospiraceae科细菌的代谢产物可以调节次生胆囊酸形成,维护肠道生理功能[18].在CDI小鼠感染模型中,FMT处理增加了Lachnospiraceae中细菌的丰度[19].另外,本研究显示FMT处理1 d后小鼠肠道菌群未能完全恢复到正常小鼠肠道菌群组成,主要差异包括FMT处理组中Ruminiclostridium_9等菌属的丰度显著增高,Lactobacillus菌属的丰度明显降低.Ruminiclostridium_9是结肠腔内重要的菌属成员,可产生多酶复合物降解多糖,并且可以抑制炎症反应[20-21].本课题组先前研究显示,KLA感染小鼠Lactobacillus菌属丰度明显降低[13],本研究中FMT处理后Lactobacillus菌属丰度未能恢复到正常小鼠水平.因此推测FMT对于K1型K.pneumoniae菌所致肠道菌群失衡的纠正可能主要是增加了Alloprevotella、Lachnospiraceae_UCG_006、Ruminiclostridium_9等优势益生菌属的丰度,而与Lactobacillus菌属无关.
除肠道菌群外,肠腔表面的黏液层也参与了对外来病原菌的抵御作用.肠道黏液层包含有防御素、黏蛋白等成分,在防止致病菌入侵和维持肠道黏膜的免疫稳态中发挥着重要作用[22].本课题组先前研究发现K1型K.pneumoniae菌经口灌胃后导致胃肠道内防御素分子浓度增高[11].在本研究中,FMT处理后显著降低了K1型K.pneumoniae菌导致的胃肠道防御素分子水平的增高.推测可能是FMT的应用抑制了肠道内K1型K.pneumoniae菌对于防御素的诱导刺激.在应用FMT治疗万古霉素耐药的肠球菌(vancomycin-resistantEnterococcus,VRE)感染小鼠的研究中,FMT处理后也显著降低了防御素分子水平[23].MUC2是肠道主要的黏蛋白,与肠道菌群共同抵御外来的病原菌[24].溃疡性结肠炎临床病人MUC2蛋白合成下降且分泌减少[25].FMT处理增加了自闭症模型小鼠肠道MUC2分子的表达[26].在本研究中FMT处理也增加了肠道MUC2分子的表达.推测其可能机制是由于FMT处理引入了利用乳酸的Bacteroides细菌,这些细菌的生物代谢过程维持了肠腔内pH值,从而促进了黏蛋白的产生[27].此外,研究显示FMT处理还改变了炎症因子的水平.例如,在溃疡性结肠炎小鼠模型中,FMT显著降低了TNF-α和IL-1β的水平[28];在肝性脑病大鼠模型中,FMT显著降低了肝脏中TNF-α、IL-1β和IL-6等因子的水平[29].在本研究中,FMT处理后显著降低了K1型K.pneumoniae菌导致的TNF-α分子水平的增高.由此可见,胃肠道相关免疫因子也参与了FMT对K1型K.pneumoniae菌所致小鼠KLA感染的抑制作用.
综上所述,FMT处理可以降低高致病性K1型K.pneumoniae菌导致的小鼠KLA感染,其机制可能与FMT纠正了K1型K.pneumoniae菌所致肠道菌群组成改变以及胃肠道免疫防御因子改变有关.在目前抗生素应用导致耐药菌日益增多的情况下,FMT作为K1型K.pneumoniae菌所致KLA感染的新型治疗方法具有一定的应用前景和优势.
致谢:感谢河北大学附属医院中心实验室博士后工作站对于本工作给予的帮助和支持.

