CT影像组学模型对食管癌术后个体化辅助治疗的评估价值
莫笑开, 林少帆, 伍光恒, 陈焯枝, 郑旭峰, 胡泽桓, 肖健宁, 林黛英*, 张水兴*
(1. 暨南大学 附属第一医院 影像科, 广东 广州 510630; 2.汕头市中心医院 放射科, 广东 汕头 515041; 3.暨南大学 信息科学技术学院, 广东 广州 510632)
食管癌是我国排名第6的常见癌症并且在各地区中均是主要的恶性肿瘤死因之一,主要的病理组织学类型为鳞状细胞癌,以男性多见,农村多于城市[1]。食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)的治疗方式多样,手术治疗仍是公认食管癌的最有效治疗方法。对于ESCC局部晚期患者,可通过手术及术前新辅助放化疗、术后辅助放化疗或根治性放化疗等方式仍能达到良好的预后[2-3]。然而,肿瘤切除术后的复发、转移是导致手术治疗失败的主要原因,约43%~53%的患者术后出现复发、转移,中位复发时间为10~12个月[4-7]。肿瘤复发后生存预后令人沮丧[7],中位生存期仅3个月,2年生存率仅7%[8]。多个回顾性研究表明术后辅助治疗较单纯手术延长了术后的生存时间、复发时间[9-12],尽管如此,美国国家综合癌症网络指南中仍未明确术后放化疗的地位[13]。因此,构建个体化预测患者术后复发、转移风险的模型,并探讨术后辅助治疗的必要性、有效性,可协助精准诊疗,从而可有效延长患者的无病生存期(disease free survival, DFS)。
影像组学是一种通过深度挖掘医学图像上的一阶、二阶及高阶的海量肿瘤纹理特征,反映肿瘤的病理生理学信息及内部异质性的技术方法,较传统的临床肿瘤分期提供了更多信息,并用于肿瘤诊断、疗效评估及预后预测[14-15]。影像组学分析在手工预定义的特征提取及机器学习建模的基础上,还增加了深度学习的特征提取及建模,有效提高对图像特征的提取及分析应用能力,从而提高模型的预测效能[16]。影像组学模型对可切除性食管癌的术前精准分期[17]、新辅助治疗的疗效评估[18]及术后的生存预后[19]评估,因此具有重要的预测价值。然而ESCC的治疗方案多样,部分患者手术治疗后仍需要进一步行辅助治疗,但并非所有患者能从辅助治疗中获益。因此,研究者需要进一步探讨能从辅助治疗获益的患者群体,以延长患者的DFS,实现个体化的精准治疗。
因此,本研究通过构建及验证CT影像组学模型预测食管鳞状细胞癌切除术后的进展风险,并进一步探讨术后个体化辅助治疗的临床意义。
1 材料和方法
1.1 研究对象
回顾性分析2013年2月至2019年8月共184例经病理证实的食管鳞状细胞癌病例。本研究通过暨南大学附属第一医院伦理管理委员会批准(批准号:KYk-2022-012)。纳入标准:(1)接受了根治性食管癌手术的患者;(2)术后病理组织学类型为鳞状细胞癌;(3)术前行完整的胸部CT平扫及增强检查;(4)临床资料及随访资料完整。排除标准:(1)食管多中心癌、合并或既往存在其他肿瘤或严重疾病(如严重心脑血管疾病、终末期肾病、重症肝炎等);(2)既往胸部手术史;(3)年龄>75岁或者<18岁;(4)图像质量欠佳或食管癌病灶过小无法勾画感兴趣区;(5)术后随访时间小于半年。本研究的临床终点指标为DFS, DFS定义为首次影像学检查时间至最后的随访时间;终点事件发生定义为自确诊之日起至出现任何的复发、转移。随访期间未发生终点事件的患者为删失值。纳入的全部病例作为训练集,从全部病例中随机抽取约1/3的病例作为内部验证集。
1.2 CT检查方案
所有患者均进行多层螺旋CT检查,共涉及3种机型,包括GE lightspeed VCT、Philips ingenuity core 128和Siemens Definition Flash。设备及扫描参数具体如下,管电流设定范围为120~142 mAs,管电压设置均为120 kV,层厚为5 mm,三种机型的螺距设定分别为1.375、1、1,探测器准直设定为64 mm×0.625 mm,矩阵为512×512。增强扫描方案如下:碘对比剂用量1.5 mL/kg,注射后27 s扫描动脉期,注射开始后1 min扫描静脉期。本研究的图像统一使用5 mm层厚的食管CT平扫期及增强静脉期图像。
1.3 影像组学分析处理流程
图像获取与勾画感兴趣区。首先将所有患者胸部增强CT的医学数字影像和通信标准(digital imaging and communications in medicine,DICOM)格式图像导出,包括平扫期、动脉期、静脉期的图像。然后由一位具有8年影像诊断工作经验的放射科医师使用ITK-SNAP (Version 3.40; http://www.itksnap.org)选取肿瘤的最大层面并人工勾画肿瘤感兴趣区(region of interest, ROI),避开食管空腔及周围其他组织结构,同时勾画同一患者的平扫期及静脉期的同一肿瘤最大层面。为了评估影像组学特征的可重复性及稳定性,需要评估测量者内的一致性(intraclass correlation coefficients,ICCs)。同一位医师在3个月后重新勾画随机抽取的30位患者图像的ROI。
采用Python 3.6 (Version 2.1.2;https://pyradiomics.readthedocs.io/en/latest/index.html)中的PyRadiomics开源工具箱,分别提取肿瘤ROI的影像组学特征,并计算影像组学特征的ICCs,筛选出ICC>0.9的可重复性及稳定性高的特征。同时,通过最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)进一步降维时,同时采用10倍交叉验证,以筛选出稳定的特征,且尽量避免过度拟合。
1.4 构建模型及其效能评估
经LASSO降维后的特征用单因素与多因素Cox回归分析得出与DFS相关的组学特征。通过LASSO-Cox回归将最终筛选出的n个显著性特征用其系数加权构建影像组学模型,该模型用于计算Rad得分(radiomics score),其公式为(Rad得分=特征1×系数1+特征2×系数2+…+特征n×系数n)。计算每个患者的Rad得分,并根据X-tile最佳截止点将患者分为肿瘤进展高风险组和低风险组。在临床模型的构建方面,纳入的临床资料包括有:年龄、性别、吸烟、饮酒、肿瘤家族史、活动状态评分、肿瘤位置及长度、最大肿大淋巴结短径、术后病理分期、肿瘤分化程度、手术切缘、脉管浸润及癌栓、治疗方案。采用单因素及多因素Cox回归分析构建临床模型。综合影像组学模型与临床模型后获得影像组学-临床模型。
采用一致性指数C指数(concordance index)评估各模型的预测值与真实值之间的差别。采用Kaplan-Meier生存曲线分析和log-rank检验评价各模型的风险分层能力。绘制校准曲线图评估模型的校准度,直观地显示模型估计的DFS与实际观察到的DFS的接近程度,通过Hosmer-Lemeshow拟合优度检验计算P值,P>0.05,当预测值与实际值无统计学差异,提示模型校准度良好。
1.5 统计学分析
本研究数据统计均使用R软件(version 3.5.1)。“psych”软件包用于计算ICCs;“glmnet”软件包用于LASSO-Cox分析;“survival” 软件包用于建立Cox比例风险模型和计算C指数,绘制Kaplan-Meier曲线;“rms”软件包用于绘制校准曲线。统计软件包用于连续变量的独立样本t检验,分类变量的卡方检验和Mann-WhitneyU检验。统计分析所有检验均为双侧检验,P<0.05 认为差异有统计学意义。
2 结果
2.1 病例资料
收集食管癌根治术后病例共317例,术后病理证实为食管鳞状细胞癌者273例,排除图像平扫期/静脉期不齐全、肿瘤病灶过小无法勾画感兴趣区的病例后共225例,排除随访时间<6个月的病例,最终共纳入184例患者,其中达到终点事件仅89例。所有患者的DFS中位数是17个月(6.7~71个月)。184位患者作为训练集,并以30%的比例随机抽取56位患者作为验证集,训练集与验证集的DFS无统计学差异。训练集及验证集中除了病理淋巴结分期有统计学差异(P<0.001),其余各基线特征无统计学差异。训练集及验证集临床特征见表1。
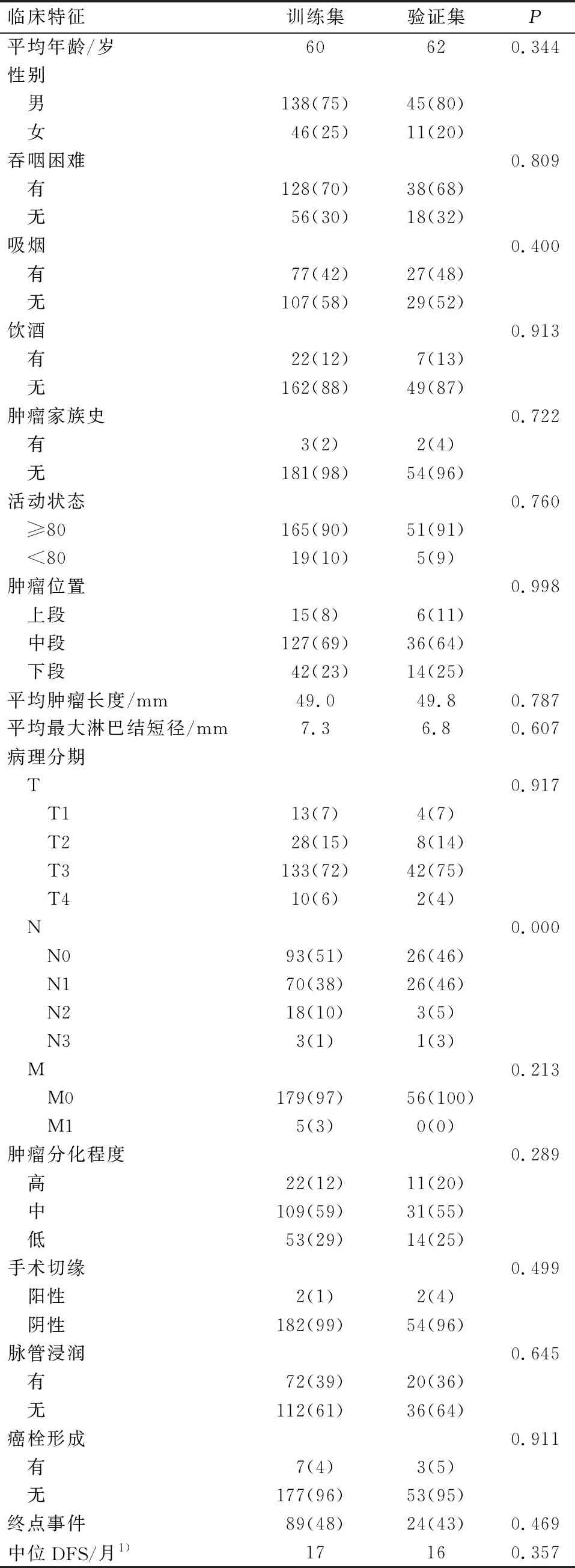
表1 训练集及验证集临床特征
2.2 影像组学模型建立及验证
分别提取到基于平扫期及静脉期图像的影像组学特征各1 216个,2期共2 432个。通过选择ICC>0.90的特征,其中平扫期图像的有636个,静脉期图像的有669个特征,进一步采用LASSO进行特征降维和进行Cox回归分析后,最终筛选出10个与DFS相关的影像组学特征,其中平扫期6个,静脉期4个,分别用于建立影像组学模型(表2)。使用该影像组学模型计算每个患者的Rad评分后,通过X-tile产生的最佳截止值为9.36,将患者分为高风险组(Rad评分≤9.36)和低风险组(Rad评分>9.36)。

表2 CT平扫及静脉期图像的有效影像组学特征
影像组学模型的区分度较佳,其在训练集的C指数为0.788,95% 置信区间(confidence interval, CI)为0.719~0.857,验证集的C指数为0.758, 95% CI为0.631~0.885。通过Rad评分的截点值分为术后进展高风险组及低风险组,绘制训练集及验证集中高、低风险组的Kaplan-Meier生存曲线。在训练集中,高风险组和低风险组的中位DFS分别为16个月和33个月,P<0.001;在验证集中,高风险组和低风险组的中位DFS分别为15个月和24个月,P=0.006 (图1a)。因此,影像组学模型可预测患者术后的DFS,并能区分出进展高风险的患者。
2.3 临床模型的建立及验证
将纳入的临床因素进行单因素Cox回归分析,结果显示最大肿大淋巴结短径、病理T分期、病理N分期与患者术后生存相关性高(P值分别为0.006及0.022、P<0.001),其他因素的P值为0.114~0.984(P>0.05)。经多因素Cox回归分析后,病理N分期(P=0.001)是预测DFS的独立风险因素。尽管如此,病理N分期的临床模型的区分度欠佳,其在训练集中的C指数为0.630 (95% CI:0.572~0.689),验证集中的C指数为0.586(95% CI:0.476~0.696)。在训练集中,高风险组和低风险组的中位DFS分别为19个月和33个月,P<0.001;在验证集中,高风险组和低风险组的中位DFS分别为22个月和25个月,P=0.348 (图1B)。表明了该临床模型在训练集中尚能区分术后进展高低风险人群,但在验证集中其区分度欠佳。
2.4 综合模型的建立及验证
综合影像组学模型与临床模型后得到影像组学-临床模型,该模型具有较佳的区分度,其在训练集中的C指数为0.744 (95% CI:0.689~0.799),验证集中的C指数为0.774 (95% CI:0.676~0.872)。在训练集中,高风险组和低风险组的中位DFS分别为16个月和39个月,P<0.001;在验证集中,高风险组和低风险组的中位DFS分别为11个月和24个月,P<0.001 (图1C)。提示该模型可预测患者术后的DFS及区分术后肿瘤进展高低风险人群。同时,在训练集的进展低风险患者中,手术后辅助治疗患者与单纯手术患者的DFS比较无显著统计学差异(DFS分别为34.4个月,32.5个月,P=0.816)(图2B)。在训练集的进展高风险患者中,单纯手术患者比手术后辅助治疗的DFS长4.2个月(P=0.028)(图2A)。
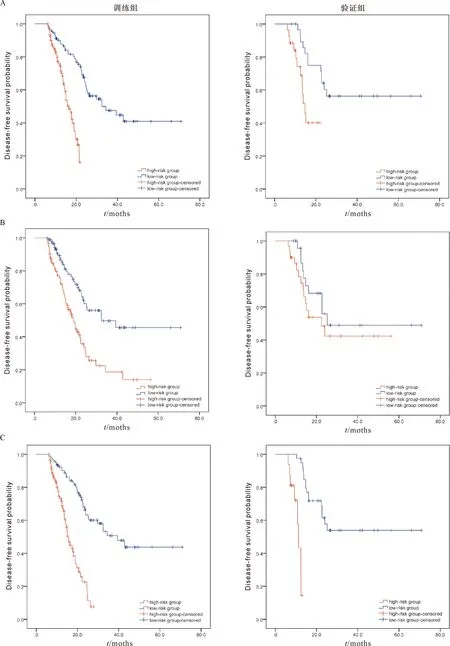
high-risk group:高风险组;low-risk group:低风险组;censored:删失值
2.5 校正曲线
分别绘制了影像组学-临床模型的术后1年、2年和3年的DFS预测校准曲线图,其DFS预测值与临床实际观察值均相对较为接近 (图2C)。Hosmer-Lemeshow检验(P=1)验证了预测值和实际临床观察值之间存在一致性(校准度)。
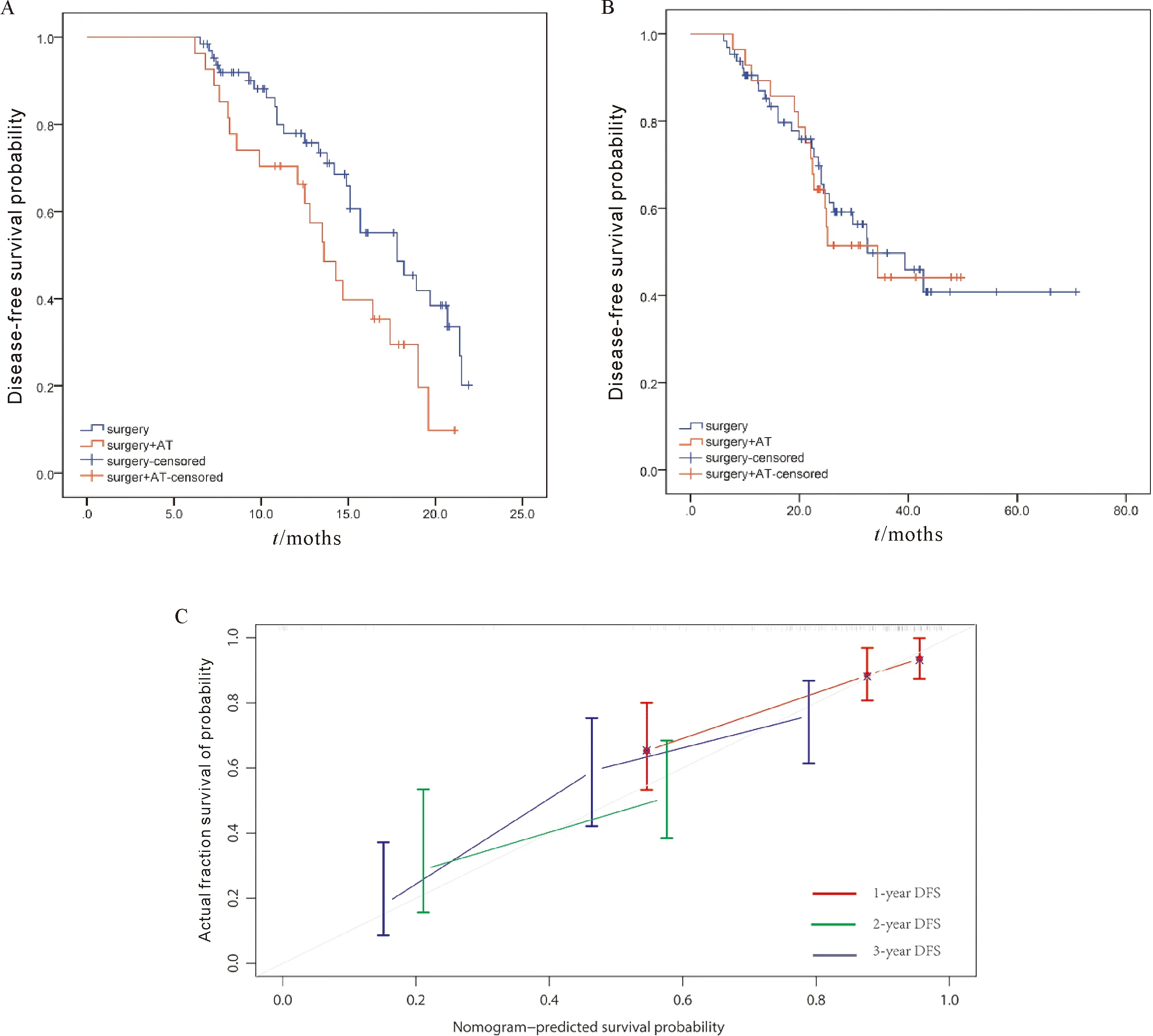
surgery:手术;surgery + AT: 手术及辅助治疗;censored:删失值; DFS:无病生存期
3 讨论
本研究基于CT图像提取的影像组学特征,构建了用于预测食管鳞状细胞癌患者DFS的影像组学模型,该模型有效识别肿瘤进展高风险人群,发现病理N分期是独立的DFS临床风险因素。影像组学-临床模型在训练集及验证集中均能良好地区分DFS进展高低风险患者。
肿瘤的内部异质性表现为不同表型的肿瘤细胞亚群及其内部的分布的空间及时间的差异,导致肿瘤对不同治疗手段的敏感性不同[20]。影像组学模型特征是通过提取CT平扫图像及静脉期图像的强度、形状和纹理特征等高维度特征,并降维、筛选后得到与预后相关的有效特征,该特征能有效地反映ESCC的肿瘤内部异质性、生长微环境等微观层面信息,可作为ESCC手术切除后DFS无创的预后生物标志物。影像组学模型在预测ESCC的新辅助放化疗或根治性放化疗中取得良好的疗效评估效能[18,21]。对于接受食管癌切除术的患者,其术前的临床TNM分期具有重要的预后预测意义,然而,本研究中影像组学模型的预后预测效能显著高于传统的临床分期模型。多个研究也表明对接受手术治疗的肿瘤,影像组学模型较传统的TNM分期可提供更多维度的预后信息[22-23]。因此,本研究中的影像组学模型能良好地预测ESCC患者术后的进展风险,从而识别肿瘤进展高风险患者,并及时调整术前及术后的辅助治疗手段,使得患者获益最大。
ESCC的术后病理TNM分期是最为准确的食管癌分期,其生存预后信息具有重要的临床价值。术后病理N分期是依据区域淋巴结的转移的数目,病理淋巴结转移是ESCC的预后不良的一个重要因素[24-25]。本研究中亦提示病理N分期是ESCC术后进展高风险的独立风险因素。影像组学模型是基于肿瘤原发灶的特征构建的,内蕴含部分淋巴结转移信息[17],但结合病理N分期后提高了影像组学的预测效能。
ESCC术后是否需要辅助治疗及其疗效存在一定争议[26-27]。但对于ESCC切除术后存在病理淋巴结转移的患者,术后辅助治疗可以有效延长3年及5年生存率[26,28]。本研究中进展高低风险患者的均存在不同程度的淋巴结转移,但并非所有的患者都能从术后辅助治疗中获益,在食管癌切除术后进展低风险的患者中,其手术及术后辅助治疗与单纯手术的DFS并无统计学差异。因此,对于该部分患者无须进行术后辅助治疗,从而减轻患者的心理负担,并提高患者的生活质量。因此,影像组学模型比传统的病理N分期提供了更多的预后信息,并有效提示术后进展低风险患者无须进一步行辅助治疗。
本研究仍有一定局限性。(1)本研究为单中心回顾性研究,相对于多中心的研究,缺乏外部验证集的验证。虽然在内部验证集中影像组学-临床模型能达到良好的预测效能,尚需扩大验证范围。(2)本研究的ROI选用的食管癌的最大横断位而非全瘤体积,既往研究中以肿瘤最大层面作为ROI构建的组学模型亦能达到良好的预测效能[29],体现了单肿瘤层面的影像组学模型能较大程度地反映肿瘤的内部异质性,并具有良好的预测价值。(3)当前食管癌治疗方式尚存在较多争议,因为术后辅助治疗缺乏相应的随机对照研究的证据,术后辅助治疗并未列入国际指南中,但仍有多个研究提示术后辅助治疗比单纯手术能够延长患者的生存时间[9-12],对于本研究中的进展低风险患者,术后辅助治疗并未能有效延长患者的DFS。因此,在日后研究中仍需要探讨术后辅助治疗在ESCC患者个体化治疗中的价值,以提高术后辅助治疗的患者获益程度,推进肿瘤个体化诊疗。
本研究基于食管鳞状细胞癌治疗前的CT图像及病理N分期的临床风险因素构建了影像组学-临床综合模型,该模型具有良好的肿瘤预后预测效能,可用于预测食管鳞状细胞癌切除术后的进展高低风险人群,并提示对低风险人群无须进一步术后辅助治疗,为临床提供了一种可靠且便捷辅助精准诊疗的工具。
作者贡献声明
莫笑开:提出研究思路,参与数据分析,制图与撰写论文;林少帆:数据收集及图像导出;伍光恒:数据分析,统计分析数据;陈焯枝:图像勾画;郑旭峰:临床数据收集及初步分析;胡泽桓:临床数据收集及图像导出;肖健宁:图像数据整理;林黛英:研究思路的制定,提供研究病例,参与分析;张水兴:提出研究思路和框架,统筹数据分析方案、制图方案,修改论文。
利益冲突声明
本研究未受企业、公司等第三方资助,不存在潜在利益冲突。

