尖孢镰刀菌转化表达松材线虫Bx−apa−2 和Bx−apm−2 基因dsRNA 以及饲喂法介导的RNAi 研究
松材线虫(Bursaphelenchus xylophilus)是引起松树萎蔫病的主要元凶,对世界范围内的松林造成极大的危害[1]。目前,对该病的防治,主要是针对其媒介昆虫天牛(Monochamusspp.)进行药物防治[2],但是这种方式极易在自然界中产生药物残留而造成生态环境的次级危害。RNA 干扰(RNAi),作为一种常用的研究技术,目前已有转基因植物表达双链RNA(dsRNA)并对其寄主生物进行抵抗的报道,而且这种防御策略不会造成生态环境的破坏,因而具有较大的潜在应用价值[3−4]。在秀丽线虫的研究中,通过饲喂其表达靶基因dsRNA的大肠杆菌(Escherichia coli)可以引起秀丽线虫特定的RNAi 效应[5],即饲喂法介导的RNAi。在松材线虫中,通过饲喂表达其靶标基因dsRNA 的真菌,同样也可以使线虫产生特定的RNAi 效应[6]。最近的研究表明,哺乳动物胃中的SIDT1 蛋白可以介导食物miRNA 的吸收,进而使其在动物体内发挥生物学功能[7]。这表明,食源性的核酸分子可能对动物机体产生广泛性的影响。因此,饲喂法介导的RNAi 技术无论是在动植物疾病防控还是人类医疗中均有潜在的应用价值。
衔接蛋白(AP)是一种由多亚基组成的异四聚体蛋白复合物,其介导参与细胞膜上网格蛋白的作用以及识别跨膜蛋白分子胞质尾区的分选信号[8]。迄今为止,在哺乳动物和拟南芥中发现了5种AP(1−5)蛋白,而在酿酒酵母(Saccharomyces cerevisiae)、秀丽隐杆线虫(Caenorhabditis elegans)以及黑腹果蝇(Drosophila melanogaster)中仅发现3 种AP 蛋白(AP1−3)。物种间各种AP蛋白的组成基本相同,均是由2 个大亚基,1 个中亚基和1 个小亚基组成的异四聚体结构[9−10]。在这之中,AP2 主要与网格蛋白相互作用,负责将其组装到质膜上。AP2 蛋白的β 亚基上铰链及相关结构域可结合网格蛋白,而其他α 和β 亚基的区域则负责募集动力蛋白和调节蛋白。秀丽隐杆线虫中,apa−2基因编码了AP2−α 大亚基。在果蝇中,AP2−α 大亚基无效等位基因可产生神经肌肉接头处没有突出小泡,破坏细胞的内吞作用并导致胚胎的死亡[11]。在秀丽隐杆线虫中,apm−2基因编码了AP2−μ 中亚基,功能上可与受体上的酪氨酸富含区域相结合,促进受体与网格蛋白包被的相互作用,并识别受体胞质尾区“YXXφ”分选信号,调控受体与配体的内吞过程[12−13]。降低该基因的表达可导致秀丽隐杆线虫胚胎致死和幼虫发育停滞,对维持正常神经元的功能是必需的[14]。另有研究指出,无效突变AP2−α 或AP2−μ 的秀丽隐杆线虫是可存活的,主要表现出30% 左右的突触囊泡数量下降;但α−μ2 同时突变则会造成突触囊泡数量70% 的下降,并导致明显的致死现象[10]。总之,AP2 在执行有关蛋白分选和转运、维持正常神经元的功能等过程中起到非常关键的载体作用。松材线虫作为一种入侵物种是目前松林疫病防控的重点,以编码松材线虫AP2−α 和AP2−μ 亚基的基因为对象,可以作为重要的分子靶标进行研究,为未来应用RNAi 进行松材线虫病的防控提供借鉴。
1 材料和方法
1.1 实验材料
本研究所用到的松材线虫,取自浙江省嵊泗县,并在实验室条件下传代培养。研究的供试真菌为尖孢镰刀菌甘蓝种(F.oxysporumf.sp.conglutinanswild-type Foc−A8),用于构建真菌表达载体为pDH−RH 和pKOV21。以上材料均获于北京师范大学。
1.2 RNA 提取及cDNA 第1 链的合成
为获得高质量的松材线虫RNA,本研究采用Trizol 结合RNA 提取试剂盒(NucleoSpin RNA II Kit,德国)的方法[15],为后续的靶基因片段的扩增以及实时荧光定量PCR(Q−PCR)做准备。RNA提取后,按照PrimeScriptTM II 1st strand cDNA Synthesis Kit(宝生物)说明进行cDNA 第1 链的合成。
1.3 目的片段的纯化及载体构建
根据松材线虫Bx−apa−2基因(Wormbase Parasite 数据库:BXY_1519000)和Bx−apm−2基因(Wormbase Parasite 数据库:BXY_1516200.1)分别设计引物扩增靶基因片段,用以构建dsRNA 表达载体。以PCH−sGFP 表达载体序列为参考设计引物扩增绿色荧光蛋白(GFP)基因片段,用以构建dsRNA 表达无关干扰载体。引物设计信息如表1 所示,以上一步合成的cDNA 为模板进行PCR 扩增。PCR体系为50 μL,包括:5×PrimeSTAR Buffer(Mg2+Plus)10 μL,dNTP Mixture(2.5 mmol/L each)4 μL,引物对10~15 pmol,cDNA 1 μL,PrimeSTAR HS DNA Polymerase (2.5 U/μL)0.5 μL。扩增条件为:94 °C 10 min,循环35 个(94 °C 30 s,退火温度15 s,72°C 30 s),72 °C 7 min。扩增后的片段采用琼脂糖凝胶回收试剂盒(APx−GX−50,爱思进)进行纯化,之后片段连入pJET1.2 载体(Rapid DNA ligation Kit,美国赛默飞),并经克隆测序后验证正确。

表1 用以载体构建、检测、Q−PCR 引物信息Table 1 Primers used in this study for vector construction,detection and Q−PCR
将目的片段连入pDH−RH 载体的过程,主要采用双酶切并经T4 DNA 连接酶的方法进行,同Wang 等所述[6]。为实现同一Foc−A8 菌株中转入不同靶基因片段,根据pKOV21 载体序列,设计一段引物扩增包括neo基因启动子和终止子在内的片段,并在引物两端引入KpnI 酶切位点。原载体pDH−RH 经KpnI 单酶切去除潮霉素抗性基因(hph),并经虾碱性磷酸酶(rSAP)处理后,与neo扩增片段相连,形成具有新霉素抗性的pDN−RH 载体。
1.4 农杆菌介导的尖孢镰刀菌转化及阳性真菌转化体的鉴定
构建好的连有目的片段的pDH−RH 和pDN−RH 质粒载体,通过电击转化AGL−1 农杆菌感受态,并介导尖孢镰刀菌转化过程,操作方法同Wang 等[6]。筛选出潜在含有目的片段的Foc−A8真菌转化体。待选真菌转化体采用CTAB 法提取基因组DNA,并使用PHD−up 引物对和PHD−down引物对同时检测上下游插入片段。PCR 鉴定完毕后,为了确定T−DNA 的随机插入及在基因组中的拷贝数,以目标片段作为探针,使用洋地黄毒苷标记和检测系统进行Southern 杂交(High Prime DNA Labeling and Detection Starter Kit I,罗氏)验证。
1.5 松材线虫饲喂法介导的RNAi及Q-PCR表达验证
将经过鉴定的Fox−A8 真菌转化体接种到PDA 平板上,待菌丝生长至边缘约1 cm 时,随机将100 条线虫接种到真菌垫上,分别经过20、30、40 d 的生长繁殖后,用无菌水将线虫清洗出来,进行验证。按1.2 中所述提取RNA 并反转录合成cDNA 后进行qPCR 验证。以松材线虫Bx−ef1a基因作为内参,通过2−ΔΔCT方法计算靶基因在经饲喂法介导的RNAi 处理后的相对表达量的差异。
1.6 松材线虫形态学参数的测定
经饲喂法介导的RNAi 干扰前后的松材线虫,使用TAF 固定液(每100 mL 含有:40%甲醛7 mL,三乙醇胺2 mL,蒸馏水91 mL)进行固定。固定好的线虫置于玻片上,立即于显微镜下进行观察和拍照。为了衡量线虫在经过RNAi 处理后的身体形态上的变化,本研究主要测量松材线虫成虫的体长和最大体宽等指标,并计算 a值:体长/最大体宽[16]。通常情况下,为描述一个松材线虫群体,雌雄至少各测量25 条,本研究为了结果的准确性,对不同处理组的松材线虫,随机取雌虫和雄虫成虫各30 条进行测量。
1.7 数据分析
采用SPSS 19.0 软件分析各组实验统计结果,以P0.05 为显著水平,以P0.01 为极显著水平。统计时,多组数据之间比较,在满足方差齐性的前提下,进行单因素方差分析(One−way ANOVA)进行检验,再进行Duncan 两两比较。若方差不齐,则采用Kruskal−Wallis 非参数检验,之后再进行Mann−Whitney U 两两比较。
2 结果与分析
2.1 载体构建
对构建好的载体及空载体分别用引物对PHD−A(A)和PHD−P(P)进行上游和下游PCR 验证(图1)。结果显示:Bx−apa−2基因上游检测片段p−apa2: A 长度为981 bp,下游检测片段长度p−apa2: P 为1 221 bp;Bx−apm−2基因上游检测片段p−apm2: A 长度为1 275 bp,下游检测片段长度p−apm2: P 为1 515 bp;GFP 基因上游检测片段p−GFP: A 长度为 934 bp,下游检测片段长度p−GFP: P 长度为 1 174 bp;对照空载体上游检测片段p−vector: A 长度为560 bp,下游检测片段长度p−vector: P 为800 bp。用于载体构建的扩增片段均经测序后验证正确。
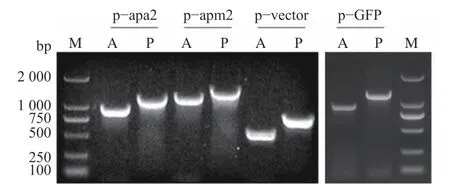
图1 载体构建上下游片段PCR 验证结果Fig.1 PCR results of anterior and posterior fragments for vectors' construction
2.2 真菌转化体转入验证及表达验证
通过农杆菌介导的尖孢镰刀菌转化过程,本研究获得了分别转入GFP、Bx−apa−2和Bx−apm−2基因上下游片段并具有潮霉素抗性真菌转化体以及同时转入Bx−apa−2和Bx−apm−2基因具有新霉素抗性的真菌转化体(图2)。对这些真菌转化体进行PCR 验证,结果显示在候选真菌转化体基因组中均有效转入了目标片段,(图3a)。进一步通过Southern blot 显示,候选真菌转化体是以随机单拷贝的方式插入到基因组中,在Bx−apm−2和Bx−apm−2基因片段同时转入的真菌转化体中显示出了两个靶标转入的情形(图3b)。为了验证这些插入片段能正常在真菌转化体中转录,通过反转录PCR(RT−PCR),使用d−apa−2、d−apm−2以及d−GFP 引物分别进行验证,结果显示转入片段能正常的转录(图3c)。
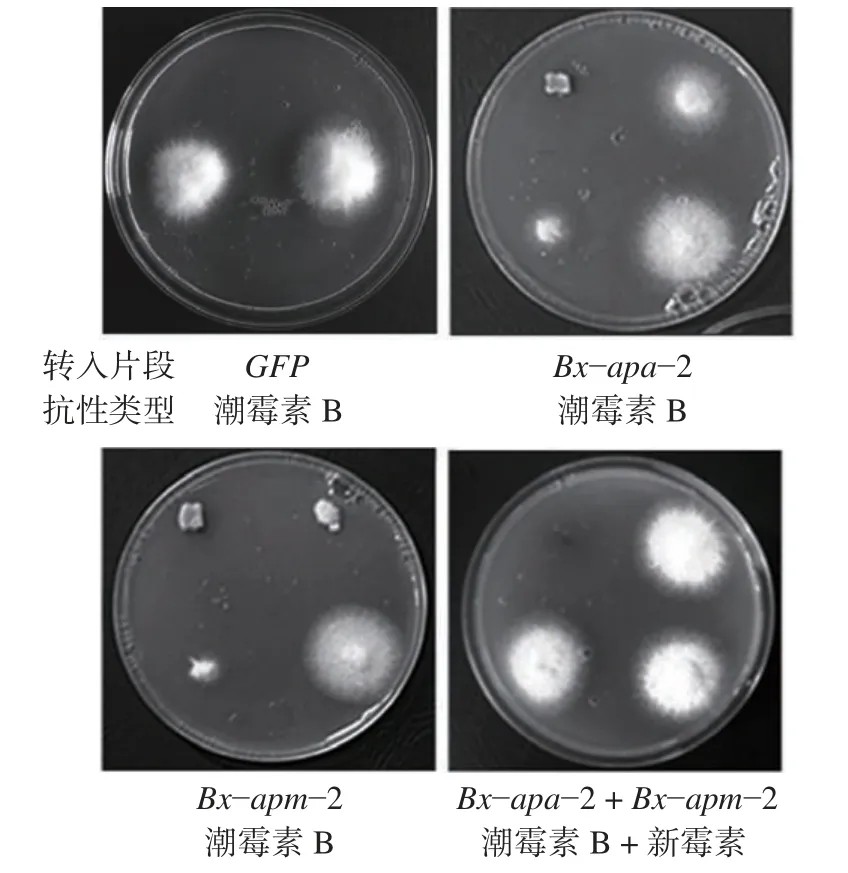
图2 转入不同目标片段的尖孢镰刀菌转化体Fig.2 F.oxysporum transformants with different target fragments
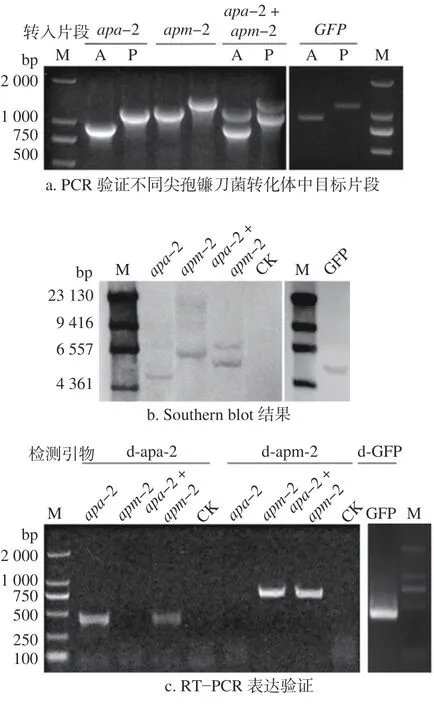
图3 尖孢镰刀菌转化体目标片段验证Fig.3 Validation of target fragments of F.oxysporum
2.3 松材线虫靶基因饲喂法介导的RNAi qPCR 结果
将松材线虫接种到相应的真菌转化体上进行饲喂法介导的RNAi,RT−qPCR 检测靶基因的相对表达变化。结果发现:当干扰30 d 时,Bx−apa−2基因(图4a)的表达量约为无关对照组dsGFP 表达量的51%(P0.05);而干扰Bx−apm−2基因(图4b)时,在20 d 时即表现出明显的靶基因水平降低(约正常值的65%,P0.05),此后,随干扰时间的增长,表达量继续降低。这表明,松材线虫Bx−apa−2基因和Bx−apm−2基因经过饲喂法介导的RNAi 后显著降低表达(P0.05)。通过饲喂线虫同时含有表达两个基因片段dsRNA的真菌,靶标基因Bx−apa−2基因和Bx−apm−2基因的表达量均显著性下降,分别下调了47%和80%(图4c)。
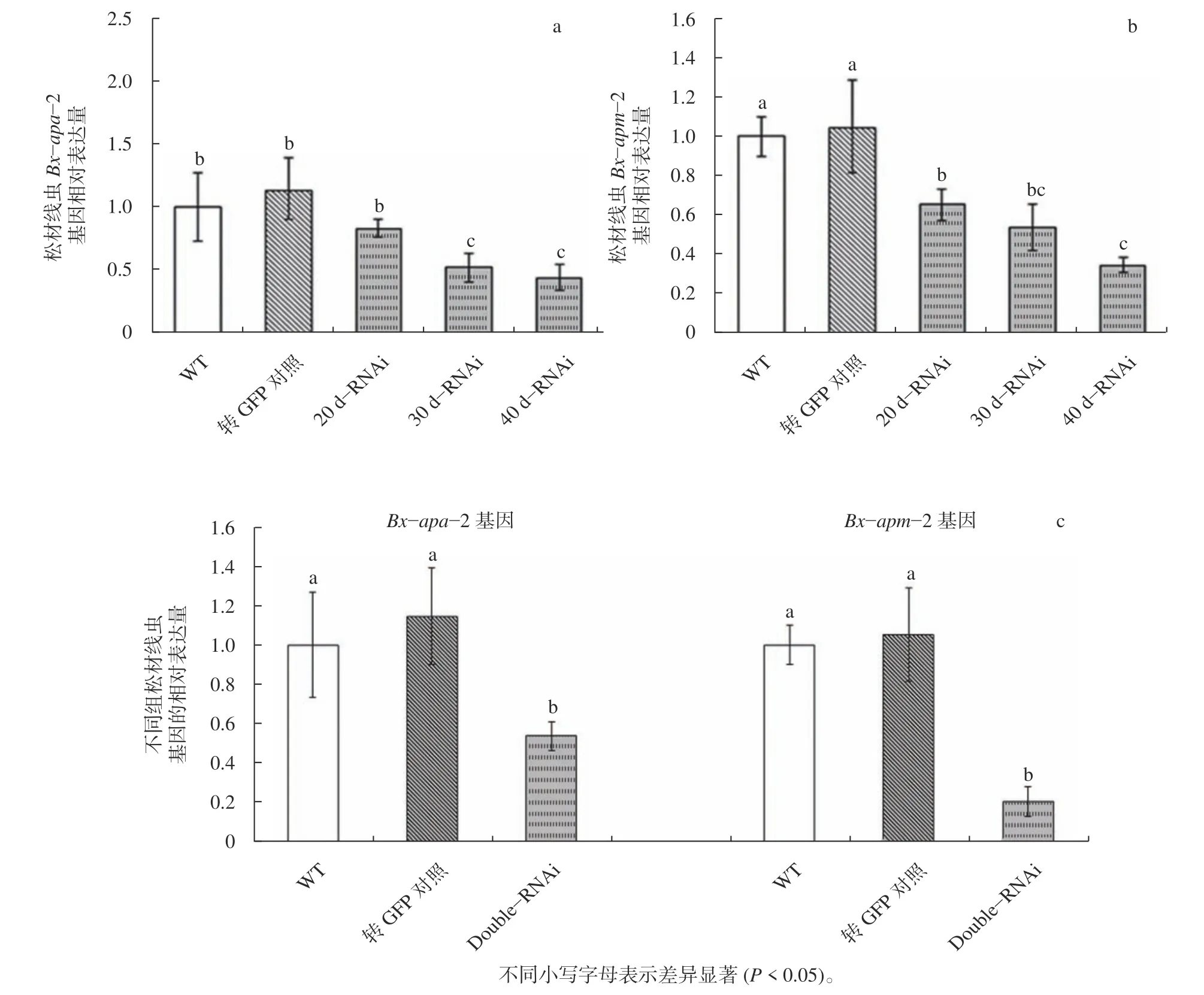
图4 松材线虫Bx-apa-2 和Bx-apm-2 基因饲喂法介导的RNAi 基因表达变化8722;2 基因饲喂法介导的RNAi 基因表达变化Fig.4 Relative expression changes of Bx−apa−2 and Bx−apm−2 genes after feeding mediated RNAi
2.4 松材线虫Bx−apa−2 基因和Bx−apm−2 基因RNAi 表型
松材线虫Bx−apa−2基因和Bx−apm−2基因RNAi 后,各组线虫的基本形态如图5 所示。通过体尺测量,比较非靶标对照线虫,体长和最大体宽均极显著减小(P0.01,图6a,b),较非靶标对照,干扰Bx−apa−2基因,线虫“a”值没有明显差异,干扰Bx−apm−2基因,雌性线虫“a”值与对照没有明显差异。说明分别饲喂法介导的RNAiBx−apa−2和Bx−apm−2基因,线虫主要是变得更细小,即“Small”表型;而在干扰Bx−apm−2基因的雄性个体以及同时干扰Bx−apa−2和Bx−apm−2基因的线虫内,其体长和体宽进一步缩短,“a”值极显著减小(P0.01),说明双干扰的线虫有明显的“Dumpy”短粗表型。
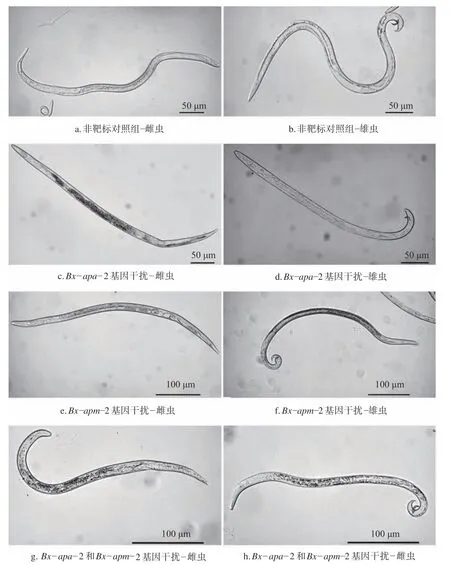
图5 松材线虫Bx−apa−2 和Bx−apm−2 基因 RNAi 表型Fig.5 Phenotypes of B.xylophilus after Bx−apa−2 and Bx−apm−2 RNAi
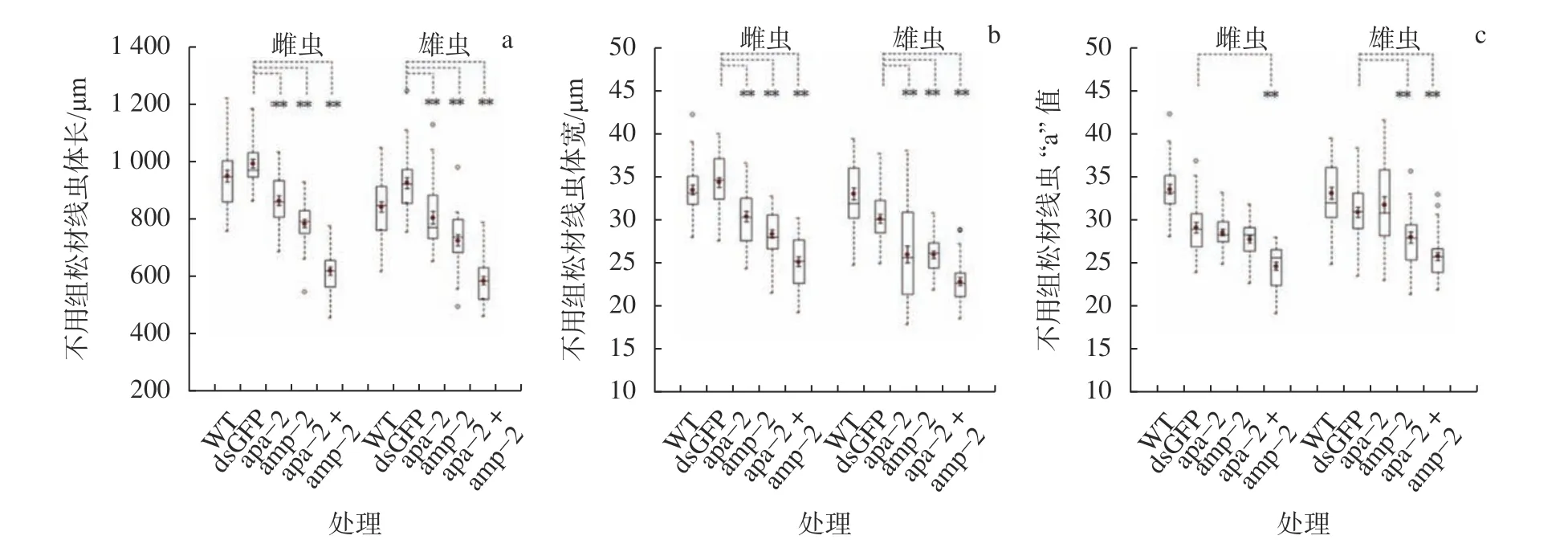
图6 松材线虫Bx−apa−2 和Bx−apm−2 基因 RNAi 主要的形态指标Fig.6 The main morphological parameters of B.xylophilus after Bx−apa−2 and Bx−apm−2 RNAi
3 结论与讨论
饲喂法介导的RNAi 作为一项技术应用,其核心是在宿主内表达寄主靶基因dsRNA,寄主通过取食或侵害宿主,从而产生影响寄主生物体相关基因的作用。这种RNAi 机制最早的发现是在模式生物C.elegans中[17]。利用这种机理,目前已经有研究报道在某些植物病虫害疫病防治上得到应用,如拟南芥(Arabidopsis thaliana)[18]、烟草(Nicotiana tabacum)[19]、番茄(Lycopersicon esculentum)[20]、马铃薯(Solanum tuberosum)[21]等。通过本研究,发现松材线虫通过取食转入表达松材线虫Bx−apa−2基因和Bx−apm−2基因靶基因dsRNA 的尖孢镰刀菌菌丝,在40 d 范围内可以引起比较明显的RNAi 效应。因此本研究进一步证明饲喂法介导的RNAi 技术在线虫等病虫害的寄主防御上,以及后基因组功能分析上均具有潜在的应用价值。
衔接蛋白是大分子物质进入细胞以及在细胞内运输过程中起关键作用的一类蛋白质,这类蛋白负责识别膜受体,指导货物分子参与囊泡的形成,同时网格蛋白轻链对网格蛋白被膜的柔韧性具有重要作用,AP2 通过调节网格蛋白被膜的刚度,促进了被膜囊形成过程中与货物分子的有效隔离[22]。研究指出,衔接蛋白作为网格蛋白的适配器,协调形成包被的囊泡,用于细胞器之间的物质运输。在这个过程中,AP1 与富含磷脂酰肌醇4−磷酸的膜结合,而AP2 与质膜的磷脂酰肌醇4,5−二磷酸结合。膜蛋白、货物蛋白和网格蛋白均能促进AP 蛋白的活化[23]。由此可见,AP2蛋白在物质转运、蛋白分选和运输过程中蛋白质间的相互作用这一相对复杂的调控过程中起到非常重要的作用。
在组成上,物种间AP 蛋白虽有不同,但差异不大[24]。AP2 蛋白相关亚基,在各物种中均由单基因编码,松材线虫的与之类似。在果蝇中,AP2−α 的功能缺失可导致成虫运动机能的减退[11]。C.elegans中,通过体外合成dsRNA 并针对AP2−α,AP2−μ 相关基因实施RNAi 时,线虫表现为短粗或突出囊泡的异常现象[14,25]。然而也有研究指出,AP2−μ 或许是对突出囊泡的形成可能不是关键的[26]。此外,研究发现完全突变的Ce−apa−2的线虫是可以存活的,而只有当AP2−α 和AP2−μ都同时突变,线虫才会产生严重的表型,这提示当AP2−α 缺失时,β−μ 半复合体是可以继续发挥AP2 蛋白的部分功能[10]。本研究中干扰AP2−α 编码基因Bx−apa−2仅会造成松材线虫变小,干扰AP2−μ 编码基因Bx−apm−2基因会造成雄性个体较为明显的“dumpy”现象;而当两个基因同时干扰时,短粗表型更加明显,这些发现与C.elegans的部分研究结果是类似的,证明AP2 蛋白单亚基的缺损可对线虫造成不利的影响;而双亚基的缺失对其功能的损害是巨大的,会加剧这种不利的影响。在哺乳动物中的研究也发现,当AP−2缺失时,会造成小鼠在胚胎发育早期神经发育的异常[27]。本研究中侧重观察了松材线虫的外形表现,因此这一部分的内容值得进一步探索。
松材线虫是一种极具破坏性的危险外来入侵生物,而开发环境友好型的松材线虫防治方式是目前较热的研究内容之一,饲喂法介导的RNAi提供了这种可能性。随着技术的不断进步,逐渐使用新方法对这种方法进行技术革新,可为未来进行线虫的基因功能分析,及广泛应用于松材线虫病害防治等方面提供参考依据。

