孕酮对绵羊瘤胃体外发酵和瘤胃微生物区系的影响
郭业静,裴彩霞,夏呈强,赵 燕,刘 强
(山西农业大学 动物科学学院,山西 太谷 030801)
母羊妊娠前后的生理变化与孕酮密切相关,研究孕酮对瘤胃发酵和微生物区系的影响,对调控母羊瘤胃微生物代谢及提高饲料消化率具有重要意义。有研究发现,妊娠会加快反刍动物瘤胃液和胃肠道饲料的通过率[1-4]。与非妊娠母羊相比,妊娠母羊瘤胃颗粒物的滞留时间和胃肠道平均滞留时间减少[5],营养物质采食量逐渐升高。妊娠除影响动物代谢活动和营养需求外,还对动物肠道微生物菌群具有影响[6-7]。母体从妊娠早期到后期肠道中微生物菌群多样性提高[6,8]。有研究发现,孕妇肠道中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)[6]和双歧杆菌属(Bifidobacterium)[7]丰度增加。奶牛产前和产后瘤胃中的普雷沃氏菌属(Prevotella),瘤胃球菌科(unclassified Ruminococcaceae)未分类菌属和琥珀酸弧菌科(unclassified Succinivibrionaceae)未分类菌属相对丰度不同[9],瘤胃中微生物组成受妊娠影响,然而孕酮对瘤胃微生物的影响尚未见报道。
近年来,已证实宿主激素会影响细菌的基因表达[10],而这反过来又会对宿主产生影响。有研究发现[11-12],性腺类固醇可抑制革兰氏阳性菌的生长,孕酮作为调节和维持妊娠的重要激素[13],可促进女性和小鼠肠道双歧杆菌属(Bifidobacterium)的生长[7]。此外,还有研究发现,母羊妊娠后血清中孕酮浓度显著升高[14],并可通过唾液和瘤胃壁进入瘤胃[15],而瘤胃和瘤胃中的微生物在营养物质消化吸收过程中又发挥着关键作用,所以推测孕酮可能通过调控瘤胃微生物从而影响动物饲料分解。但到目前为止,孕酮对反刍动物瘤胃内代谢活动的影响尚不清楚。
本试验通过体外培养法,研究孕酮对绵羊瘤胃微生物发酵以及瘤胃微生物区系的影响,旨在为调控绵羊瘤胃微生物代谢提供新的思路。
1 材料和方法
1.1 材料
1.1.1 试验动物 选取3 只体况良好,非妊娠期的杜寒杂交经产母羊(3~4 岁,体质量为(50.00±1.28)kg),单栏饲喂,饲喂全混合日粮(TMR)(表1),每天于7:00 和19:00 喂食2 次,自由饮水。
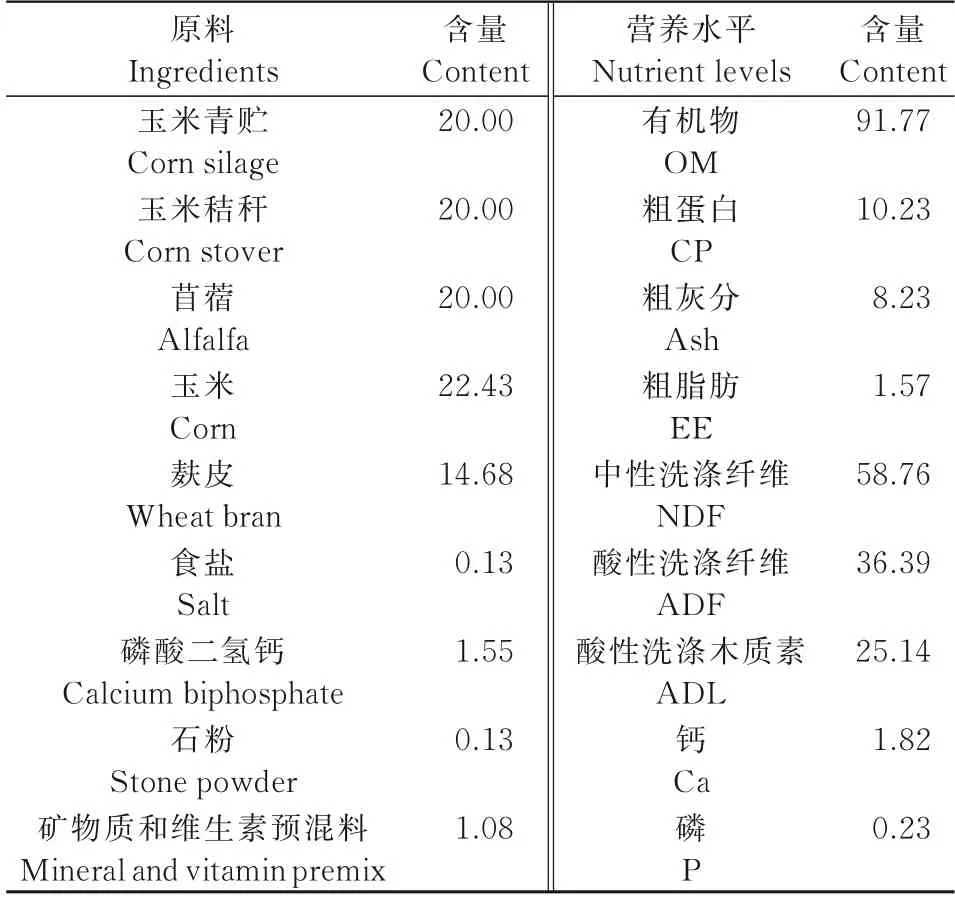
表1 试验日粮组成及营养水平Tab.1 Composition and nutrient levels of the experimental diets %
1.1.2 发酵底物 TMR 风干后,粉碎过2 mm 筛,作为发酵底物。
1.2 方法
1.2.1 试验设计 将5 mg 孕酮(Sigma,美国)溶解于100 mL 丙酮(分析纯)中制备成原溶液。试验设4 个处理,孕酮终质量浓度分别为0 ng/mL(CK)、1 ng/mL(PL,低浓度组)、8 ng/mL(PM,中浓度组)和22 ng/mL(PH,高浓度组),每个处理5 次重复,培养48 h 后终止发酵。
1.2.2 瘤胃液采集及体外发酵 瘤胃液按照MENKE 等[16]的方法进行体外培养。晨饲前2 h 使用胃管采集3 只未妊娠母羊的瘤胃液,混匀过滤后装入充满CO2的保温瓶(39 ℃),迅速带回实验室。每个发酵管中使用300 mg 风干的TMR 和30 mL培养液(10 mL 瘤胃液和20 mL 缓冲液)并加入不同水平的孕酮,置于39 ℃恒温水浴振荡器中发酵培养。
1.2.3 样品采集 根据BLÜMMEL 等[17]的方法,在培养3、6、9、12、20、28、36、48 h 时记录气体体积。培养结束后,取2 mL 上清液于-80 ℃贮存,进行瘤胃微生物菌群测定。剩余上清液用定量滤纸分离后,立即用pH 计(EC-pH510 标准智能型台式pH计,上海)测定pH 值,于-80 ℃贮存,以测定瘤胃液挥发性脂肪酸和氨态氮(NH3-N)的含量。
1.3 测定指标及方法
1.3.1 体外发酵参数 挥发性脂肪酸采用TRACE-1300 气相色谱仪(Thermo Fisher Scientific,美国)测定;采用紫外分光光度计(UV2100,上海)测定瘤胃液中NH3-N 浓度;采用动态发酵参数模型计算产气参数[18];根据MENKE 等[19]的方法估算饲料代谢能(ME)和发酵24 h 后有机物消化率(OMD)。

其中,d为饲料粗蛋白含量(g/kg),f为饲料粗脂肪含量(g/kg),h为饲料粗灰分含量(g/kg)。
1.3.2 瘤胃培养液DNA 提取和16S rRNA 基因测序 取等量的同一孕酮质量浓度样品上清液混合为一个样品,通过珠磨法从上清液混合物中提取微生物DNA[20]。并对16S rRNA 基因的V3-V4 可变区进行PCR 扩增[21]。
PCR 扩增产物在Illumina MiSeq 平台(华大基因,深圳)上测序。序列进行质控和过滤后,将得到的平均优质序列使用USEARCH(Version 7.0.1090)按照相似度大于0.97 将序列聚类为操作分类单元。Alpha(ACE、Chao1、Simpson 和Shannon 指 数)和Beta 多样性(主坐标分析)通过Microbiome Analyst(https://www.microbiomeanalyst.ca/MicrobiomeA nalyst/upload/OtuUploadView.xhtml)进行估算。采 用LEfSe(http://huttenhower.sph.harvard.edu/galaxy/)分析CK 与孕酮添加组之间的菌群差异。
1.4 统计分析
数据采用Excel 2010 进行初步整理;使用SPSS 21.0 中一般线性模型进行差异性分析,采用LSD 和Duncan 氏法进行多重比较(P<0.01 表示差异极显著,P<0.05 表示差异显著)。
2 结果与分析
2.1 孕酮对瘤胃发酵参数的影响
孕酮对瘤胃发酵参数的影响如表2 所示。
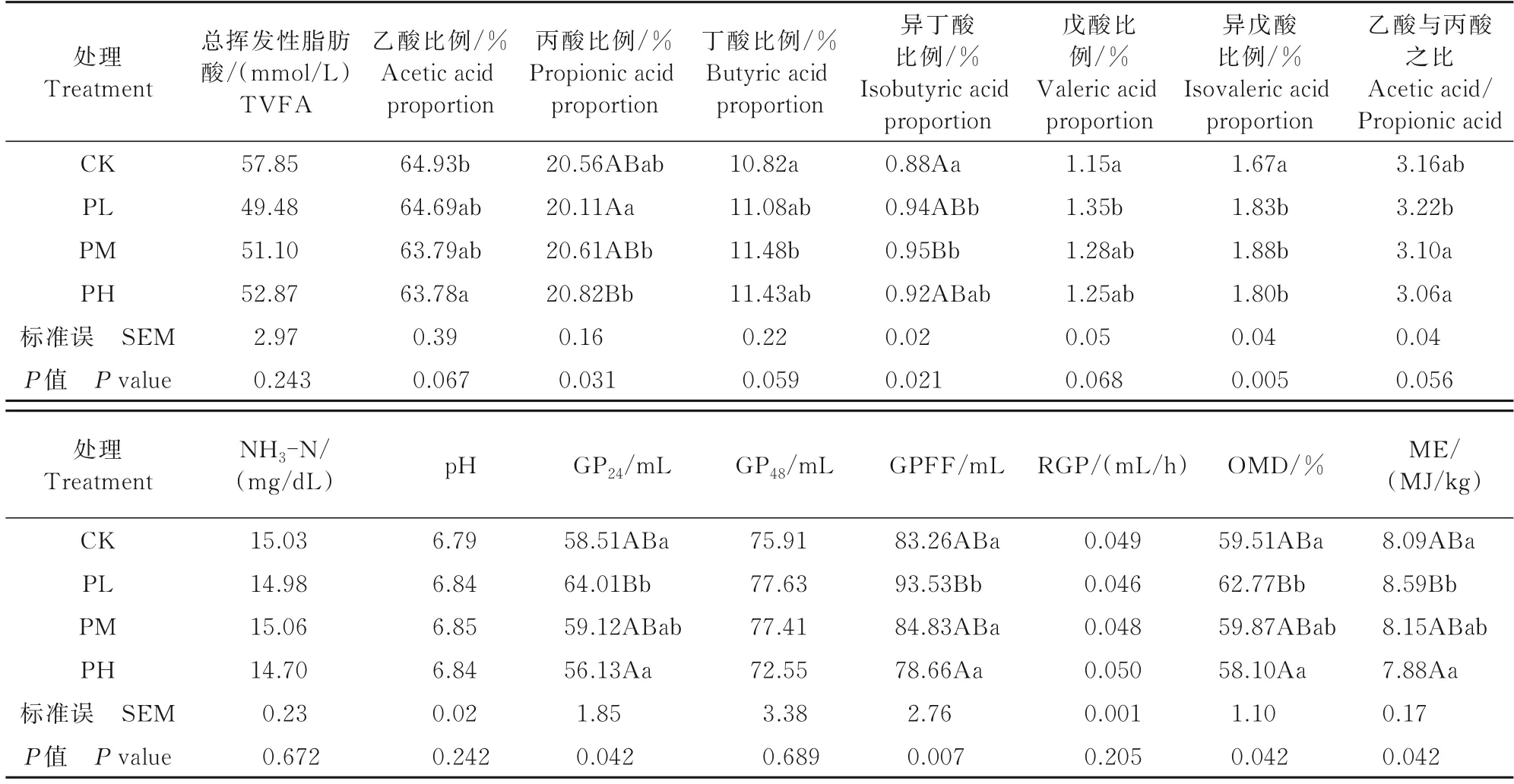
表2 孕酮对瘤胃发酵参数的影响Tab.2 Effect of progesterone on rumen fermentation parameters
由表2 可知,CK、PL 组、PM 组和PH 组之间总挥发性脂肪酸浓度无差异;与CK 相比,PH 组乙酸比例显著降低1.77%(P<0.05),PM 组丁酸比例显著升高6.10%(P<0.05),异丁酸比例极显著升高7.95%(P<0.01),PL 组、PM 组和PH 组异戊酸比例均显著升高(P<0.05);PL 组丙酸比例显著低于PM 组(P<0.05),极显著低于PH 组(P<0.01)。PL 组的乙酸与丙酸之比显著高于PM 组和PH 组(P<0.05);PL 组 的GP24、OMD 和ME显著高于CK(P<0.05),极显著高于PH 组(P<0.01);PL 组的GPFF 最高,显著高于CK 和PM 组(P<0.05),极显著高于PH 组(P<0.01)。CK 和孕酮添加组之间NH3-N 浓度、pH、GP48和RGP 无显著差异。
2.2 孕酮对瘤胃微生物区系Alpha 多样性的影响
由表3 可知,ACE 指数和Chaol 指数在CK、PL组、PM 组和PH 组之间差异不显著;PH 组Shannon指数和Simpson指数极显著低于其他3组(P<0.01)。以上结果表明,孕酮对细菌群落的丰富度无显著影响,但高浓度的孕酮可降低微生物菌群多样性。
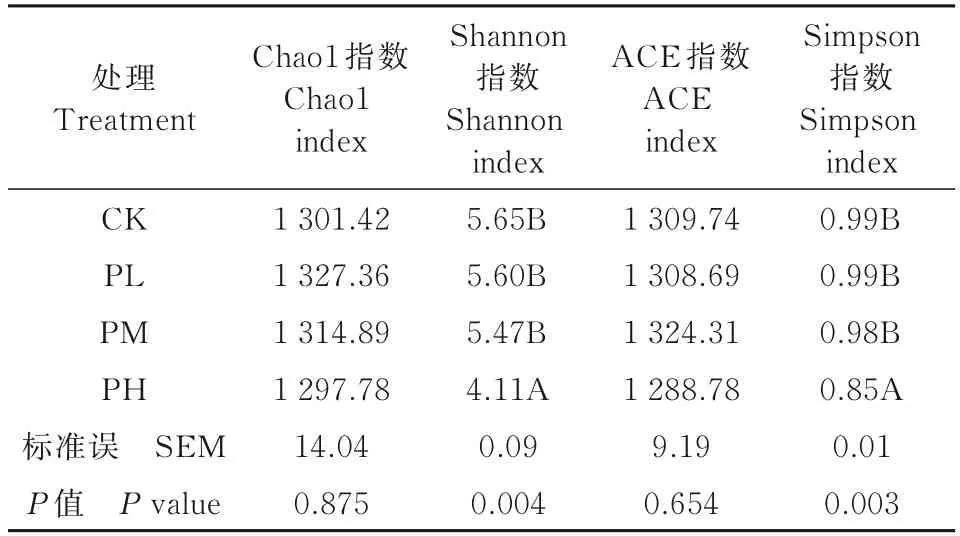
表3 孕酮对瘤胃微生物菌群Alpha 多样性的影响Tab.3 Effect of progesterone on Alpha diversity of rumen microflora
2.3 孕酮对瘤胃微生物区系Beta 多样性的影响
孕酮对瘤胃微生物菌群Beta 多样性的影响如图1 所示。

图1 孕酮对瘤胃微生物菌群Beta 多样性的影响Fig.1 Effect of progesterone on Beta diversity of rumen microflora
通过非加权Unifrac 距离主坐标分析图可知(图1),第1 主成分(贡献率为55.6%)中PM 组与CK 和PL 组微生物菌群多样性的差异较大,而PH组和其他3 组组间分布距离较远,说明PH 组和其他3 组组间的微生物菌群多样性差异显著(P<0.05)。
2.4 瘤胃微生物菌群LEfse 分析结果
由图2可知,与CK 相比,孕酮添加组β-变形菌纲(Betaproteobacteria)、Elusimicrobia菌纲、伯克氏菌目(Burkholderiales)、丛毛单胞菌科(Comamonadaceae),Elusimicrobiaceae菌科、黏胶球形菌门(Lentisphaerae)、丛毛单胞菌属(Comamonas)和Elusimicrobium菌属的相对丰度显著升高(P<0.05);孕酮添加组显著降低了动性球菌科(Planococcaceae)、拟杆菌科(Bacteroidaceae)、琥珀酸弧菌科(Succinivibrionaceae)和互养菌科(Synergistaceae)的相对丰度。此外,孕酮添加组中假丁酸弧菌属(Pseudobutyrivibrio)、反刍杆菌属(Ruminobacter)、Streptococcus minor、Shuttleworthia菌属、假单胞菌属(Pseudomonas)和乳杆菌属(Lactobacillus)的相对丰度也显著降低(P<0.05)。

图2 CK 和孕酮添加组瘤胃微生物菌群LEfSe 分析Fig.2 LEfSe analysis of rumen microflora in CK and progesterone addition groups
3 结论与讨论
瘤胃作为反刍动物极其重要的消化器官,其消化代谢能力和微生物区系变化受动物生理状态的影响。孕酮是维持妊娠的关键激素[13],其浓度在瘤胃中呈昼夜变化规律[22],瘤胃中孕酮直接或间接地参与了瘤胃发酵与微生物区系的调控。
挥发性脂肪酸是瘤胃微生物发酵饲料底物中碳水化合物产生的重要代谢产物,可以评价瘤胃微生物对营养物质的利用程度[23]。本试验中,孕酮质量浓度从0 ng/mL 增加到22 ng/mL 时,乙酸比例呈现下降趋势,丙酸比例先降低后升高,乙酸丙酸之比先升高后降低。同时,本研究还发现,孕酮添加组中的琥珀酸弧菌科(Succinivibrionaceae)[24](属于变形菌门(Proteobacteria))、乳杆菌属(Lactobacillus)[25]、假丁酸弧菌属(Pseudobutyrivibrio)[26]、Shuttleworthia菌属[27](属于厚壁菌门(Firmicutes))和反刍杆菌属(Ruminobacter)[28](属于变形菌门(Proteobacteria))相对丰度降低,而这些细菌只产乙酸,不产丙酸。推测孕酮可能通过抑制这些细菌的代谢增殖,进而抑制了乙酸的生成。前人研究发现,孕酮可以提高瘤胃中总挥发性脂肪酸的含量[22,29],而本试验却发现,孕酮对瘤胃总挥发性脂肪酸浓度无影响,这可能是由于发酵时间、发酵底物或瘤胃液供体动物不同,其还有待进一步研究。
瘤胃液pH 是反映瘤胃内环境与发酵水平的一项综合指标[30]。本试验发现,添加孕酮对瘤胃pH无影响,这与任清长[22]的研究结果一致。但由于发酵液中缓冲液占比较大,本试验中各组pH 值均在正常范围(5.5~7.5),可保证微生物的正常生长和繁殖。瘤胃氨态氮浓度受瘤胃对蛋白质降解程度及微生物对氨态氮利用情况的影响[31]。本试验发现,添加孕酮对瘤胃氨态氮浓度无影响。但是,陈杰[29]通过人工瘤胃试验发现,孕酮可提高瘤胃微生物的代谢活性并促进氨态氮的释放。本试验各组之间氨态氮浓度变化不大的原因,可能是由于发酵底物的成分和比例相同。
本研究发现,孕酮质量浓度可调控瘤胃微生物区系的变化;随着孕酮质量浓度的升高,细菌多样性呈依次递减的趋势,瘤胃菌群的结构差异也随之增大。然而,孕酮质量浓度对物种的丰富度无影响。NURIEL-OHAYON 等[7]将孕酮 或PBS 加 入雌性小鼠的粪浆中,通过未加权UniFrac 测定发现,孕酮处理组微生物组成多样性明显降低,与本试验结果一致。YOTIS 等[12]在体外检测了孕酮对革兰氏阳性菌活性的影响,结果发现,孕酮对革兰氏阴性菌的抑制作用很小。众所周知,瘤胃中存在革兰氏阴性菌和革兰氏阳性菌,孕酮可能参与了对瘤胃中革兰氏阳性菌的抑制作用。NURIELOHAYON 等[7]研究也发现,孕酮处理期间,粪球菌属(Coprococcus)、粪杆菌属(Faecalibacterium)、拟杆菌属(Bacteroides)、瘤胃球菌属(Ruminococcus)、韦荣氏球菌属(Veillonella)、萨特氏菌属(Sutterella)和乳杆菌属(Lactobacillus)相对丰度增加,本试验结果与其不一致,可能是由于所处理的样品或孕酮添加量不同。
一定时间内的产气量反映了底物被瘤胃微生物利用的程度。黄雅莉等[32]研究报道,产气量与饲料中有机物的降解程度呈正相关,并且可消化的有机物含量和代谢能与24 h 累积产气量成正比。任清长[22]研究发现,在高淀粉日粮条件下,培养液孕酮质量浓度为2 ng/mL 时,发酵72 h 后产气量高于对照组。本试验中,随着孕酮质量浓度升高,潜在最大产气量、发酵24 h 产气量、有机物消化率以及饲料代谢能均呈现先升高后降低的趋势,且在孕酮质量浓度为1 ng/mL 时最高,说明此质量浓度下饲料底物能被微生物很好地利用,但在质量浓度为22 ng/mL 时最低,可能是由于高质量浓度孕酮抑制了瘤胃微生物活性,从而导致产气量、有机物降解率下降。本试验孕酮影响瘤胃微生物代谢的作用机制还需进一步验证。
综上所述,孕酮质量浓度会影响瘤胃发酵和瘤胃微生物菌群,且孕酮质量浓度为22 ng/mL 时瘤胃菌群多样性降低。

