梵净山东北部同域黔金丝猴与藏酋猴的时空分布格局*
王 丞 李海波 杨朝辉 毕 兴 樊 涵 粟海军 胡灿实 张明明
(1.贵州大学林学院 贵州大学生物多样性与自然保护研究中心 贵阳 550025; 2.贵州梵净山国家级自然保护区管理局 江口 554400; 3.贵州麻阳河国家级自然保护区管理局 沿河 565300; 4.贵州省兴义市林业局 兴义 562400; 5. 湖南张家界大鲵国家级自然保护区事务中心 张家界 427400)
明晰野生动物分布特点及影响因素一直是动物空间生态学研究的重点内容, 这是因为物种往往不是随机分布的, 而是选择性地栖息在利于其生存繁衍的适生区, 通常与气候、地形、食物资源以及生物有机体的竞争、捕食等环境条件息息相关(Rosenzweig, 1981; 孙儒泳等, 2019)。由于物种对各类环境的喜爱度或耐受度不同, 环境因子的时空分布差异也就制约着物种分布(Ofstadetal., 2019; Kinapetal., 2021)。作为动物行为学研究的重要内容, 日活动节律是了解野生动物的空间分布与环境关系的基础, 可深入了解野生动物的生存策略(Clutton-Brock, 1977)。因此, 生态环境条件变化对野生动物行为的影响, 以及它们如何在适宜栖息地内合理安排活动时间, 并将能量收支成本最优化, 对其生存维持具有重要意义。
当2个或多个同域生存物种在时空上使用相同资源时, 必然产生种间资源争夺(Hardin, 1960), 使劣势物种可获得资源变少, 甚于可能在特定分布区内被优势物种排除(Wiszetal., 2013; Sanzoetal., 2014)。Schoener(1974; 1986)认为空间、时间或取食等机制差异可促使生态位分化和细分资源利用, 让各物种占有独特的环境资源, 以减少或避免直接竞争, 保障种群正常活动的同时也有效维护了种间关系。这既是维持生物多样性和群落结构稳定的基础, 又是反向制约当地生态系统中各物种消长平衡的关键(Chesson, 2000)。Schreier等(2009)比较了全球同域灵长类的生态位分化, 发现其竞争共存方式主要是通过大环境下的栖息地选择差异、食性分化以及共占栖息地的垂直空间、微环境资源或活动时间的选择差异来实现。其中, 同域灵长类的栖息地选择和食性分化是生态位分离、避免竞争、稳定共存的最常见行为。同时, 生态选择机制的不同也反映了物种的生理生态需求差异(Grueteretal., 2010; Zhouetal., 2018)。
黔金丝猴(Rhinopithecusbrelichi)仅分布于梵净山保护区内, 种群数量约700余只(杨业勤等, 2002)。受当地旅游活动影响, 主要栖息于海拔1 500~1 900 m的常绿落叶阔叶混交林内(Xiangetal., 2009; Guoetal., 2018)。广泛分布于中国中部到南部的藏酋猴(Macacathibetana)(蒋学龙等, 1996), 环境适应能力较强, 适应于多种森林生态系统, 从温带山地森林到亚热带湿润常绿森林都有活动(熊成培, 1984; Zhaoetal., 1989), 在梵净山东北部主要栖息于海拔800~1 900 m的常绿阔叶林和常绿落叶阔叶混林交林内(杨炯蠡, 1994)。过去, 黔金丝猴的栖息面积较广, 于梵净山的东北部至西南部均见活动(杨业勤等, 2002), 随着当地旅游开发建设, 大量游客涉足, 对生性机敏、害羞的黔金丝猴造成了极大影响, 导致其原有的适宜栖息地破碎化, 压缩了活动空间(Guoetal., 2020)。因此, 明晰二者的时空分布关系非常重要, 是进一步研究资源分配和竞争模式的必要前提(Rosenzweig, 1981), 对它们的持续生存和保护管理具有重要意义。
在考虑到不影响和损害灵长类及其他野生动物种群正常活动的情况下, 本研究用红外相机技术开展了长时间、全天候、多生境的同步定点监测(O’Connelletal., 2010), 研究了梵净山东北部同域分布的黔金丝猴和藏酋猴的时空共存机制, 以期揭示二者在梵净山保护区的时空分布格局, 将有助于了解这2种灵长类活动与环境的关系, 并提高对二者种间关系的认识。

图1 梵净山国家级自然保护区红外相机布设方案Fig. 1 The infrared camera locations in Fanjingshan National Nature Reserve表示红外相机布设于2017年; 表示红外相机布设于2020年。 indicates that the camera was deployed in 2017; indicates that the camera was deployed in 2020.
1 研究地区概况
梵净山国家级自然保护区(以下简称“梵净山保护区”)位于贵州省东北部, 是武陵山脉的主峰, 地处云贵高原向湘西丘陵过渡的斜坡地带, 地理位置为27°49′50″—28°1′30″N, 108°45′55″—108°48′30″E, 总面积419.00 km2(图1)。作为长江上游森林生态区生物多样性保护优先区中具有最高保护优先性的区域之一, 保护区内自然植被保存较为完好, 动植物资源极其丰富, 为多种珍稀濒危动植物提供了优良栖息环境, 是黔金丝猴野外种群的唯一栖息地(吴波等, 2006)。
梵净山保护区属中亚热带季风湿润气候, 温暖湿润, 雨热同期, 形成了中亚热带湿润区山地森林生态系统, 年均气温变化在-1~21 ℃, 年降水量约1 300 mm(周政贤, 1990)。保护区地貌复杂, 山高谷深,高峻陡险,相对高差达2 000 m, 海拔范围500~2 570 m。主要植被类型有: 1)低山次生的落叶阔叶林和针阔混交林, 受人为干扰较重, 有明显次生特点, 主要分布于海拔1 300 m以下, 多是在原有地带性植被消失后出现次生植物群落, 主要群落类型包括枫杨(Pterocaryastenoptera)林、赤杨叶(Alniphyllumfortunei)林和枫香(Liquidambarformosana)林等, 甚至存在一小部分人工针叶纯林, 主要群落类型有杉木(Cunninghamialanceolata)林、马尾松(Pinusmassoniana)林等; 2)常绿阔叶林, 为该地区典型的原生植被群落, 主要分布于海拔1 400 m以下, 群落类型有栲树(Castanopsisfargesii)林、米槠(Castanopsiscarlesii)林等; 3)中山常绿落叶阔叶混交林, 主要分布于海拔1 300~1 900 m, 群落类型有光叶水青冈(Faguslucida)林、贵州青冈(Cyclobalanopsisargyrotricha)林等; 4)高山矮林灌丛和针叶林, 主要分布于海拔1 800 m以上, 主要群落类型包括高山柏(Sabinasquamata)灌丛、大花黄杨(Buxushenryi)灌丛、铁杉(Tsugachinensis)林、黄山松(Pinustaiwanensis)林等(周政贤, 1990; 杨海龙等, 2010)。
2 研究方法
2.1 红外相机布设方案
基于梵净山保护区的矢量边界 进行1 km2的网格化, 红外相机密度为1台· km-2。根据梵净山保护区黔金丝猴与藏酋猴的历史分布研究, 主要选择在黔金丝猴的主要分布区及与藏酋猴同域的梵净山东北部布设相机(图1)。在红外相机实际布设中, 监测点选取综合考虑了覆盖主要生境和海拔、通行可达性等因素, 具体布设于有野生动物活动痕迹的林间开阔地。2017年预先布设41台, 2020年增加25台, 共计布设红外相机66台, 整个期间连续监测。
红外相机(猎科LTL-6210 MC、东方红鹰E1B)设置为拍照模式、连拍3张、时间间隔10 s、中灵敏度, 固定于离地高0.5~2.0 m的树干, 镜头尽量与地面平行, 避开阳光直射。同时, 记录相机的GPS位点、海拔、林型以及水源距离等基本生境信息。
2.2 数据处理
首先, 挑出所有可识别黔金丝猴与藏酋猴的照片, 将在30 min内拍摄到单种灵长类的所有照片定义为1次独立有效照片, 并记为1次有效日活动时间(O’Brienetal., 2003)。由于红外相机监测时间跨度大、监测时长不均一, 且未严格按照灵长类家庭群体的家域进行相机布设。因此, 在评估二者的种群空间分布和重叠情况时, 未考虑不同家庭群的相互竞争与结构组成, 以分布于研究区域内的生存种群作为评估单元。同时, 考虑到时间跨度影响, 使用相对丰富度指数(relative abundance index, RAI)作为种群分布的评估指标(李晟等, 2016)。其原理是以同一物种单位时间内所获有效照片数为基础, 即拍摄率, 计算方法为:
RAI =Ai/N× 1 000。
其中,Ai为红外相机所拍摄到的第i个动物物种的独立照片数,N为Ai位点的总相机日, 单台红外相机持续工作24 h定义为1个相机日。
对存在空间重叠的相机位点, 使用“空间相遇时间差”来评估二者在同一空间的相遇时间变化情况。“空间相遇时间差”被定义为, 在同一相机位点上乙物种(黔金丝猴)在某一时刻出现后, 在此时刻前后出现的甲物种(藏酋猴)与乙物种(黔金丝猴)的时间差值,即 甲物种出现时刻与乙物种出现时刻之差。空间相遇时间差为正值, 表示甲物种出现晚于乙物种, 反之负值表示甲物种出现早于乙物种。
在以上各项数值的统计分析中, 对非参数的2个独立样本的差异使用Mann-Whitney U检验进行比较; 对非参数的多个独立样本的差异采用Kruskal-Wallis H检验进行比较; 对连续变量使用线性回归进行相关性分析。差异显著水平为P= 0.05。
利用整个监测期间的数据评估日活动节律, 以获悉监测区域内黔金丝猴与藏酋猴的整体日活动水平及其季节性变化。日活动节律描述方法使用核密度估计(Kernel density estimation)(Ridoutetal., 2009), 方法是将1天视为1个24 h的圆循环, 每次有效活动时间作为连续时间循环中的随机样本, 描述一种灵长类在某个特定时间段内被发现的概率, 以时间为横轴, 以该时间点上物种被发现的概率为纵轴, 最终呈现该物种在某个特定时间点活动的概率曲面图。同时, 所构成的曲线下的面积积分值为1。
为比较2种灵长类的日活动节律差异, 采用重叠指数比较两者核密度曲线之间的相似程度, 以估计二者的日活动节律对称重叠程度(Δ), 其取值范围从0(无重叠)到1(完全重叠)(Ridoutetal., 2009)。同时, 利用Wald检验比较2个物种的日活动节律差异, 差异显著水平为P= 0.05。以上所有处理结果在R软件v4.0.2的“activity”和“overlap”包中进行。
3 结果与分析
3.1 空间分布
在近4年的红外相机连续监测中, 累计有效工作日43 028天, 共记录到灵长类照片7 613张, 独立有效照片1 417张, 其中藏酋猴1 049张、黔金丝猴368张。在66个监测相机位点中, 藏酋猴在65个位点被记录到, 分布占比达到98.48%, 可见藏酋猴在研究区域内普遍分布, 从监测位点的最低海拔700 m至最高海拔2 400 m的有林地均有活动; 黔金丝猴在49个位点被记录到, 分布占比达74.24%, 主要分布于研究区域中北部, 且不分布于索道附近(图2)。可见, 黔金丝猴的分布相对较窄, 完全重叠于藏酋猴的分布范围内, 且二者在中北部的多个位点空间交互明显。
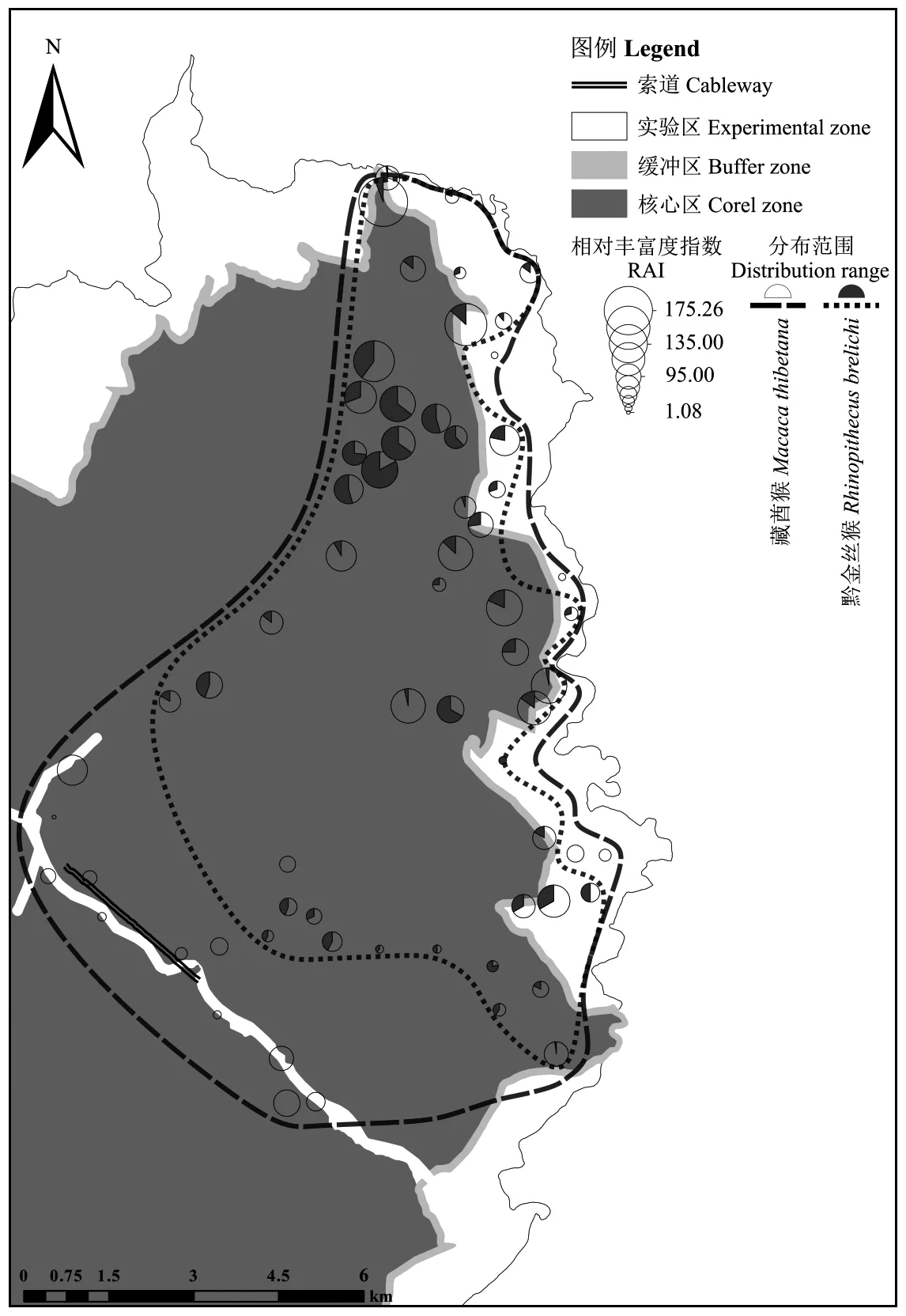
图2 梵净山黔金丝猴与藏酋猴的空间分布Fig. 2 Spatial distribution of Rhinopithecus brelichi and Macaca thibetana in Fanjingshan Reserve
藏酋猴分布的海拔差异不显著(Kruskal-Wallis test,χ2= 5.22, df = 4,P= 0.27), 其RAI与海拔不具线性关系(F= 0.51,P= 0.48), 表明其适应多段海拔; 黔金丝猴分布的海拔差异极显著(Kruskal-Wallis test,χ2= 17.78, df = 4,P= 0.001), 其RAI与海拔呈线性相关(F= 7.19,P= 0.009), 在1 600~1 900 m相对丰富度最高, 表明其更喜欢在该海拔范围栖息(图3A)。比较黔金丝猴与藏酋猴在不同海拔段的相对丰富度后发现, 在1 300 m以下(P< 0.01)和1 900 m以上(P< 0.01)的2个海拔范围呈极显著差异, 在1 300~1 900 m海拔范围未有显著差异。

图3 梵净山黔金丝猴与藏酋猴在不同海拔与植被类型的RAI值Fig. 3 RAI of R. brelichi and M. thibetana at different altitudes and vegetation types in Fanjingshan ReserveSF:低山次生林;EF:常绿阔叶林;EBF:常绿落叶阔叶混交林;AS:高山矮林灌丛。SF: Secondary forest; EF: Broad-leaved evergreen forests; EBF: Evergreen and deciduous broad-leaved forests; AS: Alpine shrub.
藏酋猴分布的植被类型差异不显著(Kruskal-Wallis test,χ2= 3.63, df = 3,P= 0.30), 说明其适应多种森林植被类型; 黔金丝猴分布的植被类型差异极显著(Kruskal-Wallis test,χ2= 12.65, df = 3,P= 0.005), 说明其更喜欢出现于中山常绿落叶阔叶林, 较少出现于其余3种森林植被类型(图3B)。比较黔金丝猴与藏酋猴在不同植被类型中的相对丰富度后发现, 在常绿阔叶林(P< 0.01)和高山矮林灌丛中(P= 0.01), 二者分布呈显著差异; 在低山次生林(P= 0.19)和中山常绿阔叶林中(P= 0.09), 二者分布未有显著差异, 二者均较少出现于低山次生林。

图4 梵净山黔金丝猴与藏酋猴在同一位点的相遇时间差Fig. 4 Encounter time difference betweenR. brelichi and M. thibetana at the same camera site in Fanjingshan Reserve
3.2 同一空间的相遇时间
统计黔金丝猴与藏酋猴的共现位点后发现, 二者15天内相遇的位点有45个, 占总监测位点数的68.18%, 占黔金丝猴分布总位点数的91.84%, 表明二者的栖息空间重叠度极高。对同一栖息地的利用时间差表现为, 于黔金丝猴出现的前后, 藏酋猴出现在同一位点的时间不存在显著差异(P= 0.48), 平均5~6天会出现在同一位点, 表明二者对同一栖息地的利用有一定的时间分布规律(图4)。四季变化对黔金丝猴与藏酋猴在同一栖息地的相遇时间无显著影响(Kruskal-Wallis test,χ2= 3.31, df = 3,P= 0.35), 平均相遇时间的变化范围为5天(冬季)至7天(春季)(图5)。

图5 梵净山黔金丝猴与藏酋猴在不同季节的相遇时间差Fig. 5 Encounter time difference betweenR. brelichi and M. thibetana in different seasons in Fanjingshan Reserve
3.3 日活动节律
黔金丝猴与藏酋猴为完全昼行性物种, 但二者明显拥有不同的日活动节律, 全年数据分析结果呈现极显著差异(P< 0.01), 重叠度为0.76(图6)。黔金丝猴呈现晨昏型的日活动节律, 呈双峰型, 一天中活动时间跨度约13 h, 活动高峰期在晨间7: 00—10: 00和黄昏16: 00—18: 00时段, 日中活动强度较低, 活动强度最低时段在13: 00—15: 00; 藏酋猴日活动节律呈单峰型, 一天中活动时间跨度约14 h, 日出后活动逐渐增强, 高峰在9: 00—12: 00, 午后逐渐减弱。
比较黔金丝猴与藏酋猴在不同季节的日活动节律后发现, 二者均呈现季节性变化, 重叠程度不同[冬季(0.64)<春季(0.68)<夏季(0.75)<秋季(0.82)],二者的季节性日活动节律均呈极显著差异(P< 0.01)。春季, 二者均呈现双峰型, 其中黔金丝猴的2个活动高峰最明显, 与藏酋猴的活动高峰时段形成错峰现象(图7A)。夏季, 黔金丝猴呈多峰型, 藏酋猴的呈单峰型(图7B), 其中黔金丝猴增加了午间前后的活动强度, 使日活动时间分配更均匀; 藏酋猴从日出后活动强度逐渐增加, 于10: 00—12: 00出现活动高峰, 之后活动强度逐渐下降直至天黑。秋季, 黔金丝猴呈双峰型, 藏酋猴呈单峰型(图7C)。冬季与春季相似, 二者形成错峰现象(图7D), 其中, 黔金丝猴2个活动高峰在8: 00—10: 00和16: 00—18: 00; 藏酋猴从日出开始活动强度逐渐增加, 12: 00—14: 00达到高峰, 之后迅速下降。

图6 梵净山黔金丝猴与藏酋猴的日活动节律Fig. 6 Daily activity patterns of R. brelichi and M. thibetana in Fanjingshan Reserve
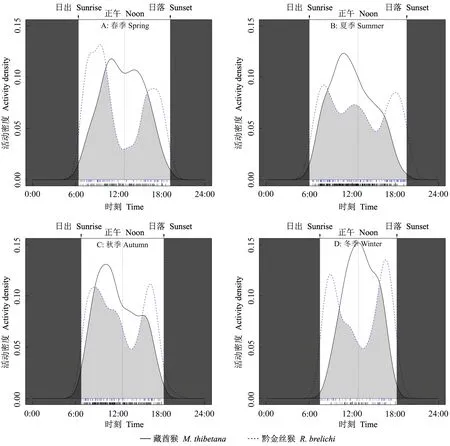
图7 梵净山黔金丝猴与藏酋猴的日活动节律及其季节变化Fig. 7 Daily activity patterns and seasonal variation of R. brelichi and M. thibetana in Fanjingshan Reserve
4 讨论
4.1 时间关系
黔金丝猴与藏酋猴的日活动节律明显不同, 呈现极显著差异(P< 0.01), 很好地错开了活动时间的竞争。虽然存在日活动节律重叠度的季节变化(冬春夏秋依次增大), 秋季的高重叠可能会引起竞争, 但笔者认为这种日活动节律差异和季节变化更多来自内源适应, 与自身取食特征和对栖息环境的温、光和食物资源等变化的响应密切相关(尚玉昌, 2014)。此外, 秋季的栖息地内分布着大量优质果实资源, 可选食物丰富, 同域灵长类对特定空间的竞争压力相对减少, 可通过取食不同主要食物维护共存(Singhetal., 2011; Zhouetal., 2018)。因而, 高度相似的日活动节律变得不再重要, 更多地在于如何适应该环境条件的季节变化, 使其日活动时间得到合理有效的分配(Schoener, 1974)。
受地球公转影响, 滇金丝猴(R.bieti)的日活动时间在短日照的冬季比长日照的夏季缩短2 h, 且推迟1 h开始活动(Dingetal., 2004)。其他昼行性灵长类也表现出相似行为(黄中豪等, 2007; Hanyaetal., 2018)。Dunbar(1992)认为, 昼长是有效制约昼行性动物日活动时间分配和长度的重要因素, 如何在昼间获得一天内所需能量, 合理分配其活动时间尤为重要。黔金丝猴与藏酋猴在不同季节对昼长的反应相似, 相较于夏季, 在冬季呈现为日活动时间缩短和日出活动时间推迟。可见, 黔金丝猴与藏酋猴的日活动时长同样受昼长制约。
黔金丝猴与藏酋猴的日活动节律均为完全昼行性, 但黔金丝猴活动呈明显晨昏性, 藏酋猴则呈单高峰特点。Clutton-Brock(1974;1977)认为引起灵长类日活动节律不同的重要因素是白天温度和日照强度的变化, 以及与自身的消化生理和形态特征, 并最终表现出一定的节律性适应特征。黔金丝猴与叶食性灵长类的日活动节律相似(Huangetal., 2003; 黄乘明等, 2018; 张龙等, 2019), 即在经过夜间较长时间的不进食后, 急需补充营养, 会随日出开始积极寻找和采集食物, 出现第1个活动高峰; 午间普遍会增加休息减少活动, 因为所食树叶富含纤维素, 休息利于树叶营养在肠胃中的发酵、分解和吸收(美国国家学院国家研究委员会, 2011); 为迎接漫漫长夜的到来, 日落前普遍又再一次进行高强度取食, 以保障进入夜宿地后的热量维持。藏酋猴单峰型日活动节律与猕猴类相似(周岐海等, 2007; Hanyaetal., 2018), 因其肠道短、食性杂, 多取食高糖、高水、低纤维的食物(美国国家学院国家研究委员会, 2011), 大多没有明显晨昏活动特点, 而是在日出后活动逐渐增强, 日间持续保持一定强度的活动, 常在一定时段出现明显单高峰或不明显的多高峰。
季节性的温度变化是影响灵长类日活动节律季节差异的重要因素, 其带来的环境资源变化迫使灵长类改变生存适应策略, 尤其在严寒冬季和酷热夏季表现更明显(Nakagawaetal., 2010; 黄乘明等, 2018)。冬季面临低温、食物匮乏的困境, 灵长类生存压力剧增, 为减少机体损耗、高效获取每日所需基本营养, 它们常通过节能保温的生存策略度过寒冬(黎大勇, 2010; Nakagawaetal., 2010; 黄乘明等, 2018)。藏酋猴与黔金丝猴为躲避冬季寒冷, 会倾向于选择高温时段活动(图7D), 藏酋猴表现为日活动开始时间变晚, 活动高峰由上午推迟至午间。这种躲避低温的越冬策略普遍存在于多种灵长类中, 如日本猕猴(M.fuscata)在冬季偏向于午后至下午活动(Hanyaetal., 2018), 熊猴(M.assamensis)的觅食、移动活动于11: 00后保持着较高比例, 并一直持续到日落前(周岐海等, 2007), 黑叶猴(Trachypithecusfrancoisi)的大部分觅食、移动活动也分配于下午时段(Zhouetal., 2007)。这归因于日间的积温变化, 日间高温时段常集聚在中午到下午, 因而在评估低温能量损耗与觅食利益之后, 灵长类可能采取能量最大化的活动策略, 以减少不必要的能量损耗(Schoener, 1971)。黔金丝猴表现为晨、昏某时段活动的高度聚集, 以及午间进行长时间休息, 目的是保持体温和对上午获得食物营养的较高效率的发酵、分解和吸收(Huangetal., 2003; Zhouetal., 2007; 黎大勇, 2010)。夏季大多数灵长类会在林下或洞穴中休息纳凉减少活动, 以躲避正午至午后时段的高温侵袭(Dingetal., 2004; 黄中豪等, 2007; 黄乘明等, 2018)。为躲避高温, 藏酋猴日活动集中于上午, 午后活动强度逐渐减弱。然而, 黔金丝猴日活动节律呈现多峰型特点, 增强了午间活动, 笔者认为这种日活动策略可能与食物资源的丰度与种类有关, 夏季丰富的花、果给它们提供了高质量、易消化的食物, 减少了休息消化时间, 增加了活动时间的宽度与自由度(Schoener, 1971; Dingetal., 2004)。另外, 这还可能与安装的相机位置有关, 相较于树冠层或裸露区, 林下温度明显更低、更凉爽(Huangetal., 2003), 使得黔金丝猴在气温高的时段更易在林下被发现。总的来说, 它们的日活动差异主要与当地气候环境和食物资源有关, 普遍呈现既适应当地环境又满足自身需求的变化(Nakagawaetal., 2010; 黎大勇等, 2013; 黄乘明等, 2018)。
4.2 空间关系
黔金丝猴的空间分布明显嵌套于藏酋猴分布范围内, 且不出现于风景旅游区。过去, 旅游风景区部分范围曾是黔金丝猴由梵净山东北部向西南部游走的途经区域(杨业勤等, 2002), 但随当地旅游开发, 生性机敏、害羞的黔金丝猴活动空间受到极大的负面影响。Guo等(2020)经过2年实地踏查, 发现梵净山南部未见黔金丝猴任何活动痕迹。同时, 笔者的研究也表明黔金丝猴不再出现于梵净山风景旅游区范围, 意味着它们的活动路线可能改变或迁移受阻。因此, 相比于原有栖息活动范围, 环境现状可能压缩了黔金丝猴的分布空间或造成分布破碎化。进一步还可能影响种群间交流, 威胁到种群遗传繁衍: 在梵净山东北部获取的128只野外个体线粒体DNA变异分析研究中, 发现黔金丝猴遗传多样性已处于极低状态, 种内受胁程度紧迫(Panetal., 2011)。另外, 由于藏酋猴在梵净山保护区广泛分布且环境适应能力较强, 种群生存更具优势, 可能也会阻碍黔金丝猴的种群发展, 增加黔金丝猴的生存阻力。
虽然笔者发现黔金丝猴与藏酋猴的空间分布高度重叠, 但二者不会同框出现, 存在一定规律的利用时间差异, 交互利用时间相差平均5~6天, 有效降低在同一空间相遇的可能竞争。同时, 黔金丝猴与藏酋猴栖息地选择明显不同, 黔金丝猴主要活动于1 600~1 900 m的中山常绿落叶阔叶混交林中(图3), 这一特定活动范围与其他学者研究结果一致, 主要原因在于其主要食物来源于该区域的森林, 以及远离低海拔的人类活动干扰(Xiangetal., 2012; Guoetal., 2020)。藏酋猴则广泛分布于整个调查区域, 仅在植被较单一的次生林中活动较低(图3B), 与在其他分布区一样, 表现出极强的环境适应能力(蒋学龙等, 1996; 熊成培, 1984; Zhaoetal., 1989)。因此, 空间上合理有效的划分自需资源和利用时间差, 无疑减小了二者的空间相遇机会和可能竞争。在其他地区, 与本研究亲缘关系类似的同域灵长类也呈现明显的栖息地选择差异, 如云南白马雪山自然保护区的猕猴(M.mulatta)与滇金丝猴(R.bieti), 前者更喜欢中低海拔的常绿阔叶林, 后者更喜欢中高海拔的常绿落叶阔叶混交林(Grueteretal., 2010); 分布于四川唐家河自然保护区的藏酋猴与川金丝猴(R.roxellanae), 前者主要栖息于海拔1 200~1 800 m的常绿落阔混交林和落叶阔叶林内, 后者主要在海拔1 800~2 900 m的落叶阔叶林和针阔混交林内(白洢露, 2019)。Grueter等(2010)认为同域物种的生态选择差异一定程度上反映了种间竞争的存在与分化, 也预示着它们不同的生理生态需求。经过历史的长期适应进化, 不同灵长类的肠胃消化系统各有差异, 意味着它们的食物选择存在一定变化(美国国家学院国家研究委员会, 2011)。藏酋猴相比于黔金丝猴, 它们胃内壁更简单、光滑, 小肠更短, 不易分解纤维含量较高的叶组织(美国国家学院国家研究委员会, 2011; Zhouetal., 2014), 藏酋猴更多以高蛋白、高糖分和低纤维的植物组织为食(Zhaoetal., 1991)。然而, 黔金丝猴拥有作为食物初级储存和发酵的前囊, 类似于反刍动物的前胃结构, 可通过发酵的方式降解叶片纤维素, 能有效地吸收和利用其中的营养, 最终造就黔金丝猴更多以叶为食(Zhouetal., 2014)。因此, 对于生态位划分明显的同域物种, 相互之间是可以友好共存的。
在梵净山的物种RAI中, 藏酋猴(28.23)占比最高, 甚至超过了野猪(Susscrofa)(11.82)2倍之多(张明明等, 2019)。可见, 性胆大、适应能力强的藏酋猴在梵净山较为常见, 受旅游和人类影响程度很低, 种群优势明显, 据杨业勤等(2002)统计, 梵净山藏酋猴的种群数量达2 000余只, 是当时黔金丝猴数量的近3倍。迫于旅游和人类活动影响, 黔金丝猴的空间分布明显受限(图2)(Guoetal., 2020), 且近20年来种群数量一直维持着700余只(杨业勤等, 2002; 郭艳清等, 2017), 生存现状岌岌可危。虽然二者拥有不同的取食特性和空间选择, 但在种群分布、数量和环境适应能力等方面, 黔金丝猴受限因素明显更多。随着藏酋猴数量不断扩增和发展, 处于受限空间内的黔金丝猴与藏酋猴的种间关系可能会恶化, 可能出现类似于西黑冠长臂猿(Nomascusconcolor)与印支灰叶猴(T.crepusculus)不对称的恶性竞争(Chenetal., 2020), 最终不利于黔金丝猴小种群复壮和扩增。因此, 为了解二者种间关系的现状和未来变化, 还需长期深入调查, 从而较为全面地获悉在人类活动和旅游共同影响背景下的这2个物种的竞争与共存关系。
5 结论
近4年的红外相机监测研究表明, 黔金丝猴日间活动为晨昏型, 在梵净山东北部主要分布于远离旅游索道、海拔1 600~1 900 m范围的常绿落叶阔叶林中。藏酋猴日间活动为单峰型, 在梵净山东北部具较强适应能力, 调查范围内均有分布, 无明显的海拔、植被类型选择偏好。时空关系上二者的生态位划分明显, 有效避免了竞争和冲突的发生, 可友好共存。但迫于人类活动干扰影响, 黔金丝猴的空间分布明显受限, 不利于其种群发展, 对现环境下的二者关系的发展趋势还需要长期深入调查, 才能较全面获悉在人类活动干扰背景下的竞争与共存关系。

