微囊藻毒素纳米抗体的制备及其间接竞争酶联免疫分析方法的建立
司 睿,吴广培,王 锋,雷红涛,王 弘
(华南农业大学食品学院 广东省食品质量与安全重点实验室畜产品精准加工与安全控制技术国家地方联合工程研究中心(广东) 广州 510642)
微囊藻毒素(Microcysin,MC)是一种天然小分子毒素[1],由蓝藻产生并释放到水体中[2],主要有MC-LR、MC-LA、MC-LY、MC-LW、MC-LF、MCYR、MC-WR、MC-RR 等8 种异构体[3],其中MCLR 毒性最强[4],普通水厂净化不能有效去除,严重威胁人畜饮用水安全。1996年,巴西一透析中心的透析液被MC-LR 污染,导致至少26 人死亡[5]。而在我国,2007年太湖蓝藻爆发导致整个无锡市的饮用水污染[6]。此外,在长江、黄河、松花江中下游等主要河流以及鄱阳湖、武汉东湖、上海淀山湖等几大淡水湖泊中,均检测到MC-LR。构建藻毒素的快速检测方法十分必要。
免疫分析方法是一种基于抗原与抗体特异性识别的检测技术[7],由于特异性强、灵敏度高等优点而被广泛应用于检测分析中[8-9]。近年来,免疫分析方法发展迅速,其中以酶联免疫分析法 (Enzyme-linked immunosorbent assay,ELISA) 应用最广泛[10]。对于免疫分析方法而言,制备高质量的抗体是其重点与难点所在[11]。与传统多克隆抗体和单克隆抗体相比,仅由重链可变区组成的纳米抗体(Nanobody,Nb)具有稳定性强、易表达、易于基因工程操作等特性[12-13],在免疫检测方面的应用优势越来越受到人们的关注。本研究基于实验室前期已构建好的噬菌体展示纳米抗体文库[14],采用固相亲和淘筛的方法,制备得到特异性识别MC-LR 的纳米抗体,建立MC-LR 的间接竞争酶联免疫分析方法,并将其应用于实际样品中MC-LR 的检测。

图1 微囊藻毒素-LR 结构式Fig.1 The structure of MC-LR
1 材料与方法
1.1 材料与试剂
MCs 标准品,台湾Algal 公司;大肠杆菌BL21(DE3)菌株,全式金生物公司;大肠杆菌ER2738菌株,美国Lucigen 公司;TMB 显色液,北京索莱宝科技有限公司;兔抗VHH-HRP 多克隆抗体,南京金斯瑞科技有限公司;辅助噬菌体M13K07,NEB 生物科技有限公司;M13 噬菌体抗体,美国GE 公司;引物合成及测序由广州睿博公司完成。
1.2 仪器与设备
NanoDrop 2000C 分光光度计、SORVALL LYNX 4000 centrifuge 离心机、Multiskan MK3 酶标仪,美国Thermo 公司;蛋白电泳仪、Biologic LP蛋白纯化仪、GDS7500 凝胶成像仪,美国BIORAD公司。
1.3 方法
1.3.1 噬菌体展示纳米抗体文库的筛选与鉴定采用固相亲和淘筛方法,对已构建好的纳米抗体文库进行4 轮筛选,每轮包被不同质量浓度微囊藻毒素-鸡蛋白蛋白偶联物MC-LR-OVA(10,2.5,0.5,0.1 μg/mL),37 ℃包被过夜。用磷酸盐缓冲液(吐温)洗涤2 次,每轮选用不同封闭液封闭3 h。将100 μL 纳米抗体文库加入包被原孔,37 ℃振荡孵育1 h。第1~3 轮淘筛加入药物进行竞争洗脱,质量浓度依次为2,0.5,0.1 μg/mL,第4 轮为10 mg/mL 胰蛋白酶,37 ℃振荡1 h,重复洗脱1次,混合两次洗脱液即为各轮淘筛产物。取10 μL洗脱液计算滴度,其余进行扩增后用于下一轮的淘筛。从第4 轮的平板上随机挑取20 个单克隆进行深孔板表达,用ic-ELISA 方法检测其活性。根据测定结果,抑制率(Inhibition rate,I)计算公式如下:
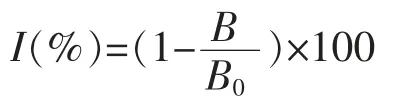
式中,B0——MC-LR“0”质量浓度孔对应的吸光值;B——MC-LR 标准溶液孔对应的吸光值。
1.3.2 抗MC-LR 纳米抗体的表达纯化与性能分析 将含有抗 MC-LR 纳米抗体基因的pComb3XSS 质粒转化至表达宿主大肠杆菌BL21(DE3) 中,表达条件为:37 ℃、250 r/min、1%接种量、0.1 mmol/L 异丙基-β-D-硫代半乳糖苷,采用冻融法提取菌体周质腔,经镍柱亲和纯化获得纳米抗体。利用ic-ELISA 方法,研究其热稳定性及有机溶剂耐受性。
1.3.3 基于抗MC-LR 纳米抗体M110 的ic-ELISA 的方法建立 用包被液将包被抗原MCLR-OVA 稀释至1 000 ng/mL,100 μL/孔加入到酶标板,37 ℃包被过夜。次日,用1%鱼胶,37 ℃封闭3 h。向酶标板内加入50 μL/孔的纳米抗体及50 μL/孔不同质量浓度的MC-LR 标准品溶液,37 ℃孵育40 min。用PBST 洗涤5 次,加入100 μL/孔的兔抗VHH-HRP 抗体(0.1 μg/mL),37 ℃孵育40 min。用PBST 洗涤5 次后,加入100 μL/孔的TMB显色液,37 ℃孵育10 min,加入50 μL/孔10%的H2SO4溶液终止后,测定A450nm吸光值。
1.3.4 样品添加回收及方法准确性分析 取车陂涌华南农业大学段水样,参照国标GB/T 20466-2006《水中微囊藻毒素的测定》的检测方法,以建立的ic-ELISA 方法对样品进行检测,并与UPLCMS/MS 检测结果进行比对,评价方法的可靠性。
2 结果与分析
2.1 噬菌体展示纳米抗体文库的淘筛
以MC-LR 为免疫原,本课题组在试验前期已成功构建库容量为8.33×107CFU/mL VHH 基因文库。经辅助噬菌体M13K07 救援后,获得滴度为1.0×1012PFU/mL 噬菌体展示纳米抗体文库。
以MC-LR-OVA 为包被原,对噬菌体展示纳米抗体文库进行4 轮淘筛,从第4 轮筛选的洗脱产物测定平板上随机挑选20 个克隆,用ic-ELISA鉴定其活性,结果如图2所示。最终获得抗MCLR 纳米抗体2 株:M110 和M207,其序列信息如图3所示。采用ic-ELISA 检测抗体活性,选择抑特异性较好的M110 克隆(I=97.26%)用于后续研究。
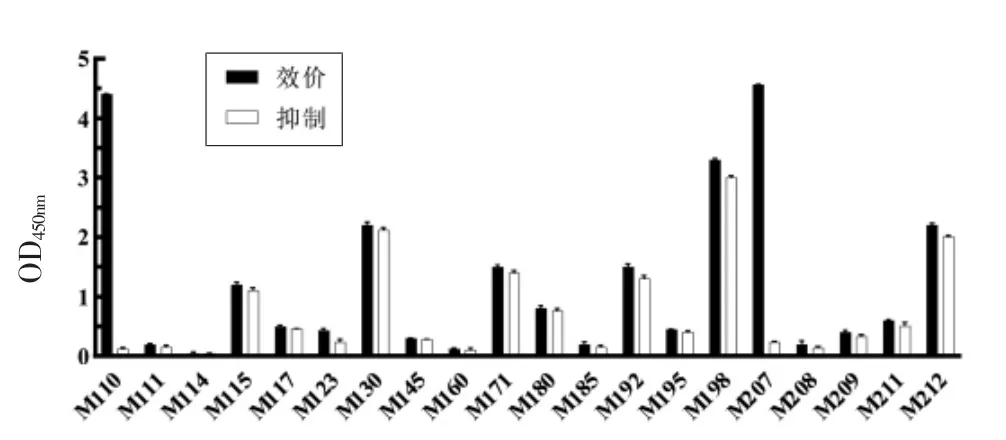
图2 ic-ELISA 鉴定特异性阳性克隆Fig.2 Identification of specific positive clones by ic-ELISA

图3 M110、M207 序列比对Fig.3 Sequence aligment of M110 and M207
2.2 纳米抗体M110 的表达纯化及性能分析
表达纯化后的纳米抗体经SDS-PAGE 和免疫印迹验证(图4),纯度可达90%以上,表达量为3.5 mg/L。稳定性分析结果表明(图5),纳米抗体M110 在90 ℃孵育1 h,仍具备超过60%的抗原结合活性,且在体积分数40%甲醇或乙腈中仍具有超过80%的活性,这显示该抗体具有较好的热稳定和有机溶剂耐受性。

图4 SDS-PAGE(a)和免疫印迹(b)验证纯化后纳米抗体M110Fig.4 Identification of the purified nanobody M110 by SDS-PAGE (a) and western blotting (b)

图5 纳米抗体M110 热稳定性和有机溶剂耐受性分析Fig.5 Thermal stability and organic solvents tolerance of nanobody M110
2.3 基于纳米抗体M110 的ic-ELISA 方法建立及灵敏度和特异性评价
2.3.1 基于纳米抗体M110 的ic-ELISA 方法建立 建立基于纳米抗体M110 检测MC-LR 的ic-ELISA 方法,绘制竞争抑制标准曲线[14]。如图6所示,其IC50为3.55 ng/mL,线性范围为1.28~9.88 ng/mL,检测限为0.652 ng/mL,其与所有藻毒素类毒素均有交叉(表1),可能的原因是藻毒素均有一个共同的结构域Adda,纳米抗体M110 能够识别的区域是Adda。

表1 纳米抗体M110 与藻毒素的交叉率(n=3)Table 1 The crossover rate between nanobody M110 and algal toxin (n=3)

图6 基于纳米抗体M110 的ic-ELISA 方法检测MC-LR 的标准曲线(n=3)Fig.6 The standard curve of ic-ELISA for detecting MC-LR based on nanobody M110 (n=3)
2.3.2 样品添加回收及方法准确性分析 分别对水样添加不同质量浓度MC-LR 标准品(0.5,1,2 ng/mL)进行添加回收试验,采用UPLC-MS/MS 方法对ic-ELISA 方法进行验证,其结果见表2,ic-ELISA 方法回收率为111.0%~119.3%,从图7中可以看出,两种方法的结果相关系数达0.999,结果表明ic-ELISA 方法检测准确性良好。

表2 基于M110 的ic-ELISA 方法检测水样中MC-LR 的回收率(n=3)Table 2 Recovery of MC-LR in water samples detected by ic-ELISA based on M110 (n=3)
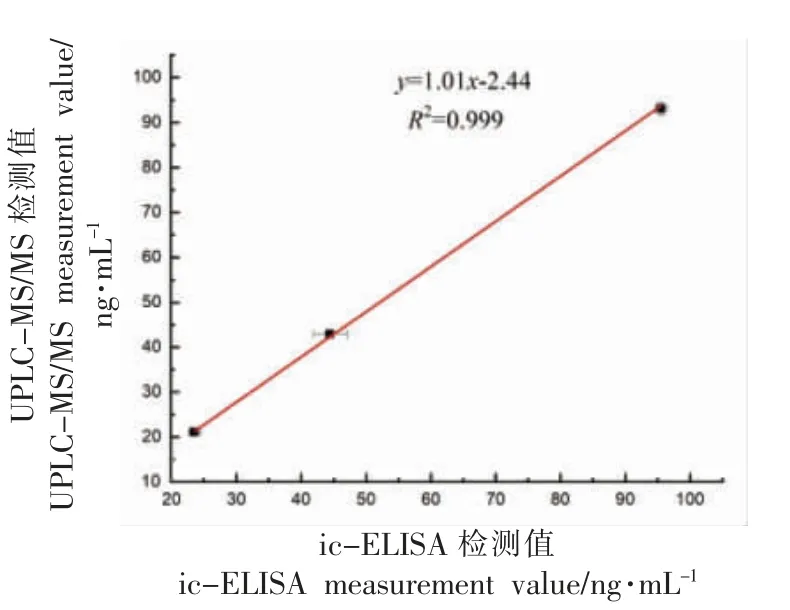
图7 ic-ELISA 和UPLC-MS/MS 方法检测水样中MC-LR 的结果比对(n=3)Fig.7 Results comparison of MC-LR in water samples detected by ic-ELISA and UPLC-MS/MS (n=3)
3 结论
纳米抗体因其特性,被广泛应用于医疗方面,近年来也被广泛应用于小分子污染物检测中。本研究构建了针对MC-LR 的纳米抗体文库,库容量为8.33×107CFU/mL。并通过亲和淘筛获得MCLR 纳米抗体M110,建立了MC-LR 的ic-ELISA方法,其IC50为3.55 ng/mL。将该方法其应用于水样中MC-LR 的检测,并利用UPLC-MS/MS 方法进行仪器比对,该ic-ELISA 方法准确性好、灵敏度高,制备的纳米抗体M110 还具有较好的热稳定性与有机溶剂耐受性,可用于免疫快速检测试剂盒的开发研究。

