金枪鱼纳米鱼骨钙对鱼糜制品凝胶特性的影响
翟 璐,杨加成,陈 康,金仁耀,3*,刘 征
(1 浙江工商大学海洋食品研究院 杭州 310012 2 浙江省水产品加工技术研究联合重点实验室 杭州 310012 3 浙江工商大学 海洋食品精深加工关键技术省部共建协同创新中心 杭州 310012 4 中国美术学院 文创设计制造业协同创新中心 杭州 310024)
鱼糜制品是鱼糜经过斩拌、凝胶化、熟化工艺制成的具有凝胶强度的鱼肉产品。弹性是鱼糜制品的一个重要指标,而蛋白质的凝胶化是形成Q弹质地的重要步骤。据报道[1],鱼糜凝固过程是由内源性转谷氨酰胺酶(TGase)介导的,TGase 能够促使鱼糜蛋白质之间形成ε-(γ-谷氨酰胺) 赖氨酸共价键,从而促使鱼糜形成紧密的三维网状结构,提高凝胶强度。鱼骨是鱼类加工业的主要副产品之一,富含胶原蛋白、软骨素、必需脂肪酸和无机盐,是低价钙的潜在来源[2]。据报道,鱼骨中的钙化合物具有高度生物利用率[3],可作为功能性食品中的天然钙源或作为食品补充剂,如超细粉碎盐煸鸡骨泥鸡肉肠[4]、猪骨泥肉丸[5]、鮰鱼鱼肉火腿肠[6]等。相关报道表明鱼骨钙能够激活内源性TGase[7-8],在鱼糜中添加鱼骨粉可提供额外的膳食钙并改善凝胶质地,然而大颗粒的鱼骨粉不仅不能改善鱼糜凝胶品质,甚至还会破坏鱼糜凝胶网络,增加砂砾口感,因此需要减少鱼骨粉粒径使其置于鱼糜蛋白凝胶网络空隙中,在提高鱼糜凝胶强度的同时不影响口感[9-10]。
目前,制备纳米鱼骨钙的主要方法是球磨法。范露等[11]利用干法球磨法制备超微鲢鱼骨粉。李少博等[12]通过响应面优化干法球磨条件制得纳米级兔骨钙。尹涛[13]研究了干、湿两种球磨方法制备纳米鱼骨及其对鱼糜凝胶特性的影响。除对鱼糜凝胶强度有影响外,纳米鱼骨钙也可应用于其它制品,如Khoder 等[14]报道纳米鱼骨对柠檬酸凝结豆腐凝胶的影响。本文通过微波辅助法制备金枪鱼骨纳米钙并应用于鱼糜制品中,研究添加纳米鱼骨钙对鱼糜制品特性的影响,为钙源型鱼糜制品研究提供理论支持。
1 材料与方法
1.1 材料与试剂
FF 级白姑鱼冷冻鱼糜,浙江渔福食品有限公司提供;乙酯型精制鱼油(EPA:14.52%;DHA:43.85%),来源为海洋鱼类废弃物提取,浙江兴业食品有限公司提供;食盐、PVDC 肠衣 (直径45 mm)均为市售;十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)、过硫酸铵、β-巯基乙醇、三羟基氨基甲烷(Tris)为电泳纯,美国Bio-Rad 公司;即用型蛋白质分子质量标准(高),宝生物工程有限公司;其它化学试剂均为分析纯级,国药集团化学试剂有限公司。
1.2 仪器与设备
EF 410 型食品调理机,美国Ashton 公司;WF-12 型液压灌肠机,嘉兴市瑞邦机械工程有限公司;TMS-Pro 质构仪,美国FTC 仪器有限公司;Color Quest XE 色差仪,美国Hunter Lab 仪器有限公司;SpectraMax 190 全波长酶标仪,美国Molecular Devices 公司;Mini-protein Tetra Cell垂直电泳槽、PowerPac Basic 电泳仪、GS 800 凝胶扫描仪,美国Bio-Rad 仪器有限公司;T-18 均质机,德国IKA 仪器有限公司;Lynx 4000 型高速冷冻离心机;Evolution 60s 紫外分光光度计,美国Thermo Fisher Scientific 公司;Nicolet iS5 FT-IR光谱仪,美国Thermo Fisher Scientific 公司。
1.3 方法
1.3.1 纳米钙的制备 称取定量的金枪鱼骨沸水烫漂3 min 后用自来水冲洗去除表面杂质,120 ℃蒸煮鱼骨20 min。按料液比1∶1 将鱼骨与蒸馏水混合,将pH 值调至7.5 后,加0.5%胰蛋白酶与0.5%中性蛋白酶(以鱼骨质量计)在55 ℃酶解60 min 后煮沸10 min 灭酶。灭酶后的鱼骨按样品质量120 g、微波功率800 W、微波时间90 min 处理,再用粉碎机粉碎。
1.3.2 化学组成的测定 水分参照GB 5009.3-2016《食品中水分的测定》中的直接干燥法进行测定;粗蛋白质参照GB 5009.5-2016《食品中蛋白质的测定》 中的凯氏定氮法测定;脂肪参照GB 5009.6-2016《食品中脂肪的测定》中的索氏抽提法测定;灰分参照GB 5009.4-2016《食品中灰分的测定》 中的灼烧称重法进行测定。鱼骨粉中的钙、铜、镁和锌含量参照GB/T 13885-2017《饲料中钙、铜、铁、镁、锰、钾、钠和锌含量的测定》用原子吸收光谱法测定;磷含量参照GB 5009.87-2016 《食品中磷的测定》 中的分光光度法进行测定。
1.3.3 纳米乳制备[15]食品级单辛酸甘油酯与司盘80 按质量比7∶3 混合均匀作为油相。将1 mL质量浓度为25 mg/mL 的茶多酚溶液缓慢滴加至9 mL 油相中,室温下900 r/min 磁力搅拌20 min,制备均匀乳液。配制60 mL 含有0.07%海藻酸钠,3.0%吐温80 及0.06% SDF 的溶液并缓慢滴加上述乳液,600 r/min 搅拌10 min 使其均匀,而后超声高速均质2.0 min 形成纳米乳。滴加1.0 mL 0.1%鱼骨粉悬浊液(CaCl2溶液)于制得纳米乳中,600 r/min 搅拌30 min 后添加0.06%壳聚糖4.0 mL,再持续搅拌60 min 得纳米鱼骨钙乳液。
1.3.4 鱼糜凝胶制备 取500 g 冷冻鱼糜于4 ℃下解冻,切碎后斩拌,斩拌过程中加入2%食盐、不同质量分数的纳米鱼骨乳(0%,0.1%,0.25%,0.5%,0.75%,1%和2%)以及对照组0.2%的CaCl2溶液,温度控制在10 ℃以下。鱼糜溶胶灌肠成型后,采用二段加热法(45 ℃,30 min;90 ℃,20 min)凝胶化,冰水冷却后4 ℃冷藏待测。以上百分含量皆以冷冻鱼糜质量为参照。
1.3.5 鱼糜凝胶pH 值和可溶性钙测定 pH 值参考GB 5009.237-2016 《食品安全国家标准 食品pH 值的测定》[16]方法进行pH 值测定。可溶钙含量的测定方法如下:取样品于4 000×g 室温离心30 min。上清液在105 ℃空气烘箱中干燥3 h,炭化直至停止冒烟,然后于马弗炉中550 ℃灰化,获得白色或灰色灰烬。用硝酸溶解灰烬,用氯化镧溶液稀释,原子吸收光谱法测定钙含量。
1.3.6 鱼糜凝胶质构特性测定 将待测样品切成20 mm 厚的圆柱体,室温下平衡30 min 后,TPA 方法测定质构特性,P/5S 球形探头。根据公式(1)计算凝胶强度。

1.3.7 鱼糜凝胶白度测定 将待测样品切成20 mm 厚的圆柱体,于室温下平衡30 min。测定L*、a*、b*值。根据公式(2)计算白度(W)。

1.3.8 鱼糜凝胶持水力和蒸煮损失率测定 准确称取3.0 g(M1)鱼糜样品,3 层滤纸包裹后,于50 mL 离心管中5 000×g 离心15 min,离心温度4 ℃,再次称重 (M2)[17]。根据公式 (3) 计算持水力(WHC)。

将切成薄片的鱼糜样品称重(m1)后放入封口蒸煮袋,90 ℃恒温水浴20 min,迅速取出鱼糜凝胶,轻柔擦去表面液体后再次称重(m2),根据公式(4)计算蒸煮损失率

1.3.9 鱼糜凝胶化学作用力测定 准确称取2.0 g 鱼糜样品分别与10 mL 不同的化学作用力破坏试剂混合均质,4 ℃搅拌60 min 后离心,测定上清液中的蛋白浓度。化学作用力破坏试剂为:0.05 mol/L NaCl (SA),0.6 mol/L NaCl (SB),0.6 mol/L NaCl+1.5 mol/L 尿素(SC),0.6 mol/L NaCl+8 mol/L 尿素(SD),0.6 mol/L NaCl+8 mol/L 尿素+0.05 mol/L β-巯基乙醇(SE)。化学作用力以组间上清液蛋白浓度差表示:离子键为SB 与SA 差异,氢键以SC 与SB 差异,疏水作用力以SD 与SC 差异,二硫键以SE 与SD 差异。
1.3.10 SDS-PAGE 凝胶电泳 浓缩胶和分离胶分别为4%和10%的丙烯酰胺。称取鱼糜凝胶样品1.0 g,加入9.0 mL 5% SDS 溶液,均质后于85 ℃恒温水浴60 min,冷却至室温后离心,取上清液与上样缓冲液按体积比1∶1 混合,沸水浴5 min。
1.3.11 傅里叶变换红外光谱 将冷冻干燥的鱼糜凝胶和溴化钾按质量比1∶100 于玛瑙研钵研磨均匀,20 MPa 压力下压片,使用傅里叶变换红外光谱仪扫描。在波数400~4 000 cm-1范围内收集光谱,分辨率为4 cm-1,扫描64 次。
1.3.12 数据分析 试验数据采用SPSS 16.0 和Origin 8.6 软件数据分析及制图,差异显著性为P<0.05,每个样品平行3 次。
2 结果分析
2.1 纳米钙基本成分及特性
由表1可知,金枪鱼骨灰分含量最高,达58.95%,高于同属硬骨鱼纲的鲶鱼[18],同时也显著高于金枪鱼肉[19]和金枪鱼皮[20],表明其含有较高的钙、磷等矿物质元素。其次为粗蛋白含量,占总质量的35.45%。水分及脂肪含量较低,分别为7.27%及1.29%。由此可见,金枪鱼骨是一种富含矿物质的蛋白原料,是开发钙类产品的良好原料。

表1 金枪鱼骨基本成分及含量(%)Table 1 Tuna bone basic composition and content (%)
由表2可知,金枪鱼骨矿物质组成中钙、磷含量较高,分别为88 383 mg/kg 和51 662 mg/kg,钙磷比1.71∶1 接近人体钙磷比2∶1,符合人体对钙磷的需求。钙、镁、锌为身体不可缺少的微量元素,对于骨骼肌的生长和促进其发育效果尤为显著,可调节内分泌和内环境,预防骨质疏松和低钙血症导致的骨关节炎和营养不良。

表2 金枪鱼骨矿物元素组成及含量Table 2 The mineral elements composition and content of tuna bone
2.2 纳米钙对鱼糜凝胶质构特性的影响
不同添加量的纳米鱼骨(NFB)对鱼糜凝胶破裂力和破裂位移的影响如图1所示。鱼糜凝胶的破裂力和破裂位移随着NFB 添加量的增加而呈先升高后下降的趋势,至0.75%达最大值。添加0.2% CaCl2的鱼糜凝胶破裂力和破裂强度接近0.5% NFB,相较空白组有明显提升,这与Yin 等[8]的研究相一致。据Hemung[7]和Yongsawatdigul 等[21]的研究表明,Ca2+不仅可以激活内源性TGase,还可以诱导肌球蛋白的展开,促使肌球蛋白内部的活性基团暴露,从而利于内源性TGase 的催化反应,形成致密蛋白网络结构,提高凝胶强度。

图1 纳米鱼骨添加量对鱼糜凝胶破裂力和破裂位移的影响Fig.1 Effects of NFB addition amount on breaking force and breakage displacement of surimi gel
由表3可知,添加纳米鱼骨对鱼糜凝胶的硬度、弹性、胶黏性以及咀嚼性的影响显著。咀嚼性随纳米鱼骨添加量的增加呈上升趋势,这可能是因为纳米鱼骨进入鱼糜的凝胶网络结构,从而增大了咀嚼度。硬度随纳米鱼骨添加量的增加呈先降后升的趋势,而弹性和胶黏性均呈先上升后下降的趋势,最大值出现在纳米鱼骨添加量0.75%时。加入少量Ca2+有利于激发鱼糜的内源性TGase,促使谷氨酸和赖氨酸残基交联形成共价交联键,从而形成更加致密的蛋白网络结构,当Ca2+浓度过高时,一方面蛋白质聚集速度加快,不利于共价交联键的形成[22],另一方面,由于“钙桥”的出现,致使弹性和胶黏性下降,硬度和咀嚼度上升。鱼糜凝胶的黏附性和内聚性随纳米鱼骨添加量的增加呈不显著变化。添加0.2% CaCl2溶液与空白相比较而言,虽使鱼糜凝胶的弹性和咀嚼性有所提升,但也使得硬度和胶黏性略有下降,而对黏附性和内聚性无明显影响。
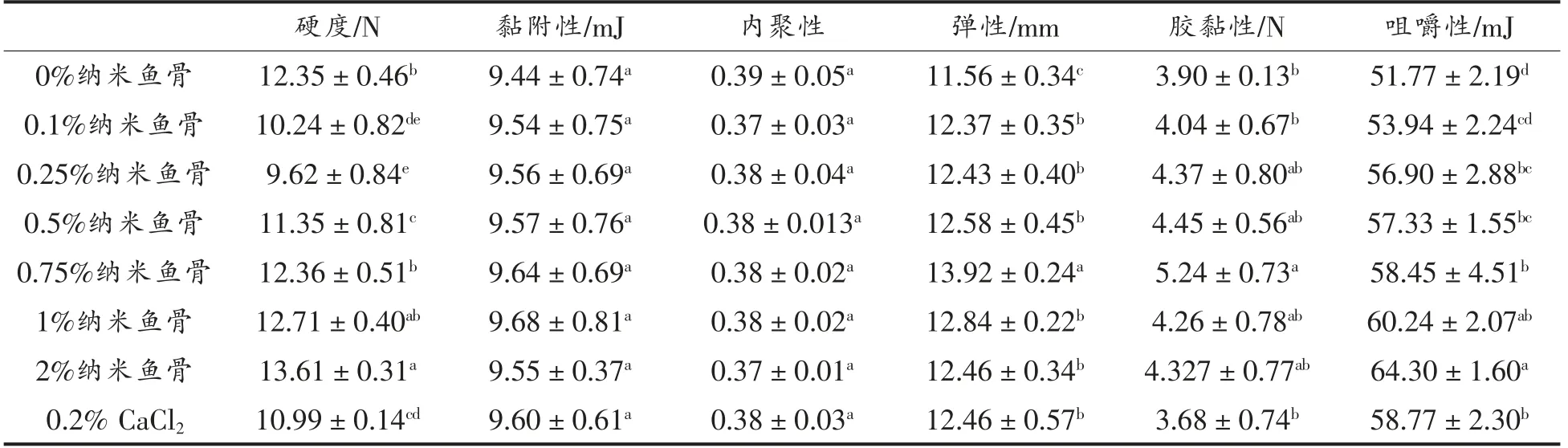
表3 纳米鱼骨添加量对鱼糜凝胶质构特性的影响Table 3 Effects of NFB addition amount on the texture properties of surimi gels
2.3 纳米钙对鱼糜凝胶pH 值和可溶性钙的影响
由图2可知,随着纳米鱼骨的加入,鱼糜凝胶pH 值呈下降的趋势,当添加量为0%时,最大pH值为6.90。结果显示,添加0.2% CaCl2或是不同添加量的纳米鱼骨钙,鱼糜凝胶pH 值均在最适pH 6.7~7.5[23]之间的中性区域,说明添加纳米鱼骨至鱼糜中,符合鱼糜制品的最适加工条件。

图2 纳米鱼骨添加量对鱼糜凝胶pH 值的影响Fig.2 Effects of NFB addition amount on pH value of surimi gel
陈文华等[24]认为添加离子钙会降低肌肉蛋白的保水保油作用,因此肉制品中不适合添加可溶性离子钙。鱼骨中虽拥有大量钙,但大部分以羟基磷灰石结晶形式存在,溶解度较低,简单的物理加工并不能有效的提高可溶性钙含量。由图3可知,微波辅助加工纳米乳鱼骨钙可显著提高鱼糜制品中的可溶性钙含量,随着纳米鱼骨添加量的增加,可溶性钙含量总体呈现先升后降的趋势,当添加量为0.5%时,鱼糜制品中可溶性钙含量达最大值,为704.02 g/L。添加0.2% CaCl2,其可溶性钙含量较空白有明显提升,其值接近0.25%纳米鱼骨的可溶性钙含量。
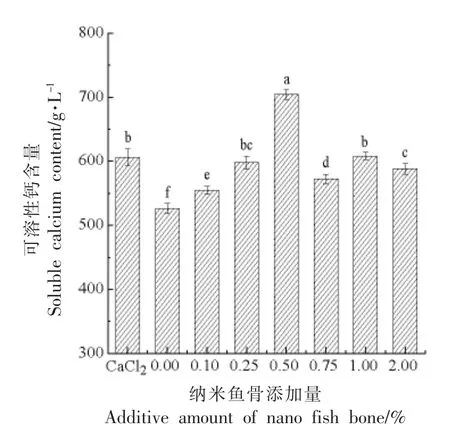
图3 纳米鱼骨添加量对鱼糜凝胶可溶性钙含量的影响Fig.3 Effect of NFB addition amount on soluble calcium content of surimi gel
2.4 纳米钙对鱼糜凝胶白度的影响
由表4可知,鱼糜凝胶的白度随纳米鱼骨添加量的增加表现出先降后升再降的变化,当纳米鱼骨添加量为1.0%时,鱼糜凝胶白度为最大值。添加0.2%的CaCl2的鱼糜凝胶白度略高于空白组,对鱼糜白度影响较小。鱼骨会由于脱脂不彻底或在加工过程被氧化褐变,导致鱼糜白度略有下降;随着纳米鱼骨添加量的增加,鱼糜凝胶形成致密网络结构,从而反射更多光,致使白度增加;当纳米鱼骨添加量为2.0%时,白度下降,可能原因是鱼糜凝胶中的鱼骨颗粒阻碍光的透射,这与王卫芳[25]的研究结果相似。

表4 纳米鱼骨添加量对鱼糜凝胶色度及白度的影响Table 4 Effects of NFB addition amount on the chromatic and whiteness values of surimi gel
2.5 纳米钙对鱼糜凝胶持水性的影响
由图4可知,随着纳米鱼骨添加量从0%增加至2.0%,鱼糜凝胶持水力持续增加至0.75%达最大值,随后下降。蒸煮损失率与持水力趋势相反,呈先降后升趋势。0.2%的CaCl2持水力相较空白而言虽有所提高,但低于0.25%纳米鱼骨,其蒸煮损失率仅次于空白和2.0%纳米鱼骨。纳米鱼骨添加量较低时,低浓度钙离子对鱼糜凝胶内源性TGase 起激发作用,促进鱼糜凝胶蛋白形成致密的凝胶网络结构,减弱凝胶网络结构中不易移动水的流动性,并促进游离水像不易移动水的转变,从而提高截留水分的能力,鱼糜持水性提高,蒸煮损失率下降。然而,钙离子和氯离子能结合蛋白质表面带相反电荷的基团,影响极性氨基酸与水的结合能力以及水分的分布,降低持水力。在纳米鱼骨添加低于0.5%时,在两种相互相反的作用下,持水力增长不显著[26]。当添加量再提高,钙离子与鱼糜蛋白之间形成“钙桥”破坏蛋白网络结构,且鱼骨颗粒物增多,致使鱼糜凝胶空隙增大,不利于凝胶水分的保持,持水力下降,蒸煮损失率上升[27]。

图4 纳米鱼骨添加量对鱼糜凝胶持水力和蒸煮损失率的影响Fig.4 Effects of NFB addition amount on water holding capacity and cooking loss rate of surimi gel
2.6 纳米钙对鱼糜凝胶化学作用力的影响
鱼糜凝胶蛋白呈三维网络结构,其结构与功能之间联系紧密。氢键是维持蛋白质二级结构的主要作用力,由带有相反电荷的氨基酸残基依靠库仑力结合形成的离子键对蛋白质的三级和四级结构起重要作用,疏水相互作用是推动蛋白质折叠的主要作用力,二硫键对蛋白质特定分子结构起相关作用。由表5可知,随着纳米鱼骨添加量的增加,离子键、疏水相互作用和二硫键均呈先升后降的趋势,氢键总体呈下降趋势。相比空白鱼糜组,0.2%氯化钙处理后鱼糜凝胶离子键、疏水相互作用和二硫键均有显著提升。化学键含量的上升可能与鱼骨中含有的Ca2+有关,Ca2+可以激活鱼糜中的TGase,促使谷氨酸和赖氨酸残基共价交联,形成ε-(γ-谷氨酰胺)赖氨酸多聚体,从而使离子键含量增加。其次,Ca2+和Cl-可与蛋白质分子上带相反电荷的基团相互作用,减少蛋白质分子间静电相互作用和改变蛋白质构象,引起肌球蛋白和肌动蛋白的游离巯基和疏水基的解折叠和暴露,导致鱼糜凝胶中二硫键和疏水相互作用的形成增强。

表5 纳米鱼骨添加量对鱼糜凝胶化学作用力的影响Table 5 Effects of NFB addition amount on the chemical bonds of surimi gel
2.7 纳米钙复合鱼糜凝胶的SDS-PAGE 分析
由图5可知,肌球蛋白重链(MHC)随纳米鱼骨添加量的增加而呈先减少后增加的趋势,转折点为鱼骨添加量0.75%,其变化趋势与鱼糜凝胶强度变化趋势相一致。由于鱼骨中的低浓度Ca2+对TGase 起激活作用,从而强化TGase 催化反应,促使肌球蛋白重链的谷氨酸(Glu)残基γ-羧基与赖氨酸(Lys)残基ε-氨基之间发生共价交联作用,生成分子内或分子间的ε-(γ-谷氨酰胺) 赖氨酸共价键,生成交叉结合的不溶性蛋白质。较高浓度的Ca2+,促使肌原纤维蛋白的伸展而降低其天然构象,促进蛋白质的变形而抑制氨基酸残基共价交联形成不溶性蛋白。高浓度的Ca2+可与蛋白质侧链上的-COO 相互作用形成分子间的“钙桥”[28]。0.2% CaCl2的MHC 条带宽度接近0.5%纳米鱼骨,与上述鱼糜凝胶强度结果相符。

图5 鱼糜凝胶的SDS-PAGEFig.5 SDS-PAGE patterns of surimi gel
2.8 鱼糜凝胶中蛋白质结构的变化
图6显示了添加不同含量纳米鱼骨和0.2%CaCl2形成的鱼糜凝胶的傅里叶变换红外光谱。在约1 500,1 700 cm-1和2 800~3 500 cm-1处的红外吸收表明蛋白质结构中分别存在酰胺Ⅱ、酰胺Ⅰ和酰胺B&A[29]。酰胺I 区对研究蛋白质二级结构具有重要意义。其二级结构与对应的吸收峰的关系为:1 600~1 639 cm-1附近的红外吸收代表β-折叠结构,1 640~1 650 cm-1代表无规卷曲结构,1 651~1 660 cm-1代表α-螺旋结构[30]。
由图6可知,酰胺A 吸收峰的强度与对照组相比均增强并向低频移动,表明鱼糜凝胶蛋白分子内和分子间氢键的增加。酰胺B 处纳米鱼骨及0.2% CaCl2的吸收峰振幅较对照组有所增强,表明蛋白质的碳-氢拉伸振动增强。此外,在大约1 735 cm-1处观察到的峰值是与鱼糜中残留的脂质相关的碳氧比,这部分对鱼糜凝胶特性起到影响[31]。在酰胺Ⅰ区波束范围内,0.2% CaCl2的红外光谱中在约1 654 cm-1处存在α-螺旋结构,而大部分纳米鱼骨添加组在约1 637 cm-1处存在β-折叠结构,少部分与空白一样存在α-螺旋结构的同时又存在β-折叠结构。含有较高β-片含量的凝胶的机械性能优于含有较多α-螺旋的凝胶,因为β-片的稳定性高于α-螺旋,这与前凝胶强度的结果相一致,各浓度酰胺Ⅱ区吸收峰强度及位置无明显变化。试验结果表明,添加CaCl2或是纳米鱼骨,鱼糜凝胶都具有相似的红外光谱,吸收峰的位置和强度均有显著差异,这表明来自鱼糜凝胶的蛋白质的化学结构受到纳米鱼骨以及CaCl2的影响。
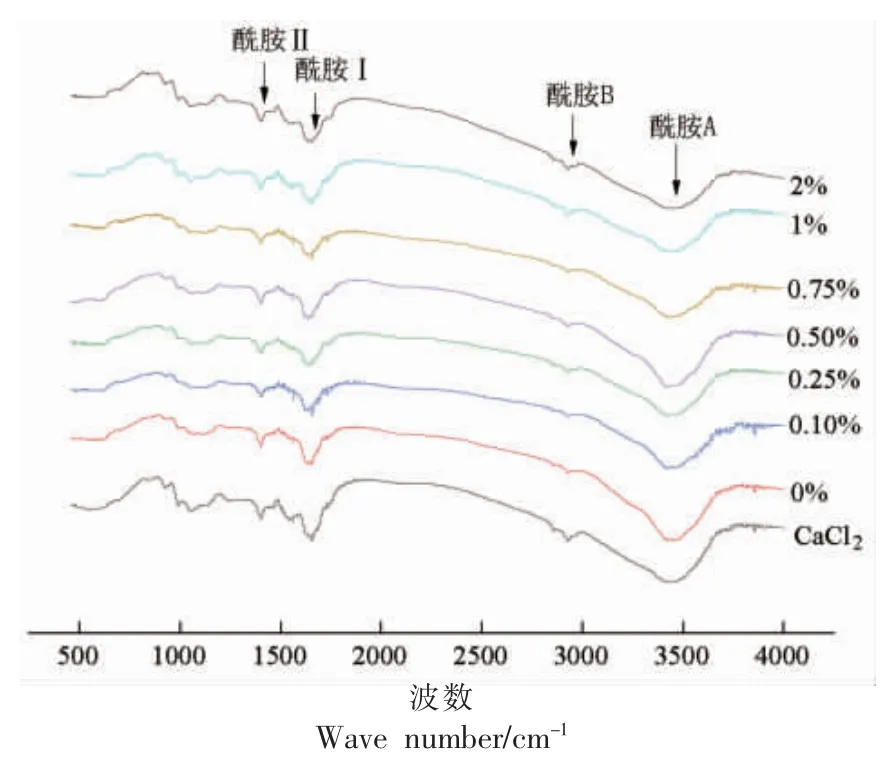
图6 不同纳米鱼骨添加量的鱼糜凝胶蛋白红外谱图Fig.6 FTIR spectra of protein in surimi gel with different NFB addition amount
3 结论
微波辅助制备的金枪鱼纳米鱼骨钙可以提高鱼糜制品的凝胶强度、持水和蛋白分子间化学作用力,并具有更好的质构特性,且对pH 值及白度等指标无明显影响。纳米鱼骨钙亦可以显著改善鱼糜制品的可溶性钙含量,利于人体吸收。相较0.2% CaCl2而言,纳米鱼骨钙对改善鱼糜制品品质有更大优势。傅里叶红外结果表明,鱼糜凝胶蛋白质构象受到纳米鱼骨钙和氯化钙的影响,β-折叠含量增加,形成更致密的蛋白空间三维结构。SDS-PAGE 结果表明,低浓度Ca2+激活内源性TGase,从而强化肌球蛋白的谷氨酸(Glu)残基γ-羧基与赖氨酸(Lys)残基ε-氨基之间的共价交联作用,提高鱼糜凝胶强度。高浓度的Ca2+与蛋白质侧链上的-COO 相互作用形成分子间的 “钙桥”,致使鱼糜凝胶强度下降。本研究可以为后续开发适合儿童和老年人的特殊膳食食品提供重要的数据支撑和研究参考,具有较高的研究意义。

