岩藻多糖对免疫低下小鼠模型免疫功能和肠道菌群的调节作用
黄 娟,黄金莉,孙佳悦,李 瑶,李华军*
(1 大连医科大学微生态学教研室 辽宁大连 116044 2 大连海宝生物技术有限公司 辽宁大连 116044)
海藻是海带、紫菜、裙带菜等海洋藻类的总称,富含蛋白质、多糖、膳食纤维、矿物质等多种营养成分,食药两用,以食为主,是一种理想的天然海洋食品[1]。岩藻多糖(Fucoidan,FUC)又名褐藻糖胶,是从海藻中提取出的一种水溶性多糖,主要由岩藻糖、硫酸盐以及少量的甘露糖、半乳糖和糖醛酸组成[2],具有抗炎,调节机体肠道菌群和免疫应答等多种活性功能,常作为功能性食品应用于食品工业和医药领域[3-4]。
肠道菌群是肠道中数量庞大、结构复杂的微生物群的总称,参与食物的消化吸收与能量代谢[5]。正常情况下,肠道菌群与机体免疫系统处于动态平衡状态,维持着肠道微生态的稳定,对人体健康发挥着重要作用。当菌群数量或种类发生显著变化时,微生态平衡被打破,机体代谢紊乱、免疫失调,促使炎症以及相关代谢和免疫类疾病的发生[6]。肠道菌群的构成不仅与个体基因和环境因素有关,还与日常饮食密切相关。长期食用“不健康”食物(例如过量的红肉)会导致肠道中有害菌的数量大大增加[7],而增加膳食纤维的摄入可抑制肠道中有害菌的繁殖并能增加有益菌的种类和数量[8]。
目前,对岩藻多糖的研究多集中在成分结构、提取工艺以及单一的抗炎抗氧化作用等方面,而对其作为功能食品对肠道菌群的影响以及对机体免疫的调节作用鲜有报道。环磷酰胺是临床常见的抗肿瘤药和免疫抑制剂,它可以抑制免疫球蛋白以及相关细胞因子的产生[9],并对肠道产生一定的损伤[10]。本文以BABL/C 小鼠为实验动物,给小鼠注射环磷酰胺,构建免疫低下模型。同时,灌胃给予免疫低下模型小鼠不同剂量的岩藻多糖水溶液。通过肠道菌群基因高通量测序技术,结合小鼠血清和组织中多种指标的变化,从肠道微生物的角度,揭示岩藻多糖对免疫低下小鼠免疫功能的影响。
1 材料与方法
1.1 主要材料与试剂
岩藻多糖(裙带菜来源),大连海宝生物技术有限公司;环磷酰胺,江苏恒瑞医药股份有限公司;ELISA 试剂盒,江苏酶标生物科技有限公司;Stool DNA Isolation Kit,成都福际生物技术有限公司;流式免疫荧光抗体,博奥森生物技术有限公司;4%多聚甲醛,北京索莱宝科技有限公司;其它化学试剂均为国产分析纯级。
1.2 主要仪器
MAXI-MIX II 涡旋混匀器、MULTIFUGE X1R 低温高速冷冻离心机、MULTSKAN FC 酶标仪,美国Thermo 公司;光学显微镜CX43,日本Olympus 公司;流式细胞仪Calibur,美国BD 公司。
1.3 实验动物及饲料
雄性SPF 级BABL/C 小鼠【6~7 周龄,平均体质量(22±2)g】。实验动物及小鼠基础饲料,均购自大连医科大学动物实验中心。
1.4 试验方法
1.4.1 动物模型建立与分组 实验小鼠在适应实验室环境一周后,随机分为4 组(每组10 只)。从实验第1 天开始,每组小鼠每天灌胃给与相应溶液(不同添加量的岩藻多糖水溶液或生理盐水),连续28 d;从第25 天开始,连续4 d 给小鼠腹腔注射环磷酰胺(正常组除外),具体分组见表1。

表1 实验动物分组Table 1 Group of experimental mouse
1.4.2 体质量与脏器指数检测 实验灌胃开始前一天晚上,给各组小鼠禁食12 h 后称量每组小鼠空腹体质量,计为初始体质量;最后一次灌胃结束后当晚给小鼠禁食12 h,第2 天称量各组小鼠空腹体质量,计为最终体质量。之后,处死小鼠进行组织取材与称重。依据公式:脏器指数=脏器质量(mg)/体质量(g),对小鼠脾脏指数和胸腺指数进行计算与分析。
1.4.3 免疫指标检测
1.4.3.1 脾脏组织病理学分析 取新鲜的小鼠脾脏组织,在4%多聚甲醛溶液中,浸泡过夜。次日,对脾脏组织进行石蜡包埋、连续切片、脱蜡、苏木精-伊红染色、中性树胶封片等试验操作。最后,在光学显微镜下观察各组小鼠脾脏组织形态学变化。
1.4.3.2 脾脏T 淋巴细胞分析 取新鲜脾脏研磨成细胞悬液,镜下计数细胞后洗涤细胞,用APC偶联的抗小鼠CD3 抗体标记脾脏细胞表面抗原,经孵育洗涤后上机检测,用Novo Express 软件对结果进行分析。
1.4.3.3 血清免疫球蛋白、细胞因子及内毒素含量检测 所有动物在最后一次灌胃操作后,禁食12 h。次日,对小鼠进行摘取眼球采血。所有血样在室温下静置60 min,以3 000 r/min 的速度,在低温离心机内离心15 min。后吸取上层淡黄色血清,分装至小试管内。按照试剂盒说明书步骤,采用酶联免疫吸附试验 (Enzyme-linked immunosorbentassay,ELISA) 检测上清中脂多糖(Lipopolysaccharide,LPS),干扰素(IFN)-γ,肿瘤坏死因子(TNF)-α,白介素(IL)-4,免疫球蛋白(Ig)M 和IgG 的质量浓度。
1.4.4 回肠组织病理学分析 取新鲜的小鼠回肠组织,在4%多聚甲醛溶液中,浸泡过夜。次日,对回肠组织进行石蜡包埋、切片、脱蜡、染色、封片等试验操作。最后,在光学显微镜下观察各组小鼠回肠组织结构变化。
1.4.5 肠道菌群分析 试验结束时,在超净台内无菌收集各组小鼠盲肠内容物,放于-80 ℃冰箱保存待用;之后用试剂盒提取小鼠盲肠内容物DNA,进行肠道菌群16S rRNA 基因高通量测序,分析肠道菌群的物种组成以及在门水平与属水平上的变化。
1.5 数据处理与分析
SPSS 22.0 软件被用来分析试验数据,多组间在统计学上的比较,采用单因素方差分析。数据以“平均值±标准差”表示,以P<0.05 为差异具有统计学意义。
2 结果
2.1 岩藻多糖对小鼠体质量和脏器指数的影响
与正常对照组(N)相比较,免疫低下模型组(M)小鼠的体质量、脾脏指数和胸腺指数显著下降(P<0.05)(表2),表明环磷酰胺对小鼠免疫造成了严重损害,成功构建了小鼠免疫低下模型;经岩藻多糖干预后,高剂量(FHM)和低剂量岩藻多糖干预组(FLM)小鼠脾脏指数、胸腺指数与M 组相比均显著上升(P<0.05)(表2),表明岩藻多糖的干预有效缓解了环磷酰胺导致的小鼠脏器指数的降低。

表2 岩藻多糖对小鼠体质量和脏器指数的影响Table 2 Effects of fucoidan on body weight and organ index in mice
2.2 岩藻多糖对小鼠脾脏组织结构的影响
光学显微镜下观察各组小鼠脾脏组织切片(图1),N 组小鼠脾细胞排列紧密有序,细胞核清晰可见;M 组小鼠脾细胞数量明显减少,细胞大小不一、排列稀疏无序;与M 组相比较,FUC 干预后,FLM 和FHM 组小鼠脾细胞数量显著增加,细胞排列整齐,核仁清晰,少间隙,与N 组趋近。

图1 小鼠脾脏组织形态Fig.1 Histomorphology of the spleen tissue in mice
2.3 岩藻多糖对小鼠脾脏T 淋巴细胞的影响
流式细胞术分析结果(图2)显示,与正常对照组(N)相比较,免疫低下模型组(M) CD3+淋巴细胞的表达量大大增加,具有统计学差异(P<0.05);经岩藻多糖干预后,CD3+淋巴细胞数量有下降趋势,且FHM 组与M 组相比显示出明显差异(P<0.05),说明岩藻多糖的干预可下调CD3+淋巴细胞的过度表达。

图2 岩藻多糖对小鼠脾脏CD3+ T 淋巴细胞的影响Fig.2 Effects of FUC on CD3+ T lymphocytes level in mice spleen
2.4 岩藻多糖对小鼠血清中免疫球蛋白、细胞因子以及炎症因子的影响
ELISA 结果 (图3) 显示,M 组小鼠血清中lgM、lgG、IL-4、IFN-γ 水平相较于N 组均明显降低,而TNF-α 和LPS 水平显著升高(P<0.05);经岩藻多糖干预后,FLM、FHM 组血清中lgM、lgG、IL-4、IFN-γ 水平显著增高,TNF-α 和LPS 水平显著下降(P<0.05),说明岩藻多糖可以有效缓解环磷酰胺对小鼠的免疫抑制,减轻炎症,提高免疫低下小鼠的免疫功能。


图3 岩藻多糖对小鼠血清中lgG、lgM、IL-4、IFN-γ、TNF-α、LPS 的影响Fig.3 Effects of FUC on lgG,lgM,IL-4,IFN-γ,TNF-α,LPS content in mice serum
2.5 岩藻多糖对小鼠回肠组织结构的影响
光学显微镜下观察小鼠回肠组织切片 (图4),N 组小鼠肠道黏膜结构完好,肠绒毛完整轮廓清晰可见,排列紧密;与N 组相比,M 组小鼠肠壁损伤、肠绒毛结构被破坏、排列疏松、绒毛高度及隐窝深度均减少;经岩藻多糖干预后,FLM 和FHM 组小鼠肠绒毛形态逐渐恢复栅栏样,且绒毛结构清晰、长度增加,排列紧密。说明岩藻多糖在一定程度上缓解了环磷酰胺对肠黏膜的损害,保护了肠黏膜的完整。
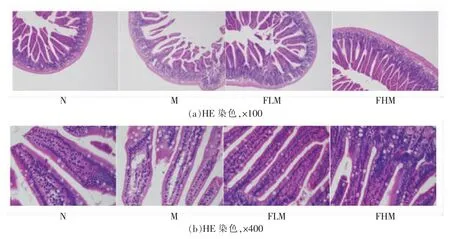
图4 小鼠回肠组织形态Fig.4 Histomorphology of the ileum tissue in mice
2.6 岩藻多糖对小鼠肠道菌群的影响
2.6.1 肠道菌群Alpha 多样性分析 表3反映了各组小鼠肠道菌群在属水平上的物种丰富度和微生物多样性,与N 组相比,M 组Shannon 指数、Simpson 指数、Ace 指数、Chao 指数均没有显发生著变化;FLM 和FHM 组的Shannon 指数、Ace 指数、Simpson 指数、Chao 指数与M 组相比也没有差异,说明岩藻多糖干预对小鼠肠道菌群丰富度与物种多样性没有明显影响。

表3 肠道菌群Alpha 多样性Table 3 Alpha diversity of intestinal flora
2.6.2 肠道菌群Beta 多样性分析 为研究各组小鼠肠道菌群的相似性和差异关系,根据Beta 多样性距离矩阵对各组样本在属水平进行层级聚类分析(图5a),结果显示M 组被聚为一大类,N 组和FLM 与FHM 组被聚为一大类,说明M 组与N组肠道菌群群落结构的差异性较大,在经岩藻多糖干预后缩小了该差异,使得FLM 和FHM 组的群落结构向N 组趋近,与N 组间差异小;PCA(图5b)、PCoA(图5c)、NMDS(图5d)分析显示,N 组和FHM 组距离相近,M 组和FLM 组距离相近,说明FHM 组的肠道菌群组成成分与N 组更相似,FLM 组与M 组更相似,也就是说高剂量的岩藻多糖对紊乱的肠道菌群的恢复作用更好。
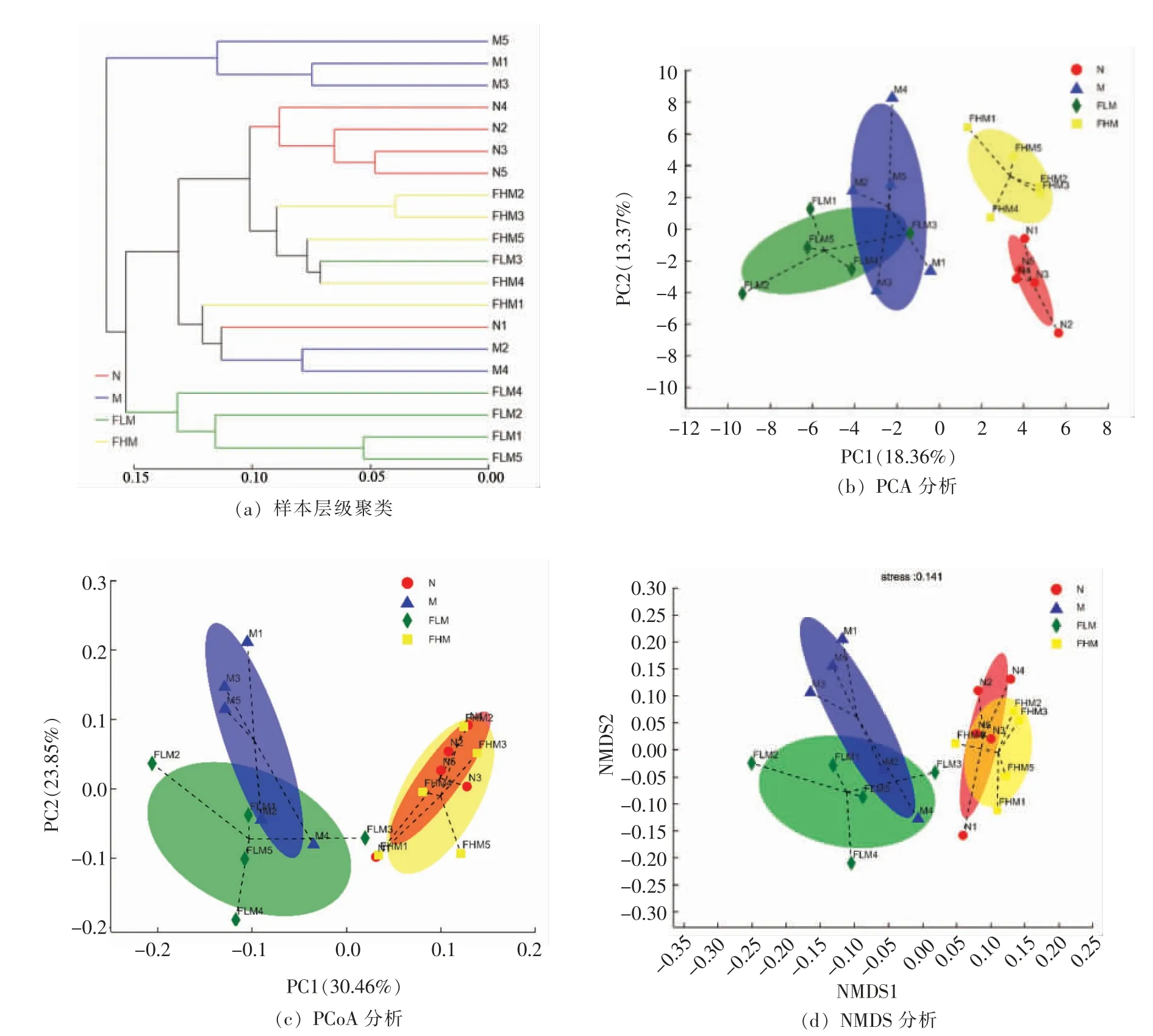
图5 肠道菌群Beta 多样性Fig.5 Beta diversity of intestinal flora
2.6.3 肠道菌群物种组成与差异性分析 在门水平上(图6),与N 组比,M 组的厚壁菌门(Firmicutes) 水平显著降低 (P<0.05),拟杆菌门(Bacteroidota)水平显著升高(P<0.05);与M 组比,FLM组和FHM 组的拟杆菌门水平显著降低(P<0.05),厚壁菌门水平显著升高(P<0.05)。
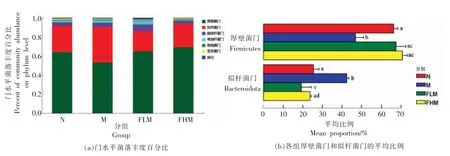
图6 岩藻多糖对小鼠优势菌门相对丰度的影响Fig.6 Effect of FUC on relative abundance of dominant bacterial phyla in mice
在属水平上(图7),与N 组比,M 组的拟杆菌属(Bacteroides)和副拟杆菌属(Parabacteroides)水平显著升高(P<0.05),而乳酸杆菌属(Lactobacillu)和罗斯氏菌属(Roseburia)水平显著降低(P<0.05);与M 组比,FLM 组、FHM 组的拟杆菌属和副拟杆菌属水平显著降低(P<0.05),而乳酸杆菌属和罗斯氏菌属水平显著升高,且FHM 组变化更为明显。


图7 岩藻多糖对小鼠优势菌门相对丰度的影响Fig.7 Effect of FUC on relative abundance of dominant bacterial genera in mice
3 讨论与结论
长期以来,食品和营养一直被认为是影响人们健康最重要的因素,饮食习惯与人类常见的疾病息息相关。最新研究表明,食物成分对机体各种免疫炎症途径的调节至关重要,不健康的饮食会促使炎症的发生,从而导致肠炎、动脉粥样硬化、非酒精性脂肪肝等疾病[11]。此外,食物中含有的多糖、膳食纤维等成分不能被人体直接消化利用,需要在结肠中经由肠道微生物发酵为特定的产物后才能吸收[12]。也就是说,饮食结构的改变影响着肠道菌群的种类和数量。大量的研究报道了岩藻多糖作为一种从海藻中提取的活性物质在体外的免疫活性作用。在体外,岩藻多糖的刺激可增强巨噬细胞的吞噬作用和对抗原提呈加工的能力[13],能激活免疫系统中的细胞毒性T 细胞[14],并促进树突状细胞的成熟[15]。然而,岩藻多糖作为一种功能食品对肠道菌群的调节作用与其免疫活性作用联系的研究却鲜有报道。本文以环磷酰胺诱导的免疫低下小鼠为模型,评价了岩藻多糖在提高机体免疫力和调节肠道菌群方面的功能。
脾脏富含B 细胞和浆细胞,是免疫细胞发生吞噬作用的主要场所,胸腺是T 淋巴细胞发育,分化和成熟的器官[16],胸腺和脾脏的改变,能够反映机体免疫功能的状态。在本实验中,免疫低下模型组小鼠的脾脏和胸腺组织发生严重萎缩,脾脏指数、胸腺指数与正常组相比显著下降,脾脏细胞结构严重被破坏。而岩藻多糖干预组的脾脏和胸腺损伤程度明显减轻,表明岩藻多糖是一种有效的免疫增强剂,可以缓解环磷酰胺对免疫器官的损害。研究表明多糖可以通过促进IgM 和IgG 的产生来增强体液免疫反应的特异性[17]。此外,还有研究指出岩藻多糖可通过调控辅助T 细胞 (T-help cell,Th)的比例,诱导Th17 细胞分化,抑制调节性T 细胞(Regulatory T-cell,Treg)分化,以及增强T、B 细胞的增殖来增强机体免疫[18]。免疫球蛋白(IgM、IgG),由B 细胞分泌,化学结构类似于抗体,具有中和毒素的能力,可被补体激活形成级联抗体-抗原复合物,在体液免疫中发挥起主要作用[19]。IFN-γ 由细胞毒性T 细胞、NK 细胞产生,可介导细胞免疫并促进Th1 细胞的分化和增殖[20]。IL-4 是由Th1、Th2、Treg 细胞和B 细胞产生的有效的抗炎因子[21],参加B 细胞和T 细胞介导的适应性免疫,可促进B 淋巴细胞增殖和相应抗体的产生[22]。本研究发现岩藻多糖不仅可以恢复环磷酰胺降低的lgG 和lgM 的含量,同时也增加了血清中IL-4 和IFN-γ 的水平(与模型组相比),提示岩藻多糖不仅激活了B 淋巴细胞增强了体液免疫,还参与了细胞免疫,调节了T 淋巴细胞的分化,从而刺激细胞因子的分泌。
人的胃肠道黏膜表面有上千种不同的类型的微生物,随着饮食、疾病、环境等因素的变化而改变[23]。相关研究[24-26]报道称环磷酰胺不仅会抑制机体免疫,还会破坏肠黏膜屏障,引起炎症,并使肠道菌群易位。本研究也有相似的结果:模型组小鼠肠道结构破坏严重,血清炎症因子LPS 和TNF-α含量较正常组大大增加,肠道中厚壁菌门数量显著降低,拟杆菌门含量显著升高。但据Shang 等[27]的报道,肠道内大多数分解碳水化合物的细菌很可能不受环磷酰胺的影响,而是与食物中多糖的含量有关,服用岩藻多糖可以降低肠道内大肠肝菌等有害菌的数量,增加或恢复乳酸杆菌的数量,表明多糖可以保护肠黏膜屏障并能通过刺激乳酸杆菌的生长来抑制肠道有害菌,从而降低了炎症性疾病的风险。在本研究中,门水平上,模型组厚壁菌门数量显著降低,拟杆菌门、蓝细菌门以及变形杆菌门数量显著增加,具体到属水平上即乳酸杆菌和罗斯氏菌数量显著降低,拟杆菌和变形杆菌数量显著升高;在岩藻多糖干预后,失调的菌群结构得到很大程度上的恢复,特别是乳酸杆菌的数量得到大大的增加。与此同时,干预组的血清中LPS 和TNF-α 的含量也明显下降,LPS 和TNF-α的高低反映机体的炎症状态[28],这更加有力地说明了岩藻多糖可以通过调节肠道菌群的结构,增加有益菌的数量并减少有害菌的数量来缓解肠道炎症。
综上所述,岩藻多糖可通过增加免疫球蛋白和细胞因子的分泌,减少炎症因子的产生,从而提高免疫低下小鼠的免疫功能,并能有效缓解环磷酰胺造成的免疫器官和肠黏膜损伤,作用机制可能与其对肠道菌群的调节作用有关。

