灵芝多糖辅助DNA疫苗对小鼠肿瘤免疫治疗的影响
刘 洋,陈会英,2*,范雪枫,李佳琪,朱 桐,张树彪,2
(1 大连民族大学生命科学学院 辽宁大连 116600 2 大连民族大学 生物技术与资源利用教育部重点实验室 辽宁大连 116600)
肿瘤是威胁人类生命的主要疾病,近年来发病率呈上升趋势。目前常用治疗方式(手术、化疗、放疗)存在复发和转移等问题,亟待寻求新的技术提高肿瘤治疗水平[1]。随着2017年首个针对血液肿瘤的免疫疗法获得美国FDA 批准,免疫疗法作为一种革新性的医疗手段,已成为最具市场潜力的肿瘤精准治疗方式[2-3]。肿瘤DNA 疫苗通过呈递亚单位肿瘤抗原刺激患者免疫应答,增强机体抗癌能力,达到预防肿瘤或者控制清除现有肿瘤的目的[4]。由于其包含的抗原具有高度限定性,能够以低的反应原性诱导集中的特异性反应,因此,肿瘤DNA 疫苗已成为肿瘤科研工作人员研究的热点之一。尽管如此,由于DNA 亚单位抗原固有的免疫触发缺陷,在临床前肿瘤模型中,DNA 疫苗的治疗效果仍然有待提高。
多糖作为一类由多个单糖分子通过糖苷键连接而成的天然高分子化合物,是构成生命的四大基本物质之一。研究表明,具有免疫调节活性的多糖,能够辅助性增强疫苗的免疫活性[5]。灵芝多糖具有广泛的生物活性,其中免疫调节活性被认为是最重要的生物活性[6-8]。由于多糖结构复杂,不同部位提取的多糖存在活性差异,因此本研究以怒江灵芝为例,利用苯酚-硫酸法[9]提取其菌托、菌柄、菌盖等不同部位多糖,考察各部位提取物对小鼠的免疫活性调节作用,筛选具有显著免疫促进功能的多糖,研究灵芝多糖作为助剂在荷瘤小鼠动物模型中对DNA 疫苗的免疫治疗促进功能,为提升DNA 等核酸疫苗的免疫治疗效果提供参考。
1 材料与方法
1.1 材料与仪器
怒江灵芝湿品,泸水怒丰生物科技有限公司;苯酚、浓硫酸、无水乙醇,购自国药集团化学试剂有限公司,均为分析纯级;葡聚糖标准品,阿拉丁试剂有限公司;Balb/c 雌性小鼠(清洁级),体质量18~22 g,北京维通利华实验动物技术有限公司(实验动物研究及使用计划编号P2021011);环磷酰胺,上海宝生物科技有限公司;苏木素伊红(HE) 染色试剂盒,北京索莱宝生物科技有限公司;4T1 细胞,中科院细胞库;1640 完全培养基,碧云天生物技术有限公司;ELISA 试剂盒、CD3+、CD4+、CD8+、INF-γ 荧光标记抗体,大连万泽贸易有限公司;HER2/neu 质粒DNA 疫苗,苏州泓迅生物科技股份有限公司。
JA3003N 型电子天平,上海精密科学仪器有限公司;UV-2800 型紫外-可见分光光度计、IR Prestige-21 红外光谱仪,岛津公司;HH-4 型数显恒温水浴锅,国华电器有限公司;3111 细胞培养箱,Thermo 公司;680 酶标仪,Bio-Rad 公司;旋转蒸发仪,上海亚荣生化仪器;IX73 荧光显微镜,奥林巴斯株式会社。BC-30 全自动血细胞分析仪,深圳迈瑞生物医疗电子股份有限公司;1260 Infinity II 凝胶渗透色谱仪,安捷伦科技有限公司。
1.2 试验方法
1.2.1 灵芝多糖提取和分析 准确称取怒江灵芝湿品菌盖、菌柄、菌托各2 g,粉碎机粉碎后,沸水浴煎煮2~4 h,冷却后定容至100 mL,过滤,冻干。用10 mL 80%乙醇洗涤沉淀3 次,将沉淀配制成体积分数5%的水溶液并进行反复冻融,初步去除蛋白,配制Sevag 溶液,与糖溶液以体积比2∶1 的比例混合,回收糖溶液,重复此操作直至中间层无蛋白析出,最后将糖溶液装于3 500 u 的透析袋中,流水透析24 h,去除葡萄糖、无机盐等小分子杂质,采用DEAE cellulose-52 离子交换柱(4.5 cm×80 cm) 和Sephadex G-100 凝胶柱(2.6 cm×100 cm)进行分离、冻干[6]。取1/10 份冻干粉,用10 mL 2 mol/L 硫酸溶解后,加水定容至50 mL,采用1 mL 体积分数4%苯酚溶液和5 mL 浓硫酸,以葡聚糖为标准品配置标准溶液,参照文献[9]的方法,计算多糖含量。采用TSKPWXL 4 000 凝胶色谱 柱,以0.3 mol/L 的NaNO3和0.1 mol/L 的NaH2PO3(pH 7.0)为流动相,激光光散射检测器和示差检测器测定多糖分子质量。KBr 压片法在400~4 500cm-1波长范围内进行傅里叶红外光谱测定。
1.2.2 灵芝多糖免疫功能促进作用考察
1.2.2.1 免疫抑制小鼠模型建立 选取4 周龄体质量约20 g 的Balb/c 雌性小鼠,随机分为空白组、模型组、盖多糖组、柄多糖组、托多糖组共5组,每组10 只。除空白组外,所有组小鼠均连续3 d 腹腔注射环磷酰胺0.2 mL(8 mg/mL),构建免疫抑制小鼠模型。空白组灌胃等体积(剂量为每千克体质量10 mL)纯净水;模型组灌胃等体积纯净水;盖多糖组、柄多糖组、托多糖组分别灌胃等体积怒江灵芝湿品菌盖、菌柄和菌托多糖提取物(200 mg/kg)。持续灌胃28 d。
1.2.2.2 体质量和免疫器官指数测定 处死小鼠前,称取小鼠体质量;处死小鼠后,半小时内无菌取出脾脏和胸腺,根据公式(1)和(2)考察免疫器官指数。

1.2.2.3 单核-巨噬细胞功能测定 随机抽取小鼠,每组5 只,持续灌胃25 d 后,腹腔注射60 mg/mL 淀粉肉汤1 mL;灌胃结束后第2 天,腹腔注射鸡红细胞生理盐水悬液 (V鸡红细胞∶V生理盐水=1∶200)1 mL。半小时后,处死小鼠,取50 μL 腹腔液,滴于清洁的载玻片上,湿盘内37 ℃孵育30 min后,取出载玻片,用预温的生理盐水漂洗3 次,干燥5 min,瑞吉染色,显微镜观察并计数,考察巨噬细胞吞噬指数,计算公式如下:

1.2.2.4 淋巴细胞免疫功能测定
1)淋巴细胞增殖能力测定 无菌取脾,置于RPMI-1640 培养液中,研磨为匀浆,网筛(200 目)后收集滤液,离心15 min(1 000 r/min),弃上清,加入4 mL 红细胞裂解液,冰浴10 min 后离心5 min(1 000 r/min),弃上清,RPMI-1640 培养液洗涤2 次,加入5 mL RPMI-1640 培养液(含10%胎牛血清),调节细胞浓度为2×106个/mL。在96 孔板中按照每孔100 μL 接种该细胞悬液,分别加入5 μL 的刀豆蛋白(ConA,5 μg/mL)或脂多糖(LPS,10 μg/mL),37 ℃、5% CO2条件下培养48 h,采用MTT 法[10]测定ConA 活化的T 细胞和LPS 活化的B 细胞的增殖性能。
2)NK 细胞杀伤活性测定 以小鼠脾细胞悬液(2×106/mL,含NK 细胞)为效应细胞,以肿瘤细胞(YAC-1,2×105/mL)为靶细胞。效靶细胞杀伤试验孔分别加入100 μL 效应细胞和100 μL 靶细胞;效应细胞自发释放孔加入100 μL 效应细胞和100 μL 培养液;靶细胞自发释放孔加入100 μL 靶细胞和100 μL 培养液。分别于37 ℃,5% CO2培养箱中孵育48 h,采用MTT 法测定吸光度值(OD),并计算NK 细胞杀伤活性(4)。


3)体液免疫功能测定 每组剩余5 只小鼠断颈处死后采血,分离出血清,采用ELISA 试剂盒测定小鼠血清白细胞介素2(IL-2),白细胞介素6(IL-6),肿瘤坏死因子α(TNF-α)和免疫球蛋白G(IgG)含量,所有操作均严格按照试剂盒说明书进行。
1.2.3 灵芝多糖辅助DNA 疫苗的小鼠肿瘤免疫治疗效果评价 选取4 周龄体质量约20 g 的Balb/c 雌性小鼠,皮下注射4T1 细胞,构建荷4T1瘤小鼠模型。瘤体积长到约100 mm3后,随机分为对照组、DNA 疫苗组、灵芝菌盖多糖组进行研究,每组5 只。DNA 疫苗组分别在0 d 和14 d 以30 mg/kg 皮下注射DNA 疫苗进行免疫。灵芝菌盖多糖组在进行DNA 疫苗皮下注射免疫2 次之前,使用30 mg/kg 免疫增强效果显著的灵芝多糖连续喂食3 d。观察21 d,检测小鼠体质量和瘤体大小。断颈处死小鼠,快速取出脾脏,置固定液中固定24 h,水洗、乙醇脱水、二甲苯透明,石蜡包埋,切片(片厚4~6 μm),经HE 染色后在显微镜下观察脾脏组织形态变化。收集不同组小鼠脾脏单细胞悬液,采用CD3+、CD4+、CD8+流式抗体进行标记,采用流式细胞仪测定T 细胞及亚群;将细胞固定,破膜,然后用IFN-γ 抗体标记细胞,在荧光显微镜上进一步分析细胞CD4+、CD8+亚型。
1.3 数据处理
利用SPSS 17.0 统计学软件进行试验数据分析。分析结果均以平均数±标准差(±s)表示。比较采用单因素方差分析(One Way ANOVA)。方差齐性采用Levene 检验,若方差齐,采用最小显著性差异法(LSD)进行多重比较,若方差不齐,采用保守成对比较检验法(Tamhane's T2)或最大t值成对比较检验法(Dunnett's T3)进行多重比较。如果P<0.05,表示试验结果具有统计学差异显著性意义,P<0.01 则表示试验结果具有统计学差异极显著性意义。
2 结果与讨论
2.1 灵芝盖、柄、托多糖含量和结构分析
采用葡聚糖为标准品,根据波长485 nm 处的吸光度值,绘制标准曲线(R2=0.994),测得怒江灵芝样品中菌盖、菌柄、菌托多糖百分含量分别为2.95%,1.81%和1.61%,说明灵芝菌盖部位多糖含量高于菌柄和菌托。经GPC 测定,平均分子质量分别为1.84×104(PI=1.13),1.92×104(PI=1.22),2.07×104u(PI=1.17),结果详见表1。

表1 灵芝湿品中多糖质量分数及分子质量测定结果Table 1 Determination results of mass concentration and molecular weight of polysaccharides in Ganoderma lucidum wet products
怒江灵芝盖、柄、托多糖的红外光谱测定结果见图1。从多糖红外光谱可看出,在3 419,2 920,2 852 cm-1和1 638 cm-1处存在-OH 伸缩振动吸收峰、C-H 伸缩振动吸收峰和-OH 的弯曲振动吸收峰,在1 421,1 374,1 175 cm-1处存在CH2的变形吸收峰和1 316 cm-1处C-H 弯曲振动吸收峰以及环上C-O 吸收峰。1 070 cm-1处的吸收峰是醇-OH 的变角振动一起的。1 266 cm-1和1 269 cm-1处吸收峰是由于-COOH 中C=O 的对称伸缩振动引起的,表明灵芝多糖含有-COOH 基团;在522,528 cm-1处的吸收峰是CCO 变形振动[11]。盖部多糖在896 cm-1处强的特征吸收峰,说明盖多糖主要为β-吡喃糖苷键多糖[12]。柄多糖和托多糖β-吡喃糖苷键多糖则逐渐减少。图1结果表明,灵芝盖、柄、托多糖存在结构差异。
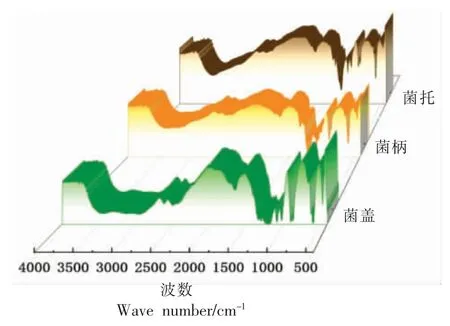
图1 灵芝菌盖、菌柄、菌托多糖红外谱图Fig.1 Infrared spectrum of polysaccharide in pleat,stem and cap of Ganoderma lucidum
2.2 灵芝盖、柄、托多糖对小鼠的免疫促进作用
采用怒江灵芝多糖提取物喂食免疫抑制小鼠,记录小鼠体质量,结果见表2。环磷酰胺处理的免疫抑制模型组小鼠净体质量低于空白组,而多糖组高于模型组和空白组,且盖部多糖组小鼠体质量高于托、柄多糖组。免疫器官指数是反映免疫功能的重要指标[13],表2给出的脾脏指数和胸腺指数的计算结果表明,多糖组脾脏指数和胸腺指数高于空白组,而环磷酰胺处理的免疫抑制模型组脾脏指数和胸腺指数则低于空白对照组,盖多糖组表现出更加明显的免疫器官指数增强。该实验结果表明,怒江灵芝盖多糖具有改善小鼠免疫功能的潜在价值。
鸡红细胞吞噬结果表明(表2),与模型组相比,盖多糖组小鼠腹腔巨噬细胞的吞噬指数增加,且高于柄、托多糖组。淋巴细胞增殖作用考察结果见表3中,灵芝盖、柄、托多糖对ConA 活化的T淋巴细胞的促增殖作用均较弱,而对LPS 活化的B 淋巴细胞的促增殖作用较强,且盖多糖组作用最为显著。相对于柄、托多糖组,盖多糖组脾NK细胞活性明显增加,与空白组相比,差异有统计学意义(P<0.05)。细胞因子IL-2、IL-6、IgG 及TNFα 测定结果(表4)表明,与模型组相比,盖多糖组细胞因子分泌增加。表2、3 和4 的实验结果说明灵芝盖多糖具有免疫增强功能。

表2 灵芝多糖对小鼠净体质量、脾脏指数、胸腺指数和吞噬指数的影响(n=5)Table 2 Effects of Ganoderma lucidum polysaccharides on body weight,spleen index,thymus index and phagocytosis index of mice (n=5)

表3 灵芝多糖对小鼠淋巴细胞增殖和NK 细胞活力的影响(n=5)Table 3 Effects of Ganoderma lucidum polysaccharides on lymphocyte proliferation and NK cell activity in mice (n=5)

表4 灵芝多糖对血清细胞因子的影响(n=5,pg/mL)Table 4 Effects of Ganoderma lucidum polysaccharides on serum cytokines (n=5,pg/mL)
2.3 灵芝多糖辅助DNA 疫苗对荷瘤小鼠的免疫治疗效果
DNA 疫苗具有较高的安全性和经济性,虽在肿瘤的免疫治疗中被广泛研究,但尚未临床应用,助剂有助于提高其免疫治疗效果[14],有望进一步推动临床转化。表皮生长因子受体2(HER2)是具有酪氨酸激酶活性的跨膜蛋白,在多种肿瘤细胞表面过表达,是一种重要的肿瘤基因标志物和常用的分子治疗靶点。约20%~30%的乳腺癌病例存在HER2 基因扩增,影响乳腺癌的侵袭、转移和复发,导致预后不良。赫赛汀是一种单克隆抗体药物,通过抗HER2 分子靶向免疫治疗,极大改善了HER2+乳腺癌病人的预后,是目前HER2+乳腺癌治疗的首选。然而,赫赛汀的原发、继发耐药成为HER2+乳腺癌治疗的瓶颈。本研究尝试利用HER2 重组DNA 疫苗,选取免疫增强效果显著的灵芝菌盖多糖,以4T1 荷瘤小鼠为动物模型,考察灵芝多糖辅助DNA 疫苗的肿瘤免疫治疗效果。
疫苗组和灵芝菌盖多糖组小鼠接种疫苗后,精神状态良好,进食和活动正常,局部注射部位无硬结、出血或溃烂情况,无死亡。纪录各组21 d 小鼠体质量变化曲线和肿瘤生长曲线,结果见图2。对照组小鼠体质量增加不到3%;疫苗组小鼠在第9 天以后体质量开始明显增加,21 d 后体质量增加约13%。灵芝盖多糖组在6 d 后体质量显著增加,21 d 时体重增率约18%。肿瘤生长曲线结果表明,对照组肿瘤增长最快,21 d 后肿瘤体积超过700 mm3,灵芝盖多糖组抑瘤效果最明显,且生长缓慢,21 d 后肿瘤体积约300 mm3,显著小于对照组,与疫苗组相比,增长速度也显著降低。各组的抑瘤效果表明,灵芝盖多糖具有较为显著的促进作用。

图2 疫苗和灵芝多糖辅助疫苗对4T1 肿瘤的免疫治疗效果Fig.2 Immunotherapeutic effects of vaccine and Ganoderma lucidum polysaccharide adjuvant vaccine on 4T1 tumor bearing mice
采用鼠抗小鼠CD3、CD4、CD8 的单克隆抗体,经间接免疫荧光染色,利用流式细胞仪检测总T 细胞和诱导性T 细胞及抑制性T 细胞亚群。检测结果表明,与对照组相比,疫苗组和灵芝盖多糖组能够有效促进CD3+CD4+、CD3+CD8+细胞的扩增。尤其是灵芝盖多糖组,CD3+CD4+、CD3+CD8+T细胞比率分别增加了9.8 倍和4.3 倍,CD4+/CD8+比例明显升高,该实验结果表明机体细胞免疫性能增加[15]。由于CD4+和CD8+T 细胞具有免疫激活功能的细胞亚型主要分泌INF-γ 细胞因子,因此采用INF-γ 抗体进行双标记,确定CD4+和CD8+细胞亚型,根据荧光统计计数确定亚型含量(图3),该结果表明具有免疫促进功能的Th1 亚型CD4+T 细胞和Tc1 亚型CD8+细胞数量占绝对优势,并且与疫苗对照组相比,在两次疫苗免疫前喂食不同剂量灵芝盖多糖,显著增加Th1 亚型CD4+T 细胞和Tc1 亚型CD8+细胞,说明灵芝多糖辅助疫苗促进了机体免疫功能[16]。

图3 荷瘤小鼠脾脏淋巴细胞测定结果(n=5)Fig.3 Spleen lymphocyte evaluation of tumor bearing mice (n=5)
免疫器官是免疫系统的重要组成部分,脾脏是十分重要的外周免疫器官,是免疫细胞居住和产生应答的部位[17]。H&E 染色是通过观察各种组织和细胞形态结构特点进行病变判断和研究的重要手段[18]。对脾脏进行HE 染色处理,利用显微镜进行观察,考察灵芝盖多糖组小鼠的脾脏组织形态,进一步分析灵芝盖多糖辅助DNA 疫苗的免疫促进作用,结果见图4。图4a 模型组脾脏红、白髓分界模糊、红髓相对较少,脾小体形态结构不完整,脾小体出现黏连、周围边缘区域不完整。灵芝盖多糖组(图4c),脾脏结构变得清晰,红髓增加,脾小体结构完整,黏连减少,脾脏改善效果优于DNA 疫苗组。该结果表明,灵芝多糖具有促进DNA 疫苗免疫增强的作用。
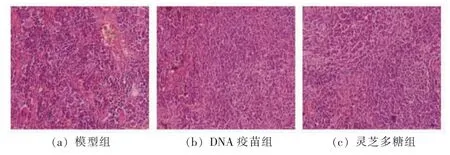
图4 脾脏H&E 染色的代表性结果Fig.4 Representative results of H&E staining of spleen
3 结论
相对传统疫苗而言,DNA 等核酸疫苗具有设计方便、安全性好等优点,是肿瘤治疗的前沿技术。然而,DNA 疫苗在临床过程中免疫应答效率尚不足。本研究提取分离了灵芝盖、柄、托各部位多糖,发现多糖结构和分子质量存在差异,盖多糖分子质量最小,对小鼠的免疫增强最大。因此,选取灵芝盖多糖作为辅助试剂,在HER2/neu 质粒DNA 首次免疫之前,喂食小鼠3 d 后,DNA 疫苗体液免疫指标和细胞免疫指标均有明显的提升,小鼠体质量略有增加、肿瘤体积减小,说明肿瘤生长被抑制,T 细胞表型和亚型分析结果表明,灵芝多糖进一步促进了疫苗的细胞免疫和体液免疫功能。该结果表明,灵芝盖多糖能促进小鼠对HER2/neu 质粒DNA 疫苗的免疫应答,本研究将为新型DNA 疫苗助剂的开发提供一定的理论参考。

