增龄相关肌少性肥胖的生物信息学分析
付婉瑞,古再丽努尔·卡德尔,冯颖
复旦大学附属华东医院营养科,上海 200040
全球人口老龄化正在加剧。据联合国《世界人口展望(2019)》报告,预计2050年,全球65 岁以上和80岁以上人口将分别占总人口的16%和5%;而中国65岁以上人口接近总人口的30%。老年人数量的急剧增加,使增龄相关健康问题得到了越来越多的关注,包括因增龄相引起的身体成分变化,如骨量和肌肉量下降、脂肪量增加等。肌肉减少症(Sarcopenia),简称“肌少症”,是指与年龄相关的肌肉质量和力量下降,可能合并躯体功能的衰退[1]。据报道,在全球60 ~70岁人群中,肌少症的患病率为5%~13%,而80 岁及以上人群中,患病率可增至50%[2]。相较于老年人骨骼肌质量的增龄性下降,有研究发现,75 岁前体重和体质量指数(body mass index,BMI)通常表现为增加,且多在稳定一段时间后才开始下降[3],这是因为骨骼肌质量的下降常伴随着脂肪量的增加,超重和肥胖可掩盖肌少症的早期变化[4]。进一步研究发现,肌少症和肥胖具有多种重叠的病因和反馈机制,且二者间具有协同作用[5]。由此,肌少性肥胖(Sarcopenic Obesity,SO)用以描述肌少症与肥胖共存的状态[6]。目前,SO的诊断标准尚未达成共识,故其流行病学尚不清楚;虽有多项SO 患病率的调研[7],但患病率估计值存在较多差异,从0%至41%,多见于老年人群。众所周知,肌少症患者发生不良结局的风险可显著增加,包括跌倒、残疾、住院和死亡;而肌少症在肥胖患者中最容易被忽视,SO 发生不良结局的风险更大;但肌少症和肥胖都存在一定的可逆性,及早诊治可大大降低发生不良结局的风险。
SO 的病因复杂,发病机制目前尚不清楚,造成了治疗上的困难。寻找同时调控增龄、肌少症与肥胖的靶点途径,可使治疗事半功倍。本研究利用生物信息学方法对多组分子生物信息数据进行整合分析,旨在探讨SO 的发病机制与可能的治疗靶点,为增龄相关SO 的诊断和治疗提供依据。
1 材料与方法
1.1 材料
本研究分别以“Aging”、“Sarcopenia”、“Obesity”在NCBI 数据库(https:/ /www.ncbi.nlm.nih.gov/gene)、 GeneCards 数据库(https:/ /www.genecards.org)、 Disgenet 数据库(https:/ /www.disgenet.org/)、OMIM 数据库(https:/ /www.omim.org/)进行检索,将结果分别进行汇总、去重,即得到该疾病的靶点基因,将以上三部分结果取交集之后便获得Aging-Sarcopenia-Obesity 共同的靶点基因。
1.2 方法
1.2.1 靶点基因功能注释及通路富集分析本研究将靶点基因输入DAVID 生物信息数据库(2021 Update) ( https:/ /david.ncifcrf.gov/home.jsp)在线工具进行分析,并进行基因本体论(Gene Ontology,GO)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)的富集分析,结果筛选以P<0.01、 FDR <0.01 同时通路富集基因数>3 为标准,GO 富集分析分为三个方面,分别是:分子功能(Molecular Function,MF)、生物学过程(Biological Process,BP) 和细胞组分(Cell Component,CC)。
1.2.2 蛋白质相互作用网络及关键基因的获取本研究将靶点基因输入STRINGv11.5 数据库(https:/ /cn.string-db.org/)分析基因调控的蛋白质相互作用(Protein-Protein Interaction,PPI),将最低互作分值设置为置信度>0.9(最高置信度),并且隐藏独立靶点。将结果导入Cytoscape 软件v3.7.1 进行PPI 网络可视化分析,再利用Cytohubba 插件计算各基因的节点值,保留节点值≥12 的结果,然后使用MCODE 插件对PPI 网络进行子网络模块分析。
1.2.3 预测靶点基因相关miRNAs 本研究使用ToppGene 数据库(https:/ /toppgene.cchmc.org/)检索靶向所有共同靶点基因的miRNAs。参数设定:(1)Correction:FDR;(2) P-Value cut off:0.05;(3)GeneLimts:1≤n≤2 000;(4)Source:miRTarbase。
2 结果
2.1 共同靶点基因的获取
使用“Aging”、“Sarcopenia”、“Obesity”作为关键词,物种选择为“9606”(Homo Sapiens,智人)进行搜索,在NCBI 数据库中分别得到1 033、54、2 056 个结果,在GeneCards 数据库中分别得到26 415、266、9 227个结果,在Disgenet 数据库中分别得到1、164、2 821 个结果、在OMIM 数据库中分别得到364、8、317 个结果;将各部分的靶点基因进行汇总,去重,分别得到26 400、1 279、9 745 个结果;将各部分汇总结果取交集,得到984 个共同调节Aging-Sarcopenia-Obesity 的靶点基因,使用jvenn(http:/ /jvenn.toulouse.inra.fr/app/example.html)进行结果可视化。见图1。
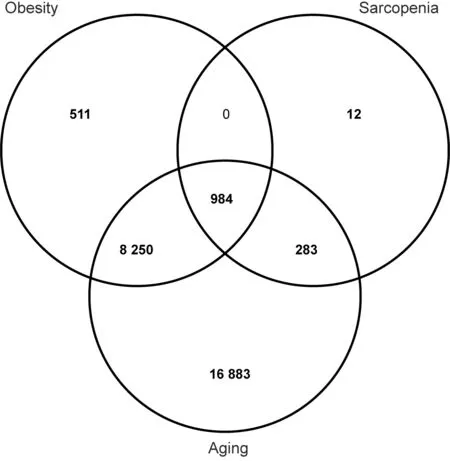
图1 Aging-Sarcopenia-Obesity 共同靶点基因的韦恩图
2.2 对共同靶点基因进行GO 富集和KEGG 分析
利用DAVID 生物信息数据库(2021 Update)对靶点基因分别进行GO 和pathway 分析。结果如图2 所示,GO 富集分析发现,靶基因的分子功能主要涉及蛋白结合等;生物学过程主要涉及增龄、药物应答以及缺氧应答等;细胞组分主要定位在胞浆、外泌体和细胞外等,KEGG 分析显示,靶点基因主要与肿瘤、PI3K-Akt 信号通路、肿瘤miRNAs 等通路有关。

图2 GO 和KEGG 分析
2.3 对共同靶点基因进行PPI 网络模块分析
本研究的PPI 分析共得到725 个蛋白6 854 对关系(图3)。将结果导入Cytoscape 软件并用Cytohubba插件计算出各基因的节点值(Degree),筛选得到节点值≥12 的基因357 个(图4)。其中,TP53、EP300、STAT3等基因的节点值最大,说明其在该网络中起着重要作用。此外,使用MCODE 插件构建及筛选具有统计学差异的子网络模块。结果显示,显著性最高的4 个模块为IL-6/STAT3、TP53、RELA(NF-κB 家族成员之一)、EP300网络(图5,score 得分越高,代表该子网络模块的作用越关键),各模块中的基因名称见表1。

图5 PPI 网络图中的子网络模块
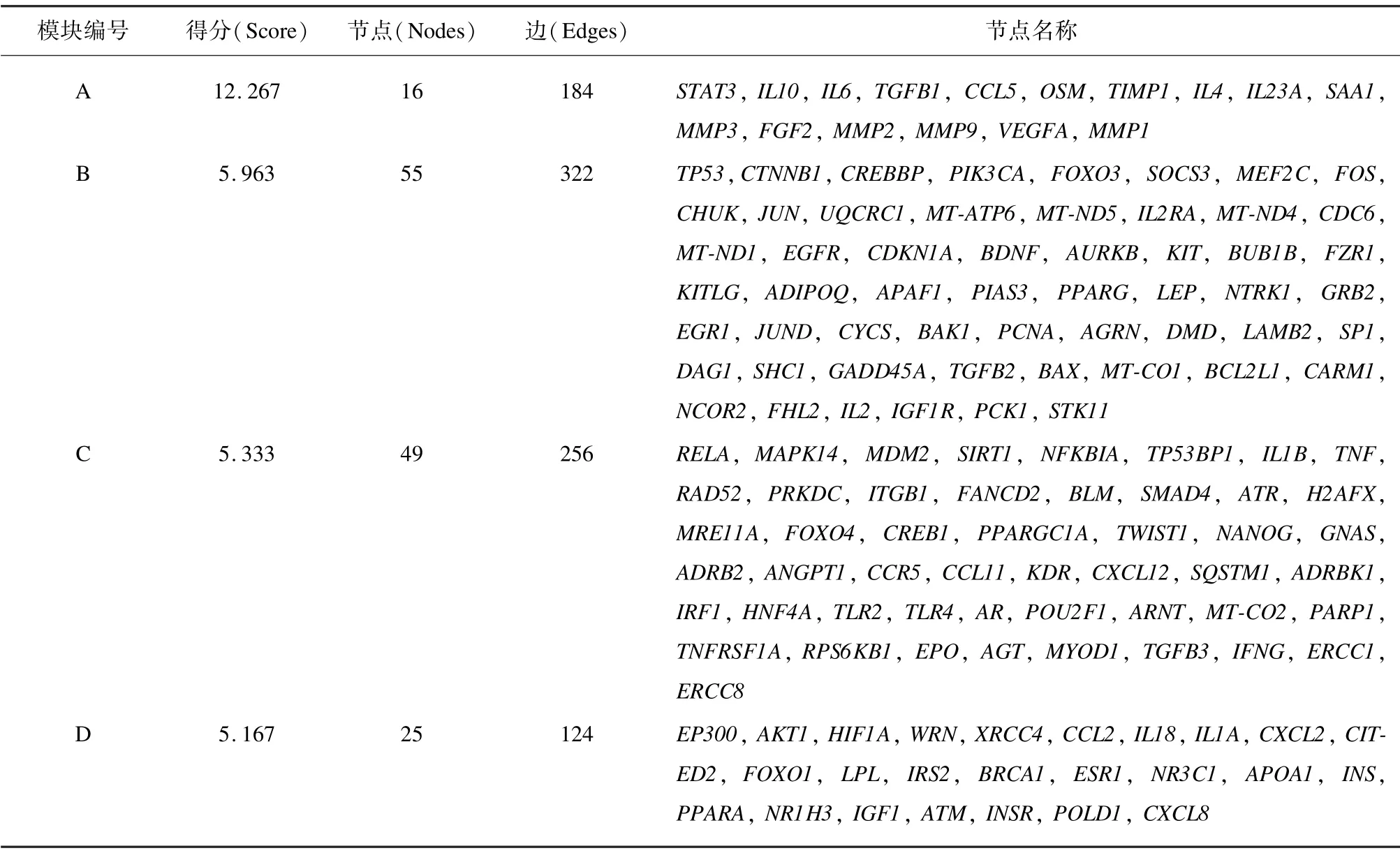
表1 子网络模块的分析结果
2.4 对共同靶点基因进行miRNAs 预测分析
使用ToppGene 数据库预测miRNAs 的结果见表2(仅列出P值最小的前10 个结果)。本研究结果显示miR-26b-5p、 miR-155-5p、 miR-34a-5p 等miRNAs 最有可能影响增龄相关肌少性肥胖的疾病进程。
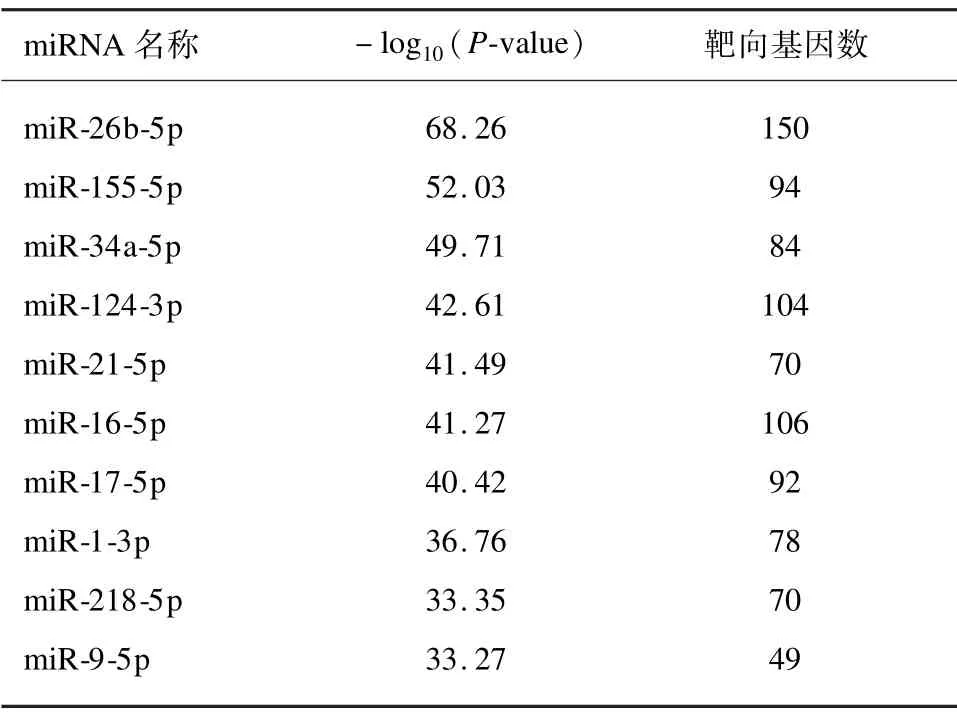
表2 miRNA 的预测结果
3 讨论
衰老的九大特征之一便是细胞衰老,代表着细胞增殖(生长)的不可逆终止,同时伴随多种表型变化,如释放许多生物活性分子:促炎细胞因子,趋化因子,生长调节因子,血管生成因子,蛋白酶,生物活性脂质,细胞外基质成分和基质金属蛋白酶(Matrix Metalloproteinases,MMP),统称为衰老相关分泌表型(Senescence-Associated Secretory Phenotype,SASP)[7-9]。在衰老过程中,脂肪炎症导致脂肪重新分布到腹腔内区域(内脏脂肪)和浸润到骨骼肌,脂质及其衍生物在肌肉细胞内和细胞间积聚,诱导线粒体功能障碍,干扰脂肪酸的β 氧化,增强活性氧(Reactive Oxygen Species,ROS)的产生,导致脂质毒性和胰岛素抵抗,进一步增强促炎细胞因子的分泌。反过来,肌肉分泌的细胞因子可能会加剧脂肪组织萎缩,维持慢性低度炎症,并导致局部高脂血症,胰岛素抵抗和全身性炎症的恶性循环,从而促进SO 的发展[10]。到目前为止,尽管有大量的研究探讨骨骼肌与脂肪的关系,SO 发病机制仍未阐述清楚。
近年来,由于高通量生物技术的快速发展,从分子水平到临床层面产生的生物医学数据呈爆发增长,伴随而来的还有数以千计的生物信息数据库。这些数据库基本可以分为一次数据库和二次数据库两类,一次数据库主要归类整理了实验室的原始数据,而二次数据库主要依照特定物种、特定目的收集整理数据,其专业性更强,操作门槛更低,可以帮助更多的非计算机专业的研究者进行生物信息学分析。目前,以生信分析为目的构建的数据整合平台层出不穷,使生信分析变得更加简便,为解读基因信息、探究疾病机制、进行药物设计提供了巨大帮助,促进了当今生物医学和生物信息学的蓬勃发展。例如,DAVID 生物信息数据库是最常用最权威的基因功能注释工具之一,用于分析基因背后的生物学意义; STRING 数据库是拥有蛋白质相互作用信息最大的数据库之一。
本研究通过生物信息学技术,探讨增龄相关性肌少症和肥胖可能的共同发病机制。通过查询四大数据库,本研究共找到984 个调节增龄、肌少症、肥胖的靶基因。分析结果显示,增龄相关的细胞间通讯改变在SO 中发挥重要作用。
P53,由TP53 基因编码的蛋白,是众所周知的“基因组守护者”,可以通过几种不同的翻译后修饰机制(磷酸化、甲基化、乙酰化等)在细胞衰老中发挥关键作用。EP300 基因编码的P300 蛋白,是最广为人知的与P53 乙酰化相关的组蛋白乙酰转移酶之一。P53 和P300 在肌细胞行使正常功能中不可或缺,同时参与调节脂肪酸降解、脂质合成以及脂肪分化[11-14]。最新研究发现,当TP53 基因发生G 等位基因突变时,SO 患病风险增加[15]。
P53 和P300 除直接调控细胞的增殖分化与代谢外,还参与调节SASP。总所周知,白细胞介素6(Interleukin-6,IL-6)是SASP 主要成分之一,它在正常衰老过程中的表达增加,是衰老的加速器。IL-6 表达受到核因子Kappa B(Nuclear Factor-KappaB,NF-κB)调控,而NF-κB 和P53 通路之间的相互拮抗,P300 可以通过NF-κB 促进IL-6 转录[16-17]。IL-6 可以通过JAK/ STAT3 途径调控衰老,其主要机制包括与P53 和P21 的启动子结合,以及与其他途径(如P300 -CBP、NF-κB)相互作用[18-19]。最新研究表明,IL-6/STAT3通路可以促使白色脂肪组织产热增加和脂肪分解的上调,而抑制该途径可抑制前脂肪细胞的SASP 以及SASP 在体外诱导的脂肪组织炎症[20-21]。IL-6 在骨骼肌蛋白质稳态的调节中具有双向作用。全身性IL-6的急性增加会促进肌肉生长和肥大,但其持续升高(如癌症或糖尿病)会导致肌肉萎缩[22-23]。已有研究报道,SO 患者比正常人以及仅为肌少症的患者具有更高的IL-6 水平[24]。
MiRNAs,非编码的短小的RNA,可以经由细胞分泌到血液循环中,介导细胞间和组织器官间的信息传递。据报道[25],衰老会改变肌肉中的miRNAs 水平,这些变化可能对肌肉的质量和数量产生不利影响。来自啮齿类动物的研究证据表明,脂肪衍生的miRNAs 可通过外泌体运输到各种宿主细胞,包括肌细胞,肝细胞和巨噬细胞;同样,骨骼肌衍生的miRNAs可被脂肪组织吸收[25]。miRNAs 的这种串扰机制使得其成为增龄相关肌少性肥胖的潜在治疗靶点。本研究预测miR-26b-5p、 miR-155-5p、 miR-34a-5p 等miRNAs 在增龄相关肌少性肥胖发生发展中可能发挥着重要作用,而已有研究表明,miR-26b 是脂肪生成所必需的,它可以通过靶向ADAM 金属肽酶结构域17(ADAM Metallopeptidase Domain 17,ADAM17)增加脂质积累[26],通过靶向磷酸酶和张力蛋白同源物(Phosphatase and Tensin Homolog,PTEN)诱导细胞分化[27]。一项对老年肌少症患者血浆的检测发现miR-155 含量降低[28]。总的来说,miRNAs 分别在肥胖、肌少症领域有初步的探索,但仍缺乏足够的证据阐明其机制,在增龄相关肌少性肥胖中更需要进一步的研究。
生活方式干预是预防和治疗增龄相关SO 的有效基本策略,适宜的有氧运动、抗阻训练联合膳食调整可明显改善老年SO 患者的身体功能。骨骼肌和脂肪间的通讯改变无疑在其中起着重要作用,但调控机制尚不清楚。本研究发现P53、 P300、 IL-6/STAT3 通路、 miR-26b-5p 等miRNAs 以及它们参与的SASP 调节可能在增龄相关SO 发生发展中起着重要作用,为进一步解析及诊疗增龄相关SO 提供了线索。由于本研究是运用数据库及生物信息学分析手段进行的探索性工作,研究结果仍需在后续实验中进一步验证。

