溴莫尼定对低氧诱导的PC12细胞神经损伤的保护作用
解晨,王强,汤旎,吴月容,谷有全
缺血性脑卒中是临床常见神经系统疾病,其主要病理类型为短暂性脑缺血发作、可逆性神经功能障碍、进展性卒中、完全性卒中,已严重影响患者生存质量,研究报道指出神经保护性治疗对减轻缺血性脑卒中患者后遗症具有重要意义[1]。既往研究显示自由基生成量增加与脑缺血缺氧性损伤密切相关[2]。因而寻找抗氧化剂防治缺血性脑卒中的发生成为研究热点。研究表明溴莫尼定是一种高度选择性α2肾上腺素能受体激动剂,并可减少视网膜神经节细胞氧化应激损伤进而保护神经[3]。溴莫尼定酒石酸盐可通过激活α-2肾上腺素能受体而保护视网膜缺血性损伤[4]。但溴莫尼定对缺氧诱导的PC12细胞损伤的作用机制尚未可知。研究表明蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)/信号转导及转录活化因子3(STAT3)信号通路激活可减轻脊髓损伤[5]。既往研究显示PC12细胞被广泛用于神经细胞功能、分化、凋亡、神经递质分泌等分子机制的研究,而缺氧所致的PC12细胞损伤与氧化应激有关[6-7]。但溴莫尼定是否调控Akt/mTOR/STAT3信号通路对缺氧诱导的PC12细胞损伤发挥保护作用尚未可知。本研究于2018年5月至2019年8月拟采用缺氧诱导PC12细胞损伤,观察并探讨溴莫尼定对PC12细胞缺氧损伤的保护作用及其机制。
1 材料与方法
1.1材料与试剂溴莫尼定购自上海晶都生物技术有限公司;Akt/mTOR/STAT3信号通路抑制剂雷帕霉素购自北京索莱宝科技有限公司;PC12细胞购自宁波明舟生物科技有限公司。RPMI 1640培养基购自杭州吉诺生物医药技术有限公司;胰蛋白酶与胎牛血清购自上海栩冉生物科技有限公司;噻唑蓝(MTT)购自上海泽叶生物科技有限公司;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡试剂盒购自上海翊圣生物科技有限公司;乳酸脱氢酶(LDH)、丙二醛、超氧化物歧化酶(SOD)检测试剂盒购自南京建成生物工程研究所;兔抗鼠B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)抗体与辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗购自美国Thermo Fisher Scientific公司;RIPA裂解液购自上海联迈生物工程有限公司;BCA蛋白定量检测试剂盒购自上海晶抗生物工程有限公司;兔抗鼠Akt及其磷酸化(p-Akt)、mTOR及其磷酸化(p-mTOR)、STAT3及其磷酸化(p-STAT3)抗体均购自美国Abcam公司。
1.2方法
1.2.1药物处理及实验分组 制备细胞缺氧模型:配制三气通气箱,放入37℃恒温培养箱内,充入95%氮气与5%二氧化碳混合气体,外接传感器以此控制含氧量,缺氧处理时间24 h[8]。细胞培养于含有10%胎牛血清的RPMI 1640培养基,置于37℃恒温培养箱内进行培养,选取对数生长期PC12细胞进行实验,实验设置五组:对照组(正常培养基培养细胞)、缺氧组(细胞缺氧处理24 h)、分别用终浓度为0.25μmol/L、0.5μmol/L、1μmol/L的溴莫尼定处理细胞24 h,随后缺氧处理24 h,分别记作缺氧+0.25μmol/L溴莫尼定组、缺氧+0.5μmol/L溴莫尼定组、缺氧+1μmol/L溴莫尼定组[9]。采用MTT实验检测各组细胞活力,筛选溴莫尼定适宜浓度用于后续研究。后续实验中为验证溴莫尼定是否通过激活Akt/mTOR/STAT3信号通路而发挥作用,实验分成缺氧+溴莫尼定组(用前述筛选出的适宜浓度的溴莫尼定处理细胞24 h,随后缺氧处理24 h)、缺氧+溴莫尼定+雷帕霉素组(含有前述筛选出的适宜浓度的溴莫尼定与800 nmol/L雷帕霉素处理细胞24 h,随后缺氧处理24 h)[10]。
1.2.2MTT法检测细胞增殖 收集对数生长期PC12细胞,0.25%胰蛋白酶消化细胞,细胞计数(5×104个/毫升),制备细胞悬液,按照每孔100μL的密度接种于96孔板,每组设置3个复孔,按照“1.2.1”处理方法进行分组,每孔加入20μL MTT溶液,置于37℃、相对湿度95%、体积分数5%二氧化碳培养箱内培养4 h,每孔加入150μL二甲基亚砜(DMSO),低速振荡混匀,应用酶标仪检测波长为490 nm处各孔吸光度。
1.2.3检测细胞中LDH、丙二醛、SOD水平 各组细胞培养结束后,收集细胞,吸取培养上清液,按照LDH活性检测试剂盒检测细胞LDH活性,采用硫代巴比妥酸法检测细胞丙二醛含量,应用黄嘌呤氧化酶法检测SOD活性,严格按照试剂盒说明书进行操作。
1.2.4流式细胞术检测细胞凋亡 收集各组对数生长期PC12细胞,0.25%胰蛋白酶消化,细胞计数(1×104个/毫升),收集细胞,预冷PBS洗涤,1 000 r/min转速离心5 min(4℃),收集细胞沉淀置于流式管内,加入500μL结合缓冲液悬浮细胞,每孔依次加入5μL Annexin V-FITC与5μL PI,充分混匀,室温避光孵育20 min,应用流式细胞仪检测细胞凋亡率。
1.2.5蛋白质印迹法检测Bax、Bcl-2及Akt/mTOR/STAT3信号通路相关蛋白表达 收集各组细胞,加入适量蛋白裂解液裂解细胞,提取细胞总蛋白,采用BCA法检测蛋白浓度,取30μg蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),结束后将分离的蛋白凝胶转移至聚偏二氟乙烯(PVDF)膜,室温条件下采用5%脱脂牛奶封闭2 h,孵育一抗(1∶1 000),4℃条件下孵育24 h,孵育二抗(1∶1 000),显影,暗室内曝光,应用凝胶成像分析仪及ImageJ软件分析蛋白条带灰度值。
1.3统计学方法应用SPSS 21.0软件分析,计量资料以±s表示且均符合正态分布,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,多组间两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1不同浓度溴莫尼定对缺氧诱导的PC12细胞活力的影响对照组、缺氧组、缺氧+0.25μmol/L溴莫尼定组、缺氧+0.5μmol/L溴莫尼定组、缺氧+1μmol/L溴莫尼定组缺氧诱导的PC12细胞活力分别为(0.69±0.08)、(0.35±0.04)、(0.44±0.05)、(0.53±0.07)、(0.60±0.09)(F=34.73,P<0.001)。与对照组比较,缺氧组缺氧诱导的PC12细胞活力显著降低(P<0.05);相较于缺氧组,缺氧+0.25μmol/L溴莫尼定组、缺氧+0.5μmol/L溴莫尼定组、缺氧+1μmol/L溴莫尼定组PC12细胞活力显著升高(P<0.05)。其中溴莫尼浓度为1μmol/L时作用效果最好,用于后续研究。
2.2溴莫尼定对缺氧诱导的PC12细胞凋亡的影响相较于对照组,Hypoxia组PC12细胞凋亡率显著增加(P<0.05),Bax蛋白表达量显著升高(P<0.05),Bcl-2蛋白表达量显著降低(P<0.05);与Hy‐poxia组比较,Hypoxia+溴莫尼定组PC12细胞凋亡率显著降低(P<0.05),Bax蛋白表达量显著降低(P<0.05),Bcl-2蛋白表达量显著升高(P<0.05)。见图1,2;表1。

图1 溴莫尼定对缺氧诱导的PC12细胞凋亡的影响 图3 抑制蛋白激酶 B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)/信号转导及转录活化因子 3(STAT3)信号通路逆转溴莫尼定对缺氧诱导的PC12细胞凋亡的影响
表1 溴莫尼定对缺氧诱导的PC12细胞凋亡的影响/±s
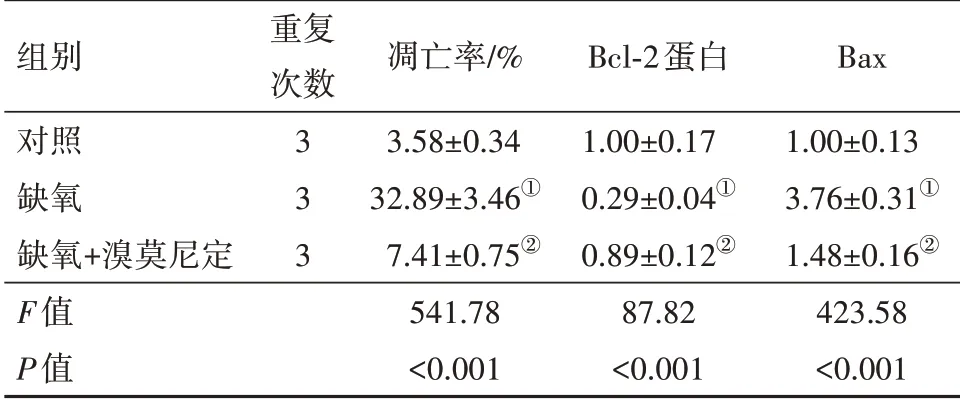
表1 溴莫尼定对缺氧诱导的PC12细胞凋亡的影响/±s
注:Bcl-2为B细胞淋巴瘤-2,Bax为Bcl-2相关X蛋白。①与对照组比较,P<0.05。②与缺氧组比较,P<0.05。
组别对照缺氧缺氧+溴莫尼定F值P值重复次数3 3 3凋亡率/%3.58±0.34 32.89±3.46①7.41±0.75②541.78<0.001 Bcl-2蛋白1.00±0.17 0.29±0.04①0.89±0.12②87.82<0.001 Bax 1.00±0.13 3.76±0.31①1.48±0.16②423.58<0.001
2.3溴莫尼定对缺氧诱导的PC12细胞LDH、丙二醛、SOD水平的影响与对照组相比,缺氧组PC12细胞中LDH、丙二醛水平显著升高(P<0.05),SOD水平显著降低(P<0.05);相较于缺氧组,缺氧+溴莫尼定组PC12细胞中LDH、丙二醛水平显著降低(P<0.05),SOD水平显著升高(P<0.05),见表2。
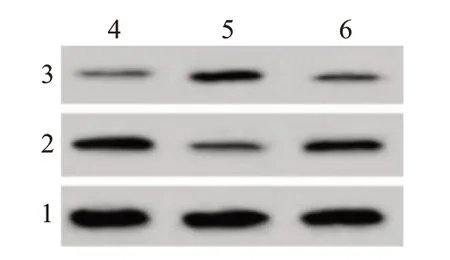
图2 溴莫尼定对缺氧诱导的PC12细胞凋亡相关蛋白表达的影响
表2 溴莫尼定对缺氧诱导的PC12细胞LDH、丙二醛、SOD水平的影响/±s
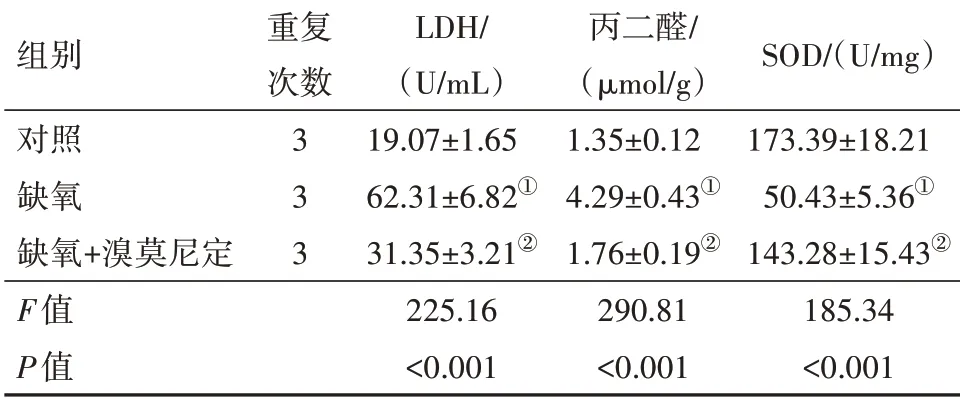
表2 溴莫尼定对缺氧诱导的PC12细胞LDH、丙二醛、SOD水平的影响/±s
注:LDH为乳酸脱氢酶,SOD为超氧化物歧化酶。①与对照组比较,P<0.05。②与缺氧组比较,P<0.05。
组别对照缺氧缺氧+溴莫尼定F值P值重复次数3 3 3 LDH/(U/mL)19.07±1.65 62.31±6.82①31.35±3.21②225.16<0.001丙二醛/(μmol/g)1.35±0.12 4.29±0.43①1.76±0.19②290.81<0.001 SOD/(U/mg)173.39±18.21 50.43±5.36①143.28±15.43②185.34<0.001
2.4溴莫尼定对缺氧诱导的PC12细胞Akt/mTOR/STAT3信号通路的影响与对照组相比,缺氧组PC12细胞中Akt、p-Akt、mTOR、p-mTOR、STAT3、p-STAT3蛋白表达水平均显著降低(P<0.05);相对于缺氧组,缺氧+溴莫尼定组PC12细胞中Akt、p-Akt、mTOR、p-mTOR、STAT3、p-STAT3蛋白表达水平均显著升高(P<0.05)。见表3。
表3 溴莫尼定对缺氧诱导的PC12细胞Akt/mTOR/STAT3信号通路的影响/±s
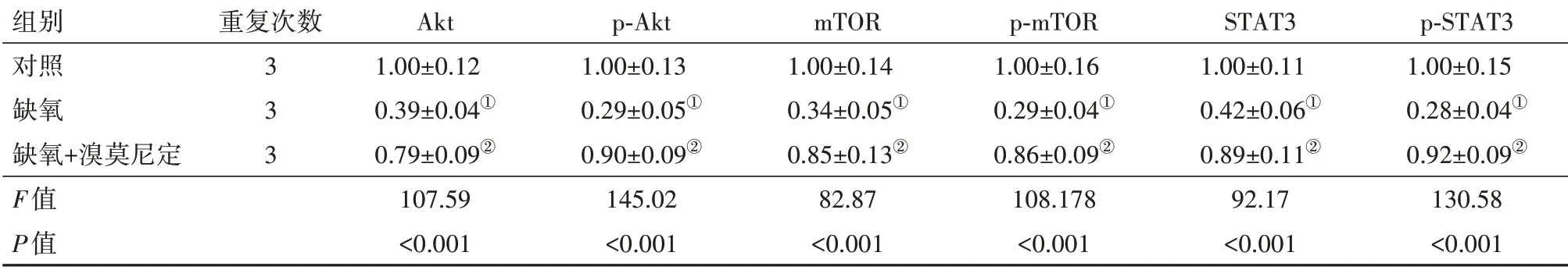
表3 溴莫尼定对缺氧诱导的PC12细胞Akt/mTOR/STAT3信号通路的影响/±s
注:Akt为蛋白激酶B,mTOR为哺乳动物雷帕霉素靶蛋白,STAT3为信号转导及转录活化因子3,p-Akt为磷酸化的蛋白激酶B,p-mTOR为磷酸化的哺乳动物雷帕霉素靶蛋白,p-STAT3为磷酸化的信号转导及转录活化因子3。①与对照组比较,P<0.05。②与缺氧组比较,P<0.05。
组别对照缺氧缺氧+溴莫尼定F值P值重复次数3 3 3 Akt 1.00±0.12 0.39±0.04①0.79±0.09②107.59<0.001 p-Akt 1.00±0.13 0.29±0.05①0.90±0.09②145.02<0.001 mTOR 1.00±0.14 0.34±0.05①0.85±0.13②82.87<0.001 p-mTOR 1.00±0.16 0.29±0.04①0.86±0.09②108.178<0.001 STAT3 1.00±0.11 0.42±0.06①0.89±0.11②92.17<0.001 p-STAT3 1.00±0.15 0.28±0.04①0.92±0.09②130.58<0.001
2.5抑制Akt/mTOR/STAT3信号通路逆转溴莫尼定对缺氧诱导的PC12细胞增殖和凋亡的影响实验结果显示,与缺氧+溴莫尼定组相比,缺氧+溴莫尼定+雷帕霉素组缺氧诱导的PC12细胞活力显著降低(P<0.05),细胞凋亡率显著升高(P<0.05),Bax蛋白表达水平显著升高(P<0.05),Bcl-2蛋白表达水平显著降低(P<0.05),见图3,4;表4。
表4 抑制Akt/mTOR/STAT3信号通路逆转溴莫尼定对缺氧诱导的PC12细胞增殖和凋亡的影响/±s
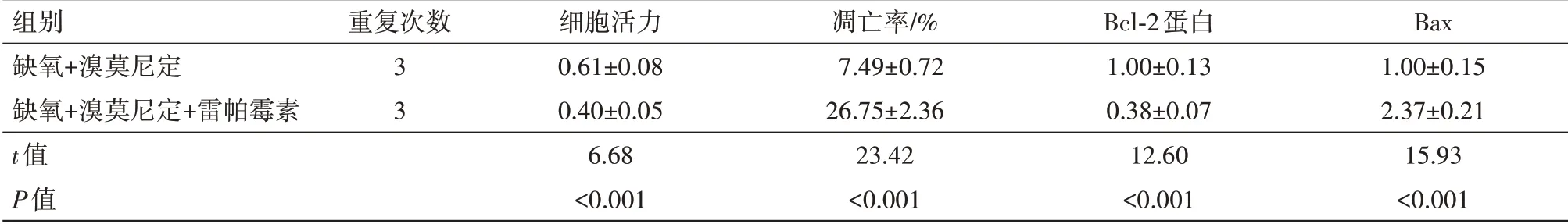
表4 抑制Akt/mTOR/STAT3信号通路逆转溴莫尼定对缺氧诱导的PC12细胞增殖和凋亡的影响/±s
注:Akt为蛋白激酶B,mTOR为哺乳动物雷帕霉素靶蛋白,STAT3为信号转导及转录活化因子3,Bcl-2为B细胞淋巴瘤-2,Bax为Bcl-2相关X蛋白。
组别缺氧+溴莫尼定缺氧+溴莫尼定+雷帕霉素t值P值重复次数3 3细胞活力0.61±0.08 0.40±0.05 6.68<0.001凋亡率/%7.49±0.72 26.75±2.36 23.42<0.001 Bcl-2蛋白1.00±0.13 0.38±0.07 12.60<0.001 Bax 1.00±0.15 2.37±0.21 15.93<0.001

图4 抑制蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)/信号转导及转录活化因子3(STAT3)信号通路逆转溴莫尼定对缺氧诱导的PC12细胞凋亡相关蛋白表达的影响
2.6抑制Akt/mTOR/STAT3信号通路逆转溴莫尼定对缺氧诱导的PC12细胞LDH、丙二醛、SOD水平的影响相较于缺氧+溴莫尼定组,缺氧+溴莫尼定+雷帕霉素组缺氧诱导的PC12细胞中LDH、丙二醛水平显著升高(P<0.05),SOD水平显著降低(P<0.05),见表5。
表5 抑制Akt/mTOR/STAT3信号通路逆转溴莫尼定对缺氧诱导的PC12细胞LDH、丙二醛、SOD水平的影响/±s

表5 抑制Akt/mTOR/STAT3信号通路逆转溴莫尼定对缺氧诱导的PC12细胞LDH、丙二醛、SOD水平的影响/±s
注:Akt为蛋白激酶B,mTOR为哺乳动物雷帕霉素靶蛋白,STAT3为信号转导及转录活化因子3,LDH为乳酸脱氢酶,SOD为超氧化物歧化酶。
组别缺氧+溴莫尼定缺氧+溴莫尼定+雷帕霉素t值P值重复次数3 3 LDH/(U/mL)30.14±2.73 52.83±6.04 10.27<0.001丙二醛/(μmol/g)1.75±0.16 3.71±0.42 13.08<0.001 SOD/(U/mg)145.33±14.87 68.29±6.76 13.97<0.001
3 讨论
大脑耗氧量占总耗氧量的23%左右,中枢神经系统对缺氧较为敏感,一旦处于缺氧状态大脑最易受到缺氧损伤[11]。PC12细胞来源于大鼠肾上腺髓质嗜铬瘤细胞,其细胞形态、结构与功能与神经元细胞相似,部分药物可通过抗炎、抗氧化对缺氧诱导的PC12细胞发挥保护作用[12]。因此本研究主要探讨溴莫尼定对缺氧诱导的PC12细胞增殖、凋亡及氧化应激的影响,并探究其可能作用机制。
溴莫尼定属于α2肾上腺素能受体激动剂,研究表明溴莫尼定对神经细胞具有一定保护作用,但关于其具体作用机制尚未阐明[13]。研究报道指出溴莫尼定可通过减少视网膜神经节细胞凋亡而减缓小鼠视神经损伤[14]。相关研究表明溴莫尼定可抑制细胞凋亡相关蛋白活化从而减少细胞凋亡[15]。本研究结果显示,缺氧处理后PC12细胞活力显著降低,不同浓度的溴莫尼定处理后细胞活力显著升高,提示溴莫尼定可促进缺氧诱导的PC12细胞存活。细胞凋亡与PC12细胞缺氧损伤密切相关,研究表明Bax表达升高可促进细胞色素C(CytC)释放而激活caspase-3从而促进细胞凋亡,而Bcl-2表达升高可抑制CytC释放从而抑制细胞凋亡[16]。本研究结果显示缺氧处理后PC12细胞凋亡率显著升高,Bax蛋白表达量增加,而Bcl-2蛋白表达量减少,但溴莫尼定处理后细胞凋亡率显著降低,Bax蛋白表达量减少,而Bcl-2蛋白表达量增加,提示缺氧可诱导PC12细胞凋亡,而溴莫尼定可抑制缺氧诱导的PC12细胞凋亡,其作用机制可能通过调控细胞凋亡相关蛋白表达而发挥作用。SOD属于抗氧化酶类并可通过清除自由基及减少过氧化物的生成而发挥抗氧化损伤的作用,细胞缺氧损伤发生时细胞透性增加导致LDH从细胞质溢出,丙二醛属于脂质过氧化物并可反应细胞损伤程度[17]。本研究结果显示缺氧处理后PC12细胞中SOD水平显著降低,而溴莫尼定可抑制缺氧诱导的PC12细胞中SOD水平的降低,提示溴莫尼定可能通过促进PC12细胞生成SOD而清除氧自由基。本研究结果显示缺氧处理后PC12细胞中丙二醛、LDH水平显著升高,而溴莫尼定抑制缺氧诱导的PC12细胞丙二醛、LDH水平升高,提示溴莫尼定可能通过以降低丙二醛、LDH水平而维持细胞膜完整性。本研究证实溴莫尼定对缺氧损伤的PC12细胞具有保护作用。
Akt/mTOR信号通路激活可减轻心肌细胞氧化损伤[18]。研究表明mTOR是Akt下游的靶点基因,STAT3是mTOR下游的靶点基因,Akt通过磷酸化下游靶蛋白可影响炎症、氧化应激等生物学过程,促进其信号通路的激活可减轻炎症、氧化应激进而减轻脑缺血再灌注损伤及脑损伤引起的急性肺损伤[19-20]。本研究结果显示缺氧处理后PC12细胞中Akt/mTOR/STAT3信 号 通路 相 关蛋 白Akt、p-Akt、mTOR、p-mTOR、STAT3、p-STAT3的表达水平均显著降低,而溴莫尼定可显著提高Akt、p-Akt、mTOR、p-mTOR、STAT3、p-STAT3的表达水平,推测溴莫尼定可能通过激活Akt/mTOR/STAT3信号通路而保护缺氧诱导的PC12细胞损伤。本研究结果显示抑制Akt/mTOR/STAT3信号通路可逆转溴莫尼定对缺氧诱导的PC12细胞增殖、凋亡及LDH、丙二醛、SOD水平的影响,分析原因可能为Akt/mTOR/STAT3信号通路激活后可能抑制氧化应激反应从而抑制细胞凋亡。提示溴莫尼定可通过激活Akt/mTOR/STAT3信号通路而促进缺氧诱导的PC12细胞增殖,抑制细胞凋亡及减轻氧化损伤从而保护神经细胞。
综上所述,溴莫尼定可促进PC12细胞缺氧损伤导致的氧自由基的清除,促进细胞增殖,抑制细胞凋亡,保护缺氧损伤神经细胞,其作用机制与激活Akt/mTOR/STAT3信号通路有关。
——雷帕霉素

