氮沉降影响草地生态系统土壤氮循环过程的研究进展
陆姣云,张鹤山,田宏,熊军波,刘洋
(动物胚胎工程及分子育种湖北省重点实验室,湖北省农业科学院畜牧兽医研究所,湖北 武汉 430064)
氮(nitrogen,N)是生态系统中重要的营养元素,为生命体生长提供必不可少的物质和能量[1]。人类活动不断增加大气中的氮含量,并通过大气氮沉降输入到陆地生态系统,对全球生态系统产生了重大影响[2−5]。在20 世纪,大气氮沉降使得陆地生态系统氮素增加了3~5 倍,当前全球大部分地区的平均氮沉降速率已大于10 kg·hm−2·yr−1[6],且据有关研究显示预计到21 世纪末全球氮沉降还将增加到现在的2.5 倍[2,7]。欧洲和北美地区的氮沉降在1980年左右达到峰值,平均氮沉降量为20~50 kg·hm−2·yr−1,其中欧洲西北部和中部及北美东北部的氮沉降量高达115 kg·hm−2·yr−1[8]。有研究发现,美国大湖区上游的糖槭(Acer saccharum)优势森林大气氮沉降速率为7~12 kg·hm−2·yr−1[9]。我国是全球第三大氮沉降区,到2000年平均氮沉降量达21.1 kg·hm−2·yr−1,部分地区达到了63.5 kg·hm−2·yr−1,极大地干预了陆地生态系统中氮素的重新分配[10−11]。近年来,也有学者研究发现我国大气氮沉降已停止增加,但较高水平的氮沉降量依然需要高度关注[12]。生态系统不断增加的氮输入改变了全球氮循环,并因此成为全球变化的关键驱动因素。氮循环作为陆地生态系统最基本的物质循环过程,对全球变化及人为活动存在敏感的响应。国际环境问题科学委员会(Scientific Committee on Problems of the Environment,SCOPE),国际地圈生物圈计划(International Geosphere Biosphere Program,IGBP)和政府间气候变化委员会(Intergovernmental Panel on Climate Change,IPCC)等均把氮素循环相关的项目列为主要研究内容[13]。在土壤环境中,氮素循环过程主要包括硝化作用、反硝化作用、固氮作用等[14−15]。大气氮沉降的加剧会引起生态系统氮输入的增加及土壤环境的改变,并对生态系统中土壤、植物及土壤微生物等产生显著影响[5,16],从而引起生态系统生产力和稳定性的变化。氮沉降直接提高了土壤中矿质氮含量和微生物活性,促进了微生物的氮矿化过程,增加了土壤中的养分含量,为植物生长提供了更多的氮素,缓解了生态系统中植物和微生物对氮素的竞争,从而增加生态系统生产力[17−19]。但是,土壤中氮输入的持续增加,导致土壤微生物产生的腐殖质分解酶的量减少,微生物活性受到影响,土壤氮矿化作用减弱[20];同时,当生态系统达到氮饱和后,多余的无机氮会发生硝化和反硝化作用,增加了氮素流失风险[21−22]。另外,氮沉降引起的土壤酸化改变了土壤中的碱基阳离子组成,导致植物的群落组成发生改变[23];同时,氮输入的增加提高了土壤中活性氮化合物的积累,引起群落中喜氮物种的快速生长[24],进而影响群落结构和生产力。综合来看,氮沉降的增加会改变土壤的环境条件(如有效氮含量、土壤酸碱性、碱基阳离子组成等),从而直接影响微生物的种类和活性,改变土壤中元素的周转和输出,影响植物的生长和生产,进而影响生态系统中养分的循环过程[25−28]。因此,在氮沉降背景下,深入了解土壤氮素循环过程,对提高植物环境适应性具有重要的理论和实践意义。
草地是陆地生态系统的重要组成部分,约占全球陆地总面积的46%左右(其中天然草地30%左右,疏林草地16%左右)[29]。我国草地面积约3.9×108hm2,占国土面积的40%,是最大的陆地生态系统[30−31]。随着畜牧业的不断发展,人类过度的利用草地导致其面积锐减,草地资源损失严重[32]。近年来,随着人们活动的增加,以及对草地保护意识不强,过度的开垦和放牧等造成养分失衡,严重限制了草地的生产和发展[33]。氮作为草地生态系统中最重要的限制性环境因子之一,在土壤中的有效含量对草地生态系统物质循环、能量流动及功能和服务有重要影响[34]。氮沉降的显著增加,导致草地生态系统土壤氮循环过程发生改变[35−36]。但是,大气中丰富的氮素大部分以植物不可利用的形式存在,只有通过土壤氮循环过程才会转化为易被植物吸收利用的氮素形态(铵态氮和硝态氮等),因此,开展土壤氮循环过程的研究,对提高草地生产力,合理开发与利用草地资源,改善草地生态系统等具有十分重要的意义[31,37]。
本研究通过对氮沉降背景下的草地生态系统土壤氮循环过程进行综述,分析目前国内外的研究进展并指出问题,分别从生物固氮、硝化作用、反硝化作用、有机氮矿化等(图1)方面进行综述,提出未来研究展望,促进草地养分循环理论的发展。本研究不仅在探讨氮沉降对草地生态系统中土壤氮循环过程的影响有重要意义,也可为实现草地资源的合理利用和可持续发展提供科学依据。
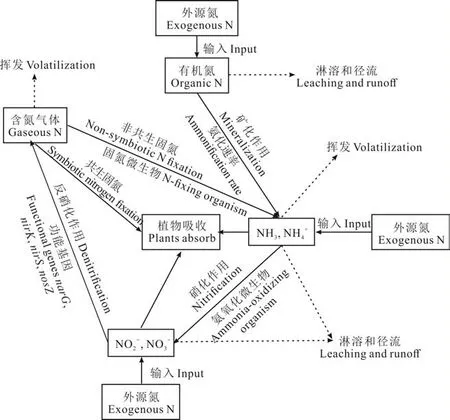
图1 土壤中氮循环主要过程Fig.1 N cycling process in soil
1 草地生态系统土壤氮循环过程
世界范围内人工氮肥的生产和工业用途大大加速了氮的循环[13]。在草地生态系统中可以被植物吸收的氮素主要通过土壤的氮循环相关过程所产生(图1)。首先,土壤微生物通过生物固氮作用将大气中不能被植物直接利用的含氮气体还原为氨。生物固氮主要包括共生固氮和非共生固氮,共生固氮是共生固氮微生物侵入到植物根部,在根内将大气中的氮素转化为氨后直接提供给植物;非共生固氮是自生固氮微生物在土壤中将氮气还原为氨后供植物利用或进行下一步反应。外源氮素主要以有机氮或无机氮的形式被输入到土壤中,而有机氮不能被植物直接吸收利用,必须先通过矿化作用将有机态氮素化合物转化为无机态氮素化合物。矿化作用主要包含氨基化和氨化两个阶段,氨基化过程是将复杂的有机含氮化合物分解为简单的氨基化合物,氨化过程是将氨基化作用产生的简单有机态氨基化合物经微生物转化成氨的过程。矿化作用和生物固氮产生的氨大部分与无机或有机酸结合生成铵盐,并与外源添加的铵盐一起被植物直接吸收利用,或通过硝化作用转化为硝酸盐。硝化作用首先将铵盐中的NH4+通过亚硝酸细菌氧化为NO2−,然后将NO2−通过硝酸细菌氧化为NO3−。硝化作用产生的亚硝酸盐和硝酸盐能够被植物直接利用,但是,当土壤中氧气供应不足时,土壤氮素发生反硝化作用,即微生物将土壤中的活性氮转化成分子氮(不同形态的含氮气体)后,释放到大气中,转化为不能被植物直接利用的氮源流失。另外,由于降水等因素,土壤中多余的氮素也易发生淋溶和径流,造成资源浪费。总而言之,土壤中的氮循环过程是由微生物介导的一系列复杂过程,不同形态、价态氮化合物的转化分别由相应的功能微生物驱动完成,微生物的种类和数量是限制土壤氮素转化的直接影响因素[1,16]。
2 生物固氮
2.1 氮沉降对共生固氮菌生物固氮过程的影响
生物固氮是土壤氮素的第二大来源,其投入土壤中的氮仅次于矿质态氮,是全球氮素输入量的16%[38]。生物固氮是大气氮进入生态系统氮循环的主要途径之一[39],它是维持草地氮素平衡的一个重要因素,是发展草地生产力的长久之计[33]。豆科植物−根瘤菌共生固氮体系是生物固氮中最强的固氮体系,每年固氮量占生物固氮总量的65%[40]。土壤中无机氮(铵态氮和硝态氮)含量是影响豆科植物共生固氮的重要因素[41](表1)。土壤中硝态氮增加会使根瘤侵染区细胞O2含量降低,固氮所需供氧不足,导致根瘤呼吸速率及固氮酶活性下降[42]。施用硝态氮不仅会降低根瘤数和根瘤干重,还会影响根瘤的正常结构并抑制根瘤菌对豆科植物的侵染[43]。同样地,土壤铵态氮的增加,会影响三磷酸腺苷(adenosine triphosphate,ATP)的产生和利用效率,造成固氮所需能量不足,固氮酶活性受到影响[44−45]。也有研究指出,在0~2 mmol·L−1外源氮添加下大豆(Glycine max)的固氮百分率显著提高,但随着外源氮的增加,大豆生物固氮能力受到抑制[46]。不同氮素形态对植物固氮能力的影响存在差异。添加10 mg·kg−1铵态氮后田菁(Sesbania cannabina)固氮作用受到抑制,而等量硝态氮却促进了其固氮作用,到含量更高时才产生抑制[47]。这主要是因为铵态氮通过直接影响固氮酶活性或限制固氮酶的合成来抑制固氮,而硝酸还原酶和固氮酶都具有含钼辅因素,可能钼的存在消除了低浓度的硝酸盐对固氮酶的抑制,提高了根瘤固氮,而高浓度的硝酸盐造成硝酸还原酶与固氮酶对钼的竞争,固氮酶活性受到抑制,固氮作用下降[45]。在不同生长阶段豆科植物固氮能力也存在差异。王丹英等[48]的研究指出,在生长初期适量施氮肥会增加植物的固氮能力,但在开花期和结荚期土壤速效氮含量与固氮率显著负相关,过量施肥易导致减产。建植初期或刈割后的紫花苜蓿(Medicago sativa)草地固氮能力较弱,增施氮肥利于增产,而对于生长2年以上的苜蓿草地,增施氮肥会抑制根瘤菌活性[49−50]。因此,可以看出根瘤菌的生物固氮过程对氮沉降的响应受施氮量、氮素形态、植物生长时期以及土壤中无机氮含量等因素的调控。
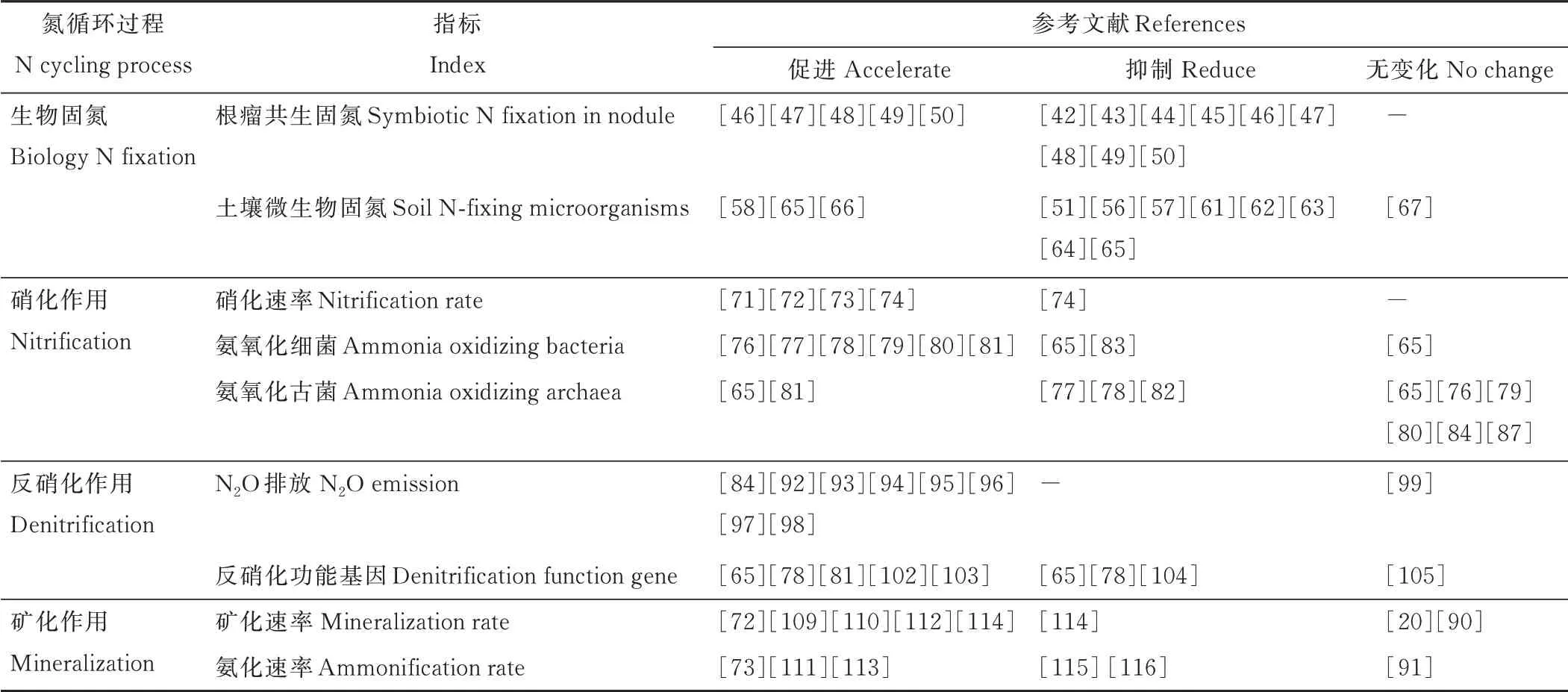
表1 氮添加对土壤氮循环过程的影响Table 1 Effects of nitrogen addition on soil nitrogen cycling
2.2 氮沉降对自生固氮菌生物固氮过程的影响
对大多数陆地生态系统而言,尤其是缺乏共生固氮植物的生态系统,非共生固氮是一个关键的氮输入途径[51]。土壤非共生固氮的主要驱动因子是土壤中的自生固氮微生物,其过程与固氮菌群落丰度、组成和活性显著相关[52](表1)。生物固氮过程极度耗能,一般认为在无机氮丰富的环境中,固氮微生物缺乏竞争性,生长缓慢,表现为无机氮对固氮速率的抑制[53]。固氮微生物对土壤氮素的响应十分敏感,土壤中有效氮含量的增加,可能会降低植物对固氮微生物的依赖,抑制土壤固氮微生物的活性,导致土壤中固氮微生物的丰度下降[54−55]。通过氮添加对贝加尔针茅(Stipa baicalensis)草原土壤微生物影响的研究发现,氮素添加降低了固氮微生物的丰度和多样性,而硝态氮是主要影响因子之一[56]。侯海军等[57]指出,土壤速效氮含量与固氮微生物的群落结构和丰度负相关,氮肥添加抑制了固氮微生物的生长,导致土壤中固氮微生物的多样性降低。但有研究表明,适量氮肥添加会提高土壤中有机碳含量以及固氮菌丰度,从而促进土壤固氮微生物的固氮功能[58]。也有研究指出,施用氮肥后固氮菌丰度和群落与对照差异不显著[55,59]。一般地,固氮酶研究中的指示基因主要有nifD、nifK和nifH,其中nifH基因与生物固氮过程联系紧密,被广泛应用于研究固氮微生物[60]。有研究发现,土壤中高浓度的无机氮可能会抑制固氮菌活性和nifH基因的表达,从而降低土壤中微生物的固氮作用[61−62]。刘朴方[63]研究表明,nifH基因的丰度随施氮量的增加而降低。在放牧林地和受管理的生态系统中,较高的土壤氮浓度与nifH基因丰度呈负相关关系[51,64]。然而,通过施硝酸铵模拟氮沉降的研究表明,内蒙古贝加尔针茅草原固氮微生物nifH基因丰度随施氮量的增加而表现出先升高后降低的趋势[65]。在土壤硝酸盐水平较高时,nifH基因丰度提高[66]。Wakelin 等[67]研究表明氮肥添加对含nifH细菌的丰度无显著影响。研究结果的不一致主要是由于施肥后土壤产生多种次生效果,氮肥添加引起土壤中有效氮、碳、pH 等发生改变,以及植物类型和生境等因素的不同均会导致施氮对土壤固氮微生物活性和群落结构产生不同影响[68]。同时,非共生固氮过程更易受环境条件的影响,施氮对非共生固氮微生物的影响及调控机制尚不明确[69]。通过定量分析,明确氮沉降对不同土壤类型或牧草的非共生固氮微生物的调控原理,对草地生态系统优化施肥,发挥非共生固氮微生物的固氮潜力,提高生产力提供科学指导。
3 硝化作用
3.1 土壤硝化过程对氮沉降的响应
土壤硝化作用是连接固氮作用和反硝化作用的重要环节,在生态系统的氮素转化中具有重要作用,该过程会产生影响土壤净初级生产力的硝酸盐[60,70]。氮沉降通过硝化作用提高了土壤中的无机氮含量,导致生态系统严重富营养化[71],因此研究者们更加关注氮沉降对土壤硝化作用的影响(表1)。全球范围内的meta 分析表明,氮添加促进了土壤的硝化作用,使土壤中NO3−浓度显著升高429%[72]。罗亲普等[73]研究表明,高氮处理会促进内蒙古温带典型草原中土壤的净硝化速率。吕玉等[74]在一定范围内的施氮研究表明,随着施氮量增加,土壤硝化势和硝化速率先增加,但在高氮处理下降低。因此,氮沉降会增加土壤中的氮输入,但土壤中氮素本底值的不同,会造成土壤硝化过程对氮沉降的响应存在差异,需因地制宜地开展更为精准地研究。
3.2 氮沉降对硝化微生物的作用
氨氧化微生物是土壤硝化作用的主要限速因子,包括氨氧化细菌(ammonia oxidizing bacteria,AOB)和氨氧化古菌(ammonia-oxidizing archaea,AOA),受氨单加氧酶基因(amoA)的控制[75]。在一系列土壤微生态系统中,AOB 对氮肥的添加有积极的响应,而AOA 丰度则保持稳定甚至降低[76−78]。在添加尿素对人工牧草地影响的研究中发现,AOB 在各施氮水平下均富集生长[79]。Shen 等[80]通过研究氮添加对内蒙古半干旱草地的影响发现,长期施氮对AOB 丰度和组成有显著影响,而AOA 丰度无显著变化。在地中海气候区的草地生态系统中,氮沉降显著增加了AOB 和AOA 的丰度,且对AOB 的影响大于对AOA 的影响[81]。通过对内蒙古典型温带草原三叶草(Trifolium repens)的施氮研究发现,AOA 和AOB 有明显的生理特征和生态位,AOB 对氮的敏感性高于AOA,土壤硝化潜势和AOB-amoA基因显著正相关而与AOA-amoA基因负相关,说明氮是AOB 丰度的重要驱动因素,氨氧化过程主要受AOB 的驱动[35]。但是,也有一些研究表明,AOA 在低肥力条件下更具有竞争优势。在pH 为4.5~7.5 的土壤中,氮沉降的加剧并未改变AOB 的丰度[79],而在铵离子浓度较低的土壤及不利的环境中,AOA占主导地位,是自养型氨氧化的重要驱动因素[82−83]。这主要是因为AOB 可能更能适应中性或偏碱性的土壤,在偏酸性土壤中,AOA 对施肥的响应可能比AOB 敏感,AOA 特殊的生理特性使它们能够在不适合AOB 的潜在生态位(低氨浓度)中生存,导致它们对氮肥的响应不同[35,82];同时,AOB 是化能自养生物,对高浓度氨离子响应明显,而AOA 是自养或混合养微生物,其对氨的亲和力很高,生长所需的最低铵态氮浓度比AOB 所需的铵态氮浓度低近100 倍,AOA 不仅能将铵态氮氧化为羟铵态氮获得自养生长的能量,也能够同化土壤有机碳进行异养生长,因而更能适应寡营养的环境[84−86]。另外,王继琛[84]研究表明,有机氮的投入对AOB 丰度无显著影响,说明有机氮在土壤中要经过矿化分解后才能被AOB 利用,这种缓慢的氮释放过程导致植物和其他异养微生物与AOB之间对氮的竞争加剧,从而对AOB 丰度影响不显著[87]。刘红梅等[65]的研究也表明,低氮添加对AOB-amoA和AOA-amoA基因丰度无显著影响,高氮添加显著提高了AOB-amoA基因丰度,而AOA-amoA基因丰度降低。对氮限制条件下的黄土高原盐碱草地的研究发现,氮肥添加显著提高了微生物的氮转化速率[88]。因此,土壤氨氧化微生物的组成和丰度受氮肥类型、施肥量、土壤肥力和土壤质地的影响[89],微生物硝化过程对氮沉降变化的响应尚不统一,要揭示AOA 和AOB 对各地土壤硝化作用的贡献,还需进行更系统的研究。
4 反硝化作用
4.1 土壤反硝化过程对氮沉降的响应
反硝化作用是土壤中的硝酸盐和亚硝酸盐被还原为含氮气体后从草地生态系统中流失的过程[33],反硝化作用是氮循环的关键环节之一,是导致土壤氮向大气流失的主要途径之一[90]。土壤是N2O 排放的最大来源,每年向大气中排放约6.0 t[91]。氮肥添加会提高土壤的反硝化作用,增加土壤中含氮气体的排放,其中以直接施用氨气造成的含氮气体排放最高[84](表1)。大气氮沉降加速了土壤氮转化过程,使得大气中N2O 排放持续升高,过去30年全球大气中的N2O 以每年(0.73±0.03)μg·L−1的速率在增长[92]。当向地球表面施入1 t 自然或者人为的活性氮后可产生10~50 kg 的N2O[93]。有机肥可能比无机肥更有利于反硝化酶活性的增加,以提高反硝化作用效率,使反硝化过程更加彻底[94−95]。在放牧草地施氮(纯N)100 kg·hm−2后,N2O 的年排放量增加了0.5~3.9 kg·hm−2[96]。Mosiera 等[97]对撂荒25年的草原研究表明,氮添加增强了草地土壤N2O 的排放。在淹水条件下施氮肥会降低土壤中的硝态氮,可能是由于厌氧环境中土壤的反硝化速率加快造成的[98]。但也有研究表明,模拟氮沉降对草地N2O 的排放无显著影响[99]。这可能是因为不同草地生态系统本底土壤氮含量不同,从而导致氮沉降增加后对N2O 排放的影响不同[100]。在20 世纪90年代起就有关于氮添加对反硝化作用影响的研究[101],但目前仅有部分零散研究,且大多只关注农田生态系统反硝化作用的特征,而针对环境因素对不同物种群落草地反硝化过程的影响却知之甚少,也鲜见大规模或大的国际研究计划。
4.2 氮沉降对反硝化功能基因的作用
反硝化过程是由众多的微生物参与的,土壤既可以是含氮气体最大的源,也是其最大的库,这主要依赖于反硝化微生物的作用[84]。目前常用的反硝化功能基因包括硝酸还原酶(narG)、亚硝酸盐还原酶(nirK和nirS)和氧化亚氮还原酶(nosZ)基因,其中亚硝酸盐还原酶催化亚硝酸盐还原为NO,是微生物驱动反硝化过程的关键步骤[65,90](表1)。对中国北方温带草地的研究发现,高频率的氮沉降模拟下的nirS和nosZ基因丰度显著高于低频率氮沉降[78]。连续6年氮肥添加后,nirK相对丰度在低氮处理下显著增加,但在高氮处理下显著降低,表明高氮会抑制nirK丰度[65,78]。增施氮肥会增加反硝化细菌nirS、nirK和nosZ基因的拷贝数[102]。氮沉降增加了地中海气候区草地生态系统中土壤的nirK和nirS,且对nirK基因丰度的影响更大[81]。Xie 等[103]研究认为土壤硝酸盐含量是驱动青藏高原草甸反硝化功能基因nirK丰度的重要因素,但也有不一致的研究结果。施用硫酸铵50年后,土壤反硝化功能基因narG、nirK、nirS和nosZ丰度降低,从而指出影响反硝化活性的是反硝化微生物的丰度,而不是群落组分[104]。高氮添加显著降低了反硝化微生物nirK基因的丰度,提高了土壤硝酸盐的积累[65]。施氮对反硝化微生物群落的影响并不显著[105],而显著降低或不改变反硝化细菌的相关基因拷贝数[90]。主要是由于细菌、古菌、真菌和放线菌等多种微生物共同参与了反硝化过程,且多数微生物同时含有多种功能基因,使得对反硝化微生物的研究比较困难,同时环境因子对不同反硝化功能基因微生物种群的影响存在差异,因此,需深入研究不同氮添加水平对不同类型的反硝化基因微生物的影响。
5 有机氮矿化
全球大部分土壤仍表现为氮限制,氮主要以不能被植物直接吸收的有机态存在(95%以上),只能在微生物的作用下通过有机氮的矿化转化为无机氮[15,106]。土壤中大部分细菌、真菌和放线菌均能分解有机含氮化合物。不同环境条件下,有机氮矿化对氮添加响应不同[107−108](表1)。总体而言,氮沉降通过降低土壤C∶N、促进土壤微生物的活动,增强了微生物对氮的固持,进而增强土壤中有机氮的矿化,增加土壤中无机氮的积累[72,109−111]。土壤氨化速率和净氮矿化速率是土壤有机氮矿化过程的重要指示指标,对氮添加的响应存在差异。氮添加显著提高沙质草地生态系统土壤净氮矿化速率[112]。罗亲普等[73]对内蒙古温带草原的研究表明,氮添加能够促进氨化速率。刘碧荣[111]研究发现,高氮添加显著提高了内蒙古锡林郭勒典型草地的土壤总氨化速率。在辽西北草地群落对氮添加响应的研究中,氮添加显著提高了冰草(Agropyron cristatum)群落和假苇拂子茅(Calamagrostis pseudophragmites)群落中土壤有机氮的氨化速率,且随着氮添加量的增大其贡献率越大,表明氮添加对土壤有机氮的矿化过程起到了明显的激发作用[113]。然而,对内蒙古羊草(Leymus chinensis)草原的施氮研究表明,低氮添加促进了土壤氮矿化量,高氮添加抑制了土壤矿化作用[114]。刘碧荣[111]研究发现,高氮添加对多伦县弃耕草地氨化作用影响不显著。刘红梅等[115]在内蒙古贝加尔针茅草原的研究表明,氮添加抑制了土壤净氨化速率。程苗苗[116]对北方农牧交错带草地生态系统的研究表明,氮添加降低了土壤氨化速率。同时,也有研究表明氮添加对盐碱化草地土壤的净氮矿化速率影响并不显著[36]。主要原因有:一是不同类型的草地土壤理化性质存在差异,因而氮沉降对土壤氮矿化作用的影响也存在差异,同时不同的植被类型对不同形态氮素的利用能力也有差异[35,117];二是土壤对氮的吸收存在饱和效应,在达到饱和前土壤氮的矿化作用随氮输入量的增加而增加,达到饱和后土壤氮矿化作用下降[118];三是氮添加对土壤氮矿化作用具有时间效应,添加的氮素在短时间内会与土壤中有机质结合,加速有机质的分解和养分释放,较高的无机氮添加促进了植物的生长及对氮的吸收;但随着时间推移,植物与微生物对土壤氮素的竞争加剧,土壤净氮矿化速率由前期的不断升高逐渐开始下降,直至接近或低于对照,导致土壤中的铵态氮含量降低[101,116,118]。因此,因地制宜地研究时间序列下氮沉降对不同类型草地土壤有机氮矿化的影响,才能更加全面、准确、科学地评价土壤矿化作用对氮沉降的响应规律。同时,矿化过程和硝化过程是微生物参与氮转化的重要环节,微生物的矿化作用为硝化作用提供了底物[111],在研究氮沉降对土壤氮转化过程的影响时,应该将矿化过程和硝化作用统一起来进行分析。
6 总结和展望
土壤微生物对土壤氮循环过程起着至关重要的调节作用。氮沉降的增加将改变土壤中微生物的多样性和生态系统的功能,改变土壤中氮素转化速率,导致氮循环过程发生变化。但是施氮的时间、数量、类型及生态系统类型极大程度地决定着微生物对氮沉降的响应,应加强对氮控制条件下土壤微生物变化的研究,深入了解其调控机制,从而提高植物的适应性和生产性能。
大气氮沉降的加剧引起草地土壤氮素储量及速效氮含量增大,但达到植物和土壤微生物所需的阈值后,土壤表现出氮饱和,土壤中的氮以硝酸盐(NO3−)形式被淋溶或以气态氮(NO、NH3、N2、N2O)形式从土壤中流失。因此,在未来的研究中应加强对我国不同营养水平草地的氮饱和阈值方面的研究,从而防止草地生态系统生态功能退化,更深入的研究可以使土壤实现N2O 源库的转化。
尽管对氮循环的研究已经超过一个世纪,但我国草地类型丰富,关于草地生态系统氮循环的研究仍有不足;加之土壤氮循环过程包含多个环节,每个环节都紧密联系,相互影响,针对氮沉降对草地生态系统土壤氮循环的研究,应当统筹各个环节的协调作用。因此,对土壤氮循环的研究势在必行,以发展有效利用氮素的草地生产系统,并减轻氮素损失对环境造成的威胁。
——固氮微生物

