温化方通过NF-κB信号通路调控大鼠膝骨关节炎实验研究
赵海燕,张鸿婷,李佳卓,魏明慧,姜芊竹
(黑龙江中医药大学附属第二医院风湿科,黑龙江 哈尔滨 150001)
膝关节骨性关节炎(Knee osteoarthritis,KOA)是在40岁以后成人残疾发病和关节改变的最重要原因之一[1]。KOA治疗药物包括非甾体抗炎药、糖皮质激素、软骨保护剂等,但疗效受限。中药治疗KOA逐渐受到重视[2]。膝骨关节炎在中医上属于“膝痹”范畴,为本虚标实之证。多因素体亏虚,风寒湿邪乘虚侵犯机体,寒湿凝滞经络导致气血不畅,引发关节疼痛肿胀[3]。膝骨关节炎急性发作时膝关节肿胀明显,以邪实为著,故治疗上常以健脾祛湿为主,温经通络为辅[4]。温化方是我院治疗膝骨关节炎的经验方,以黄芪防己汤合五苓散加减为组方。经多年临床研究证实该方治疗膝骨关节炎疗效较好[5]。在KOA的病理改变中,以核转录因子B(Nuclear factor kappa B,NF-κB)的反应性激活与滑膜和局部组织炎性侵蚀的关系密切[6]。抑制NF-κB通路可以调控炎症反应,减少成纤维细胞和滑膜细胞的扩增,促进成纤维细胞凋亡,从而减轻软骨和骨组织的侵蚀,减少破骨细胞分化[7]。本研究旨在探讨温化方对大鼠KOA及对NF-κB信号通路的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:健康雄性SPF SD大鼠50只,10~12周龄,购自中国科学院动物研究所[实验动物生产许可证号SCXK(京)2018-0005],体重210~240 g,所有大鼠均在室温24 ℃、正常昼夜节律、自由进食和饮水条件下喂养1周左右。经我院动物伦理委员会审核批准,在动物伦理委员会监督下开展实验工作。
1.1.2 实验试剂:Ⅱ胶原蛋白(批号190213),弗氏不完全佐剂(批号180321),PCR试剂盒(批号A20190820,大连宝生物工程有限公司),酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)试剂盒IL-1β(批号200408),IL-6 试剂盒(批号191004),TNF-α试剂盒(批号200405,武汉博士德生物科技有限公司),PCR试剂盒(批号P200407,美国Sigma公司),凝胶快速制备盒(批号00920KD1,美国Axygen公司),NF-κB p65、β-actin (批号M200409、FX191015,美国Invitrogen公司)。
1.2 实验方法
1.2.1 KOA模型的建立:参考既往文献[8]造模,即牛Ⅱ型胶原溶于0.1 mol/L冰醋酸,最终浓度为2 mg/ml放置在4 ℃冰箱中过夜,次日将其与等量的弗氏不完全佐剂完全乳化在大鼠左后跖底部注射乳剂0.2 ml/只,7 d后再次免疫,即尾根部注射乳剂0.2 ml,进而诱发类风湿关节炎大鼠模型,大鼠足爪红肿,足垫增厚,行动迟缓,踝关节炎症细胞浸润,病理切片提示滑膜增厚,表示造模成功。
1.2.2 分组与处理:在第15天时,随机选取构建膝骨关节炎的模型大鼠40 只,随机分为模型组、温化方组、双氯芬酸钠组、抑制剂组。温化方组大鼠以每日0.3 g/kg剂量的温化方进行灌胃,药物组成:黄芪30 g,防己、益母草、桂枝、茯苓、泽泻、猪苓各15 g,生白术20 g,生甘草10 g。双氯芬酸钠组的大鼠每天以5 mg/kg双氯芬酸钠溶液灌胃;抑制剂组每日予NF-κB抑制剂100 mg/kg灌胃;模型组每日予1 ml/g的0.9%氯化钠灌胃。对照组大鼠不予干预。干预28 d后,用40 mg/kg戊巴比妥钠[9]麻醉大鼠,留取血清和滑膜组织。
1.2.3 HE染色:滑膜组织切片用二甲苯变性,经不同浓度的酒精水合,并根据 HE 的阶梯包被并按照说明书进行扫描。切片在苏木紫和伊红溶液中浸泡。蒸馏水浸泡后,随后在酒精中脱水,用二甲苯透明后,加中性还原剂密封。
1.2.4 体重、关节肿胀度检测:每7 d测量1次大鼠体重。关节肿胀程度评估:每7 d测量大鼠膝关节周径。关节肿胀程度=建模后同侧膝关节周径-建模前同侧膝关节周径[10]。
1.2.5 血清中炎症因子检测:末次给药后禁食24 h,腹主动脉取血,离心,分离血清,ELISA检测试剂盒测定其血清炎症因子IL-1β、IL-6 和TNF-α 表达水平。参考 ELISA试剂盒的检测说明书进行检测。
1.2.6 RT-PCR分析NF-κB p65基因表达水平:通过 RNA 提取包从大鼠滑膜组织中提取 RNA。1 μg RNA 和 cDNA 被 AMV 逆转录酶转化。PCR引物序列,见表1。使用β-actin作为内部参数。PCR扩增状态参数设置为94 ℃,5 min,变性94 ℃,40 s,60 ℃,40 s,72 ℃延伸1 min,40个循环,72 ℃延伸10 min。采用2-△△Ct法计算相关基因表达水平。
1.2.7 Western blot检测滑膜组织NF-κB p65蛋白表达:采集各组大鼠的膝关节滑膜组织,组织蛋白提取试剂盒获取组织总蛋白,放入液氮研钵中快速分解。抽提核蛋白、细胞质蛋白。取蛋白样品进行聚丙烯酰胺凝胶电泳,迁移至半干聚偏氟乙烯膜,加入人NF-κB p65 抗体(1∶500 溶液),过夜孵育,裂解,膜洗涤,ECL 显色,用凝胶图像拍照与检查所测蛋白质和β-actin灰度比作为蛋白数值表达水平。
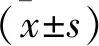
2 结 果
2.1 温化方对KOA大鼠滑膜组织损伤的影响 见图1。HE染色观察结果显示,对照组的膝关节部分光滑,软骨滑膜组织完整,细胞分布适当。模型组的软骨滑膜组织可见诸多的炎症细胞、中性粒细胞和淋巴细胞,深部的软骨细胞核压扁,细胞质肥大,波线消失,细胞重排。与模型组相比,双氯芬酸钠组、抑制剂组和温化方组软骨组织的损伤明显缩小,细胞分布调整相对均匀,细胞核和细胞质缓慢恢复趋于正常组织细胞形态。
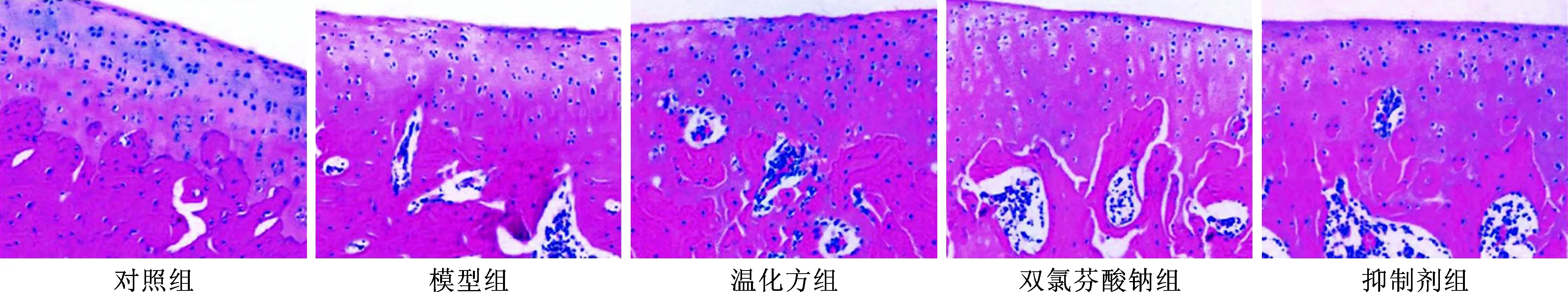
图1 各组大鼠滑膜组织变化(HE染色,×100)
2.2 各组大鼠体重、关节肿胀度比较 见表2。与对照组比较,模型组大鼠体重较轻,关节肿胀度较高,差异有统计学意义(均P<0.05)。与模型组比较,温化方组、双氯芬酸钠组及抑制剂组的大鼠体重升高,关节肿胀度降低,差异有统计学意义(均P<0.05)。
表2 各组大鼠体重、关节肿胀程度比较
2.3 各组大鼠血清TNF-α、IL-6 和 IL-1β比较 见表3。与对照组比较,模型组大鼠血清TNF-α、IL-6 和IL-1β 均高,差异有统计学意义(P<0.05)。与模型组比较,温化方组、双氯芬酸钠组、抑制剂组大鼠血清TNF-α、IL-6和IL-1β均低,差异有统计学意义(P<0.05)。
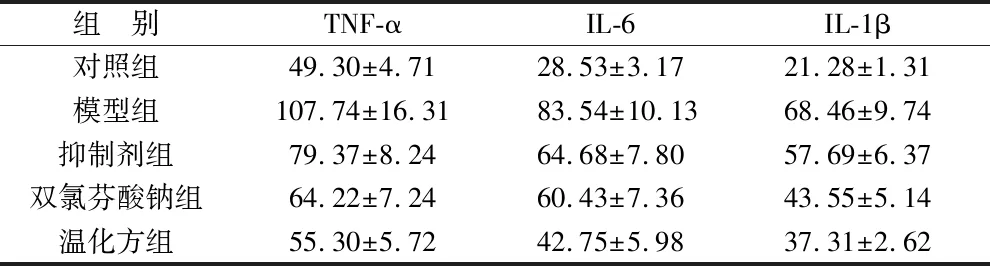
表3 各组大鼠血清TNF-α、IL-6 和 IL-1β比较(ng/L)
2.4 各组大鼠关节滑膜组织NF-κB p65 mRNA与NF-κB p65蛋白表达比较 见表4。以对照组为参照,其他各组的 NF-κB p65 mRNA及蛋白值均为与对照组的比值。与模型组比较,温化方组、双氯芬酸钠组、抑制剂组NF-κB p65 mRNA表达均低,差异有统计学意义(P<0.05)。与对照组比较,模型组NF-κB p65 蛋白表达水平较高,差异有统计学意义(P<0.05)。与模型组比较,温化方组、双氯芬酸钠组、抑制剂组、 NF-κB p65 蛋白表达均低,差异有统计学意义(P<0.05)。
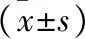
表4 各组大鼠关节滑膜组织NF-κB p65 mRNA与NF-κB p65蛋白表达比较
3 讨 论
KOA属于中医“膝痹”范畴。肝肾亏虚、瘀血阻滞是KOA的主要病机,肾主骨,肝主筋,膝为筋之府,故肝肾亏虚是发病基础,血瘀是重要因素[11]。长期机体失衡使患者产生关节肿胀、僵硬、疼痛等症状。临床常用健脾祛湿为主,温经通络为辅,治疗KOA[12]。温化方是我院治疗KOA的经验方剂,以黄芪防己汤合五苓散加减为组方。经多年临床研究,证实该方治疗KOA疗效较好。脾胃是后天之本,并且是生化之源。肝肾和气血的补充都依赖于后天之本,肝肾和,气血充足才能保证人体不受风寒湿外邪侵犯。以防己黄芪汤加味治疗,可以益气补肾,除湿活血。黄芪与防己配伍为君,固表祛风;白术、益母草、生甘草等为臣,发挥补气健脾祛湿等作用,而桂枝、泽泻和猪苓可以调和诸药[3]。
免疫炎症损伤是KOA重要的发病机制[13-14]。在这个过程中,NF-κB 信号通路的作用很重要[15]。NF-κB是转录因子,激活后可上调TNF-α、IL-6 和IL-1β等炎症因子表达,激活炎症反应[16]。另外,NF-κB还与凋亡、线粒体损伤等有关[17]。研究发现,NF-κB的激活与许多疾病的发生、发展有关,如肿瘤、心血管疾病、中枢神经系统疾病和骨关节疾病等[18-19]。既往研究发现,KOA患者关节滑液和外周血的NF-κB表达水平会升高,并且NF-κB信号通路的激活程度与软骨侵蚀和破坏程度呈正相关[7,20]。本研究发现,KOA大鼠血清和关节组织中NF-κB、TNF-α、IL-6 、IL-1β表达水平上调,与既往报道一致,提示NF-κB信号通路可能是KOA的治疗靶点。
在本研究中,相比模型组、温化方组、双氯芬酸钠组及抑制剂组的大鼠滑膜损伤和纤维增生明显减轻;相比模型组、温化方组、双氯芬酸钠组及抑制剂组的大鼠体重明显增加,关节肿胀度则降低。相比模型组,温化方组、双氯芬酸钠组、抑制剂组的RT-qPCR法和Western blot检测大鼠关节滑膜组织中NF-κB信号通路相关基因和蛋白表达水平均降低,提示温化方可有效改善膝骨关节炎大鼠临床症状,其机制可能与抑制NF-κB信号通路有关。
综上所述,温化方能抑制Ⅱ型胶原诱导的膝骨关节炎大鼠滑膜细胞中NF-κB信号通路,进一步阐明了温化方治疗KOA的作用机制。

