不同添加剂和发酵天数对残次枣营养成分及链格孢霉毒素含量的影响
杨劲松 邹婷婷 许 涛 刘 翻 刘利林,3* 周小玲,3*
(1.塔里木大学动物科学与技术学院,阿拉尔843300;2.南昌大学分析测试中心,江西省现代分析科学重点实验室,南昌330031;3.新疆生产建设兵团塔里木畜牧科技重点实验室,阿拉尔843300)
红枣是鼠李科枣属植物,红枣中含有丰富的多糖、维生素、氨基酸等营养成分,有较高营养价值[1]。我国红枣的产量从2013年的581.52万t跃升为2015年的713.45万t,近5年均保持在700万t左右,占世界枣产量的90%。由于虫害、病害、储存或加工不当等原因,产生了大量的残枣、次枣、裂枣、病枣等,统称为残次枣。新疆是我国产枣大省,枣果有30%左右是残次枣[2-3],2019年就约有110万t残次枣产生。残次枣的营养成分与正常枣接近,是良好的畜禽饲料的原料,具有抗氧化、缓解腹泻、提高免疫力等生理功能[1],具有重要开发利用价值。
然而,残次枣较普通枣存在更多的有毒有害成分。何丽等[4]报道,链格孢霉(Alternariaspp.)及其产生的链格孢霉毒素是主要风险因子之一。链格孢霉毒素主要包括交链孢酚(alternariol,AOH)、交链孢酚单甲醚(alternariol monomethyl ether,AME)、细交链格孢菌酮酸(tenuazonic acid,TeA)等[5],其中TeA含量最多且对畜禽毒害作用最大。饲粮中TeA含量在625 μg/kg左右可导致幼犬呕吐、出血性肠胃炎、死亡[6]。饲粮中TeA含量在630 μg/kg可使白来航鸡砂囊、脾脏病理改变及血管出血[6]。AOH、AME等毒素在体外有类雌激素活性,会导致猪DNA损伤和细胞周期阻滞[6-7]。Panigrahi等[8]研究显示,TeA、AOH、细格菌毒素-Ⅰ(alter-toxin-Ⅰ,ATX-Ⅰ)和交链孢霉烯(altenuene,ALT)在虾苗饲养水体中的半致死剂量(LD50)分别为75、100、200和375 μg/mL。TeA钠盐在小鼠和大鼠中的LD50为81~186 mg/kg(按体重计),且小鼠口服475 μg/kg BW的TeA就出现慢性中毒症状[9]。据何丽等[4]研究发现,病枣中TeA含量高达3 102.27 mg/kg。残次枣中链格孢毒素有潜在的饲用安全风险,有必要通过技术方法降低残次枣链格孢毒素含量。
目前关于降低链格孢毒素含量的研究较少,减少真菌毒素的常用方法有物理、化学和微生物学法[10]。植物乳杆菌是一种乳酸菌,通过产酸降低pH和提高电势差,从而抑制部分有害微生物生长,也通过产生细菌素或破坏真菌结构抑制微生物生长[11]。邢晓南等[12]研究添加复合菌剂(酿酒酵母、植物乳酸杆菌和枯草芽孢杆菌)固态发酵降低枣粉黄曲霉毒素B1和玉米赤霉烯酮含量。鼠李糖脂是一种阴离子生物表面活性剂,具有抑制腐霉病菌、疫霉病菌、灰霉病菌等有害真菌生长的作用[13-14],作为食品添加剂已得到广泛研究。现虽未列入我国农业部发布的《饲料添加剂品种目录》中,但已有研究发现它具有促进禽类肠道吸收和微生态平衡的作用[15],在生物添加剂领域具有重要应用前景[16]。丁酸钠具有保护动物胃肠道有益微生物菌群、抑制有害菌生长的作用,促使肠道微生物菌群平衡[17],作为防腐剂、防霉剂和酸度调节剂列入我国允许使用的饲料添加剂目录中,在各类养殖动物中均得以广泛使用。植物乳杆菌、鼠李糖脂及丁酸钠分别代表微生物、物理和化学手段,在降低毒素含量或防止毒素增加方面有积极作用,但在降低残次红枣链格孢毒素含量上鲜见报道。因此,本试验旨在研究这3种添加剂在不同发酵天数对残次枣营养成分及链格孢毒素含量的影响,为残次枣安全饲用提供数据支持。
1 材料与方法
1.1 试验材料
残次骏枣购于新疆阿拉尔市;植物乳杆菌P-8来自内蒙古大学(菌活数4×109CFU/g);鼠李糖脂来自浙江大学;丁酸钠购于某工业发展有限公司,分析纯。
腾毒素(tentoxin,TEN)、AME、TeA标准品购于多伦多化学研究所(加拿大);ALT、AOH标准品购于上海甄准生物科技有限公司(上海,中国);AAL毒素TA1(AAL toxin TA1,ATT-1)标准品购于武汉天植生物技术有限(武汉,中国)。
1.2 试验设计
将残次枣粉直接粉碎为2~4 mm的颗粒,添加3种添加剂,这3种添加剂的配制浓度分别为:1)植物乳杆菌:105(P1组)、106(P2组)、107CFU/g(P3组);2)鼠李糖脂:20(R1组)、40(R2组)、60 g/kg(R3组);3)丁酸钠:40(B1组)、80(B2组)、120 g/kg(B3组)。对照组(C组)添加等量蒸馏水,不添加任何添加剂。将处理好的样本置于装有单向阀的食用真空袋,用单室真空包装机DZQ 500-1D(上海三联包装机械有限公司,上海,中国)抽真空并密封后,在室温(20~25 ℃)发酵0、15、45和60 d。每组12个重复。
1.3 样品采集与pH测定
取各组发酵0、15、45和60 d时的样本,各组每个时间点分别取3个,开袋并混匀。立即称取10 g样品加入90 mL蒸馏水,搅拌15 min后用经校准的PE 28型pH计(梅特勒-托利多仪器有限公司,上海,中国)测定pH。另取200 g样品于65 ℃烘干约24 h,冷却后粉碎过40目筛,放入-20 ℃冰箱,备测营养成分。此外,在发酵60 d时,另取100 g样品直接放入-20 ℃冰箱,备测链格孢霉毒素含量。
1.4 指标测试与分析
取5 g样品,在105 ℃下用烘箱烘至恒重,测定水分含量[18]。分别取1 g样品,用凯氏定氮法-半微量蒸馏法测定粗蛋白质(CP)含量;用索氏浸提法测定粗脂肪(EE)含量;用Van Soest法测定酸性洗涤纤维(ADF)含量,具体测量方法参考张丽英[18]主编的《饲料分析与饲料质量检测技术》。
1.5 链格孢毒素含量测试与分析
直接冻存的残次枣样品在-60 ℃下用冻干机(Labconco公司,美国)冻干后,取10 g样品研磨粉碎后送往南昌大学分析测试中心,用LC-30A超高效液相色谱(岛津公司,日本)-串联质谱仪(型号Triple TOF-5600+,AB Sciex公司,美国)进行检测。首先称取0.2 g枣粉样品,加入4 mL乙腈(含2%乙酸)溶液后振荡混匀,在室温下超声提取30 min;再加入0.2 g NaCl,振荡2 min;通过1 591 r/min离心10 min后过膜。采用外标法定量。采用ESI源,正离子模式。色谱柱:Shim-pack GIST-C18,2.1 mm×75 mm,2 μm;柱温:30 ℃;进样量5 μL;流速:0.3 mL/min;流动相A:0.1%甲酸水,B:乙腈,进行梯度洗脱。一级质谱:DP 40 V CE 10 eV,采集范围180~550 m/z。二级质谱条件见表1。

表1 超高效液相色谱-串联质谱仪二级质谱条件
1.6 数据处理
数据经Excel 2019软件计算处理后,采用SPSS 19.0统计软件的一般线性模型进行显著性检验,以处理方法、发酵天数及其交互作用为固定因素,多重比较采用LSD法,P<0.05为差异显著。
2 结果与分析
2.1 植物乳杆菌添加浓度和发酵天数对残次枣营养成分和pH的影响
如表2所示,与C组相比,P3组水分含量降低12.39%(P<0.05),P1、P2和P3组的CP含量分别增加13.80%、12.67%、9.43%(P<0.05),P2和P3组的EE含量分别降低17.86%、32.59%(P<0.05)。与P1组相比,P3组水分、ADF含量分别降低11.27%(P<0.05)、9.21%(P>0.05)。

表2 植物乳杆菌添加浓度和发酵天数对残次枣营养成分和pH的影响(风干基础)
与发酵0 d相比,发酵45、60 d时,水分含量分别增加9.27%、10.24%(P<0.05),发酵15、45、60 d时,CP含量分别增加14.35%、22.49%、23.44%(P<0.05),发酵15、45、60 d时,pH显著降低(P<0.05);与发酵15 d相比,发酵45、60 d时,水分含量分别降低9.27%、10.24%(P<0.05),pH显著降低(P<0.05)。
2.2 鼠李糖脂添加浓度和发酵天数对残次枣营养成分和pH的影响
如表3所示,与C组相比,R1、R2、R3组水分含量分别增加3.50%、2.79%、7.73%(P<0.05),R2、R3组CP含量分别增加9.05%、14.03%(P<0.05)。与R1组相比,R3组水分含量增加4.09%(P<0.05),R2、R3组CP含量分别增加15.58%、20.86%(P<0.05)。与R2相比,R3组水分、CP含量分别增加4.81%、4.56%(P<0.05)。
与发酵0 d相比,发酵60 d时,水分、ADF含量及pH分别降低2.21%(P>0.05)、19.89%(P>0.05)、2.87%(P<0.05);与发酵15 d相比,发酵60 d时,水分、CP、EE含量分别降低3.06%(P>0.05)、15.44%(P<0.05)、37.63%(P>0.05),pH显著降低(P<0.05);与发酵45 d相比,发酵60 d时,pH显著降低(P<0.05)。
2.3 丁酸钠添加浓度和发酵天数对残次枣营养成分和pH的影响
如表4所示,与C组比较,B2组水分含量增加6.92%(P<0.05),B1、B2、B3组EE含量分别降低33.03%、28.57%、8.04%(P<0.05),B3组pH显著升高(P<0.05)。与B1组比较,B2组水分含量增加5.62%(P<0.05),B3组EE含量增加37.33%(P<0.05),pH显著增加(P<0.05)。与B2组比较,B3组EE含量增加28.75%(P<0.05),pH显著增加(P<0.05)。
与发酵0 d相比,发酵60 d时,水分、ADF含量分别降低5.41%(P<0.05)、16.46%(P>0.05),发酵60 d时,CP含量升高10.96%(P>0.05),发酵45、60 d时,EE含量分别降低27.21%、31.95%(P<0.05),发酵15、45、60 d时,pH显著降低(P<0.05);与发酵15 d相比,发酵60 d时,水分含量降低6.72%(P<0.05),pH显著降低(P<0.05),发酵45、60 d时,EE含量下降36.26%、40.14%(P<0.05);与发酵45 d相比,发酵60 d时,pH显著降低(P<0.05)。
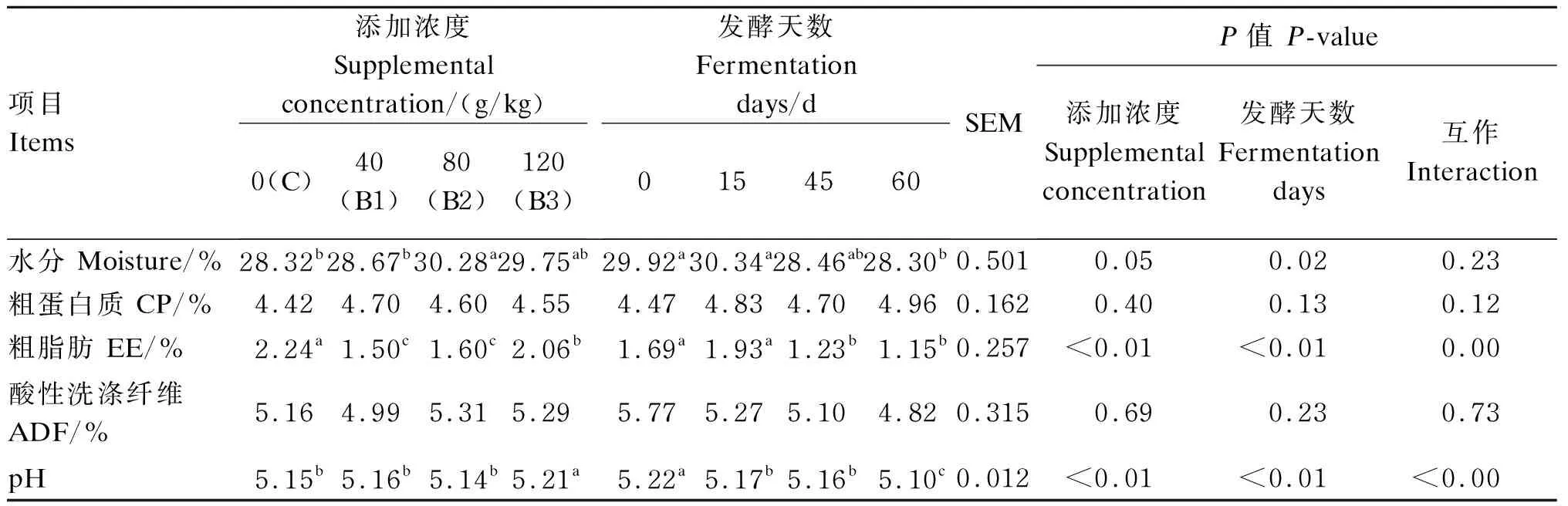
表4 丁酸钠添加浓度和发酵天数对残次枣营养成分和pH的影响(风干基础)
2.4 3种添加剂对发酵残次枣链格孢霉毒素含量的影响
如表5所示,与C组相比,添加不同浓度植物乳杆菌发酵后,TeA含量降低30%~60%,添加植物乳杆菌组中降低TeA含量效果为P1组>P2组>P3组。添加鼠李糖脂发酵后,TeA含量降低60%~70%,鼠李糖脂各浓度对降低TeA含量的影响效果为R3组>R2组>R1组。添加丁酸钠发酵后,TeA含量降低45%~60%,丁酸钠对降低TEA含量的影响效果为B1组>B3组>B2组。
除TeA外,发现残次枣中还含少量AOH、AME、TEN和ATT-1。各样本中均未检测出ALT。添加植物乳杆菌能一定程度上减少AOH、AME、ATT-1、TEN含量。添加鼠李糖脂和丁酸钠组中几乎未检测出AOH、AME、ATT-1、TEN。

表5 3种添加剂发酵60 d对链格孢毒素含量的影响(风干基础)
3 讨 论
3.1 添加植物乳杆菌发酵对残次枣营养成分及链格孢霉毒素含量的影响
植物乳酸菌是一种兼型发酵乳酸菌,在饲料发酵过程中通过产生乳酸和乙酸降低pH,起到抑制有害微生物并长期保存饲料原料的作用。本研究中,添加3种浓度的植物乳杆菌发酵能够都使pH下降,CP含量提高。饲料发酵过程中CP含量的变化与pH高低密切相关,pH越低可更加有效抑制微生物及植物蛋白酶对蛋白质的降解,减少蛋白质损失[19]。同时,植物乳杆菌添加剂中含有菌体蛋白,增加了发酵枣粉中的CP含量。类似地,黄媛等[20]也发现,添加乳酸菌后增加构树青贮饲料中蛋白质含量。水分和脂肪含量随植物乳杆菌的添加浓度增加而降低。而黄媛等[20]报道,用青贮密封袋经乳酸菌发酵后水分含量减少和EE含量增加,推测本试验中水分和EE含量都降低是由于较高浓度添加组中存在较强的微生物代谢活性,消耗了较多的碳源,产气量多,经单向阀排出的蒸发损失较多所致。添加106和107CFU/g的植物乳杆菌降低了ADF含量。ADF是饲料中动物难以消化的一部分,这类物质过多会影响动物的消化吸收,动物消化率呈负相关,研究表明添加植物乳杆菌后能降低ADF含量,改善饲料品质。在不同发酵时间下,EE和ADF含量没有变化,水分含量和pH随发酵时间降低,而CP含量随发酵时间增加。
本试验结果表明,用3种浓度的植物乳杆菌处理后,发酵红枣中TeA含量均降低;105CFU/g植物乳杆菌能使TeA含量降低60%。AME、ATT-1和TEN含量也有不同程度的减少。目前关于植物乳杆菌对链格孢毒素降解的研究鲜见报道,但前人研究发现,植物乳杆菌可通过降低pH抑制真菌生长,且可利用发酵基质中的营养物质发酵生成抑真菌物质[21]。Ge等[22]发现乳杆酸对链格孢毒素有吸收作用,其作用机制与细胞表面的多糖和蛋白组分中C-O、O-H和N-H基团有关。乳酸菌的这些功能特性,有助于解释本研究中添加植物乳杆菌对残次枣粉中TeA含量的减少作用。其中105CFU/g植物乳杆菌降低TeA含量的效果比较高浓度植物乳杆菌效果更佳,这可能是植物乳杆菌与残次枣中其他微生物发生互作效应,其中机制还需要深入探究。
3.2 添加鼠李糖脂发酵对残次枣营养成分及链格孢霉毒素含量的影响
鼠李糖脂是一种由铜绿假单胞菌(Pseudomonasaeruginosa)发酵产生的一种生物表面活性剂,对多种植物真菌病害有较好的防治效果[14]。鼠李糖脂通过改变细胞表面的疏水性及细胞表面电荷性质,从而改变微生物生态[13]。同时鼠李糖脂通过增加溶解碳氢化合物、改变微生物代谢酶活性,从而增加微生物降解有机物的能力[23],发酵饲料营养物质的损失主要始于微生物的呼吸作用,微生物利用碳水化合物及其他营养成分合成CP,产生H2O、CO2且释放热量[24]。在本试验中发现,添加3种浓度的鼠李糖脂后水分含量上升,DM含量下降,CP含量上升。这可能就是微生物降解有机物能力增加的结果,并且随着发酵天数的增加,CP、EE、ADF含量均下降。
本研究发现,3种浓度鼠李糖脂能够有效地减少链格孢霉毒素含量,对TeA的清除作用可达70%以上。经广泛查询国内外资料,迄今为止,少见鼠李糖脂对链格孢毒素降解或转化影响的研究资料。最近,Rodrigues等[25]揭示鼠李糖脂可破坏黄曲霉结构,降低黄曲霉毒素的产生。从本研究结果来看,我们尚不能确定鼠李糖脂发酵降低链格孢霉菌毒素含量的原因是否与此类似,推测可能在于鼠李糖脂与发酵基质中微生物菌群的协同作用有关。由于本试验未测定微生物区系变化,其具体机制尚待阐明。
3.3 添加丁酸钠发酵对残次枣营养成分及链格孢霉毒素含量的影响
丁酸钠常被用于保护动物肠道绒毛发育,改善肠道黏膜结构,增强肠道免疫力,提高饲粮消化率,降低肠道pH并改善肠道微生物环境[26]。添加3种浓度的丁酸钠不影响枣粉CP和ADF含量,但在添加高浓度的丁酸钠后,pH上升,这是由于丁酸钠为弱碱性物质,丁酸钠水解后溶液呈碱性有关[27]。发酵时间对丁酸钠组中水分、ADF、EE等营养成分含量的影响与鼠李糖脂组基本一致。
目前,丁酸钠对链格孢霉毒素含量的影响鲜有研究。本试验观察到,丁酸钠能够使TeA含量降至C组的45%,尤其以8%的丁酸钠添加浓度效果较好,可以使TeA含量降低至70%。丁酸钠是抑制微生物生长的一种有效防腐剂,其生物学功能源于丁酸,丁酸是短链脂肪酸的一种[28],能够抑制真菌的生长,丁酸钠可显著提高仔猪菌群多样性和丰富度[29]。目前,鲜有关于丁酸或丁酸钠与真菌毒素降解直接关联的报道,我们推测丁酸钠对链格孢毒素的降解作用与丁酸钠改变发酵枣中的菌群结构、优势菌群与丁酸共同作用提高了对链格孢霉毒素的降解或转化有关,需进一步验证。
4 结 论
本试验在残次枣中添加植物乳杆菌及丁酸钠,发酵60 d后,能够降低ADF含量,增加CP含量。鼠李糖脂降低了残次枣的营养价值,但降低毒素含量效果更好。残次枣中含大量TeA及少量AOH、AME、TEN和ATT-1。残次枣通过发酵可以降低链格孢霉毒素含量,添加植物乳杆菌、鼠李糖脂、丁酸钠后降低毒素效果更佳。与C组比较,添加105CFU/g 植物乳杆菌,TeA含量降低了59.97%;添加60 g/kg鼠李糖脂,TeA含量降低了69.99%;添加40 g/kg丁酸钠,TeA含量降低了59.82%。

