2022年高考化学模拟试题
王季常


本试卷共21小题,满分100分。考试用时75分钟。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 S 32 Ni 59 Ga 70
一、单项选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。每小题只有一个选项符合题意。
1. 中国传统文化中蕴含着许多化学知识。下列说法正确的是
A.“堇荼如饴”里的“饴”是指糖类,糖类均有甜味
B.“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”里的“碱”是 K2CO3
C.“世间丝、麻、裘、褐皆具素质…”文中的“丝、麻、裘、褐”主要成分均是蛋白质
D.“古人以剂钢为刃,柔铁为茎干,不尔则多断折”里的“劑钢”的硬度比纯铁的大,熔点比纯铁的高
2. 下列叙述不正确的是
A. 中国古代利用明矾溶液的酸性来除铜镜的铜锈
B. 用标准盐酸溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
C. 配制0.1 mol·L-1 Na2CO3溶液480 mL,需选用500 mL容量瓶
D. 洗涤脱排油烟机表面的油脂污物时,热的纯碱溶液比冷的去污效果好
3. 下列食品添加剂中,其使用目的与反应速率有关的是
A. 增稠剂B. 调味剂C. 着色剂D. 抗氧化剂
4. 下列说法正确的是
①CH3COONa、BaSO4都是强电解质;②陶瓷、玻璃、水泥都属于硅酸盐材料;③合成纤维、光导纤维都是有机高分子化合物;④ 0.1 mol·L-1NaOH溶液与0.1 mol·L-1Ba(OH)2溶液的pH相同;⑤适量CO2分别通入饱和碳酸钠溶液和澄清石灰水中,都会出现浑浊。
A. ①②④B. ①②⑤C. ②③⑤D. ③④⑤
5. 下列关于有机物的叙述正确的是
A. 液化石油气、汽油和石蜡的主要成分都是碳氢化合物
B. 环己烷与苯可用酸性KMnO4溶液鉴别
C. 由CH2=CH-COOCH3合成的聚合物为 [[ ]][n][CH2-CH-COOCH3]
D. 能与NaOH溶液反应且分子式为C2H4O2的有机物一定是羧酸
6. 我国科学家提出用CO2置换可燃冰(mCH4·nH2O)中CH4的设想,置换过程如图1所示,下列说法正确的是
A. 笼状结构中水分子间主要靠氢键结合
B. E代表CO2,F代表CH4
C. CO2置换出CH4的过程是化学变化
D. CO2可置换可燃冰中所有的CH4分子
7. 工业上用发烟HC1O4将潮湿的CrC13氧化为棕色的烟[CrO2(C1O4)2],来除去Cr(Ⅲ),HC1O4中部分氯元素转化为最低价态。下列说法正确的是
A. CrO2(C1O4)2中Cr元素显+3价
B. HC1O4属于强酸,该反应还生成了另一种强酸
C. 该反应中,参加反应的氧化剂与氧化产物的物质的量之比为8 ∶ 3
D. 该反应离子方程式为19ClO-
4+8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O
8. 下列离子方程式正确的是
A. 用醋酸除水垢:CaCO3 + 2H+=Ca2+ + CO2↑+H2O
B. 向溴化亚铁溶液中通入足量氯气:2Br-+Cl2=Br2 +2Cl-
C. 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+ H2O
D. NO2通入水中制硝酸:2NO2+H2O=2H++NO3-+NO
9. 有机化合物甲与乙在一定条件下可反应生成丙:
下列说法正确的是( )
A. 甲与乙生成丙的反应属于取代反应
B. 甲分子中所有原子共平面
C. 乙的一氯代物有3种
10. 设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2 L HF所含的原子总数为NA
B. 用惰性电极电解CuSO4溶液,当阴极产生22.4L气体时,转移的电子数为2NA
C. 2L 0.1 mol·L-1Na2SiO3溶液中含SiO32-的数目为0. 2 NA
D. 向1L 0.5 mol·L-1盐酸溶液中通入NH3至中性(忽略溶液体积变化),此时NH4+个数为0.5NA
11. 下列实验操作能达到实验目的的是
A. 用装置甲从碘水中萃取碘
B. 用装置乙验证SO2的漂白性
C. 用装置丙检验溶液中是否有K+
D. 用装置丁将FeCl3溶液蒸干制备FeCl3
12. 我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如4所示。
下列说法错误的是( )
A. ①→②放出能量并形成了C—C键
B. 生成CH3COOH总反应的原子利用率为100%
C. CH4→CH3COOH过程中,有C—H键发生断裂
D. 该催化剂可有效提高反应物的平衡转化率
13. 甲、乙、丙、丁都是短周期元素,其中甲、丁在周期表中的相对位置如下表所示,甲原子最外层电子数是其内层电子数的2倍,乙单质在空气中燃烧发出黄色火焰,丙是地壳中含量最高的金属元素。下列判断正确的是
A. 原子半径:丙>丁
B. 甲与丁的核外电子数相差10
C. 氢氧化物碱性:乙<丙
D. 甲、乙的最高价氧化物均是共价化合物
14. 常温下,浓度均为0.1 mol·L-1的下列溶液中,粒子的物质的量浓度关系正确的是
A. 氨水中,c(NH4+)=c(OH-)=0.1 mol·L-1
B. NH4Cl溶液中,c(NH4+)>c(Cl-)
C. Na2SO4溶液中,c(Na+)>c(SO42-)>c(OH-)=c(H+)
D. Na2SO3溶液中,c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
15. 鎂-次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图5所示:
下列关于该电池的说法错误的是
A. 铂合金为正极,附近溶液的碱性增强
B. 电池工作时,OH-向镁合金电极移动
C. 电池工作时,需要不断添加次氯酸盐以保证电解质的氧化能力
D. 若电解质溶液为H2O2,硫酸和NaCl的混合液,则正极反应为H2O2+2e-=2OH-
16. 25℃时,向20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图6所示:
下列说法正确的是
A. 25℃时,CH3COOH的电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
二、非选择题:本题共5小题,每小题14分。第17~19题为必考题。第20~21题为选考题,考生选择其中一道题作答。
(一)必考题:共42分。
17.(14分)
SO2的防治与利用对于环境保护意义重大。某小组在实验室中对SO2的性质及回收利用等相关问题进行探究。
(1)用图7所示装置制备纯净的SO2,发生装置中反应的化学方程式为________,装置的连接顺序为:a→________(按气流方向,用小写字母表示)。
(2)用图8所示装置探究SO2的性质。限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、FeCl3溶液、淀粉-KI溶液、新制H2S溶液。
(3)工业上回收利用SO2的一种途径是:
该小组在实验室探究步骤Ⅱ时,一定条件下向100mL c0 mol·L-1的(NH4)2SO3溶液通入空气后,欲测定溶液中(NH4)2SO3的氧化率(α)。
① 为该小组设计实验方案(不必描述操作过程的细节,物理量的数值用字母表示):
___________________________________________________________________________________________________________________________________________________________
② α =________×100%(用实验方案中的物理量表示)。
18.(14分)
过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成不利影响,因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂成为热点。以下是以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程:
上表列出相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算):
回答下列问题:
(1)“酸浸”时通入SO2的目的是 _____________,反应的离子方程式为____________。
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)?ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_______________________。
(3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是________________。
(4)用得到的CoCO3等为原料采用微波水热法和常规水热法可以制得两种CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图10是两种不同方法制得的CoxNi(1-x)Fe2O4在10 ℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。
由图中信息可知:__________法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是__________。
(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中=_________。
[已知Ksp(CoC2O4)=6.3×10-8;Ksp(CoCO3)=1.4×10-13]
19.(14分)
催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g) + 3H2(g) ? CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CO2(g) + H2(g) ? CO(g)+H2O(g) ΔH2 II
某实验室控制CO2和H2初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
已知:① CO和H2的燃烧热分别为ΔH=-283.0kJ·mol-1和ΔH=-285.8kJ·mol-1
② H2O(l)=H2O(g) ΔH3=+44.0kJ·mol-1
回答下列问题(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=________;反应II的ΔH2=________kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有________。
A. 使用催化剂Cat.1 B. 使用催化剂Cat.2
C. 降低反应温度 D. 投料比不变,增加反应物的浓度
E. 增大CO2和H2的初始投料比
(3)对比实验a和c可发现:相同催化剂下,温度升高,CO2转化率升高,而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因________。对比实验a和b可发现:相同温度下,采用Cu/ZnO纳米片使CO2转化率降低,而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因________。
(4)在下图中分别画出反应I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图。
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在________极,该电极反应式是________。
(二)选考题:本题包括2小题,每小题14分,考生只能选做一题。
20.[选修3:物质结构与性质](14分)
镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为__________;与硒同周期的p区元素中第一电离能大于硒的元素有__________种;SeO3的空间构型是__________。
(2)根据元素周期律,原子半径Ga_____As,第一电离能Ga______As。(填“大于”或“小于”)
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是________。硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4、SiBr4,上述四种物质沸点由高到低顺序为_______________,丁硅烯(Si4H8)中σ键与π键个数之比为_________。
(4)GaN、GaP、GaAs都是很好的半导体材料,熔点如下表所示,分析其变化原因___________。
(5)GaN晶胞结构如图11所示。已知六棱柱底边边长为a pm,阿伏加德罗常数的值为NA。
①晶胞中Ga原子采用六方最密堆积,每个Ga原子周围距离最近的Ga原子数目为______;
②从GaN晶体中“分割”出的平行六面体如图12。若该平行六面体的高为a pm,GaN晶体的密度为__________g/cm3(用a、NA表示)。
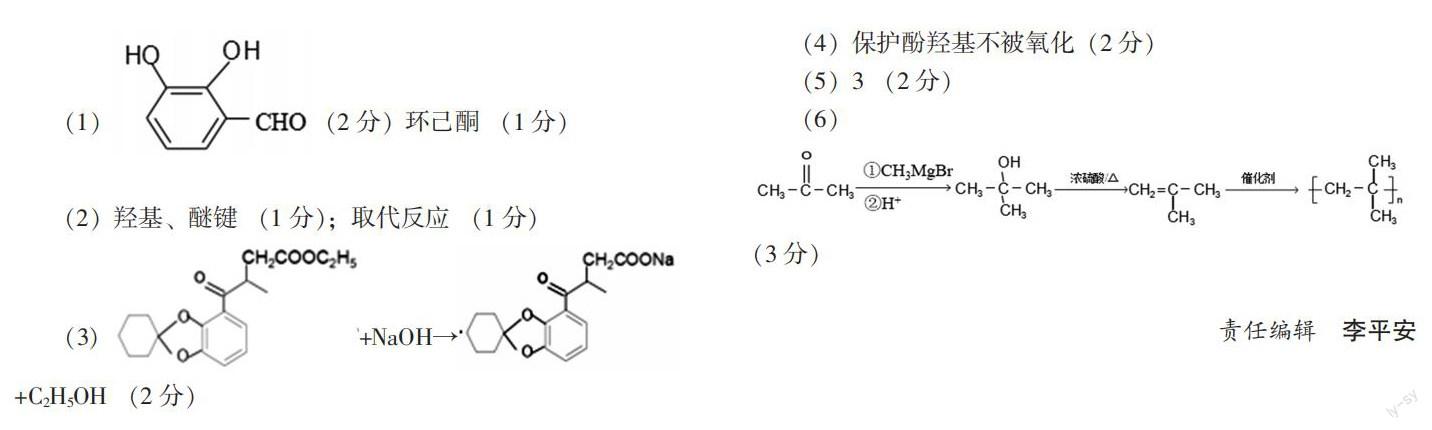
21.[选修5:有机化学基础](14分)
已知:
回答下列问题:
(1)A的结构简式为______;试剂X的化学名称为______。
(2)C中官能团的名称为______;由D生成E的反应类型为______。
(3)由E生成F的第①步反应的化学方程式为______。
(4)设计由A转化为B和由F转化为M两步的目的为______。
(5)为M的同分异构体,同时满足下列条件的结构有______种(不含立体异构)。
①只含两种官能团,能发生显色反应,且苯环上连有两个取代基。
②1mol最多能与2molNaHCO3反应。
③核磁共振氢谱有6组吸收峰。
(6)参照上述合成路线和信息,设计以丙酮和CH3MgBr为原料(其他试剂任选),制备聚异丁烯的合成路线:______。
参考答案
一、选择题:本题共16小题,共44分。
第1~10小题,每小题2分;第11~16小题,每小题4分。
1. B 2. B 3. D 4. B 5. A 6. A 7. B 8. C 9. C 10. D 11. A 12.D 13. A 14. C 15. D 16. C
二、非选择题:共56分。第17~19题为必考题,第20~21题为选考题。
17.(14分)
(1)H2SO4+2NaHSO3=2SO2↑+2H2O+Na2SO4 (1分)
b→c→g→f→d (3分)
(2)①氧化 (1分)
②FeCl3 (1分)
③溶液由棕黃色变成浅绿色 (1分)
④SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ (2分)
(3)方案1:
① 取20.00 mL反应后的溶液于锥形瓶中,用浓度为c mol·L-1的KMnO4标准溶液滴定,重复滴定三次,平均消耗KMnO4溶液的体积是V mL (3分)
② (2分)
方案2:
① 向反应后的溶液中加入过量盐酸,再加入足量BaCl2溶液,将沉淀过滤、洗涤、干燥、称量,质量为mg (3分)
② (2分)
18.(14分)
(1)将Co3+转化为Co2+(2分) 2Co3++SO2+2H2O=2Co2++SO[2
4][-]+4H+(2分)
(2)向有机层中加入适量的硫酸溶液充分振荡,静置,分液,取水层(2分)
(3)防止加入过快而产生Co(OH)2沉淀(或其他合理答案) (2分)
(4)微波水热(2分) Co2+(2分)
(5)2.2×10-6(2分)
19.(14分)
(1) (1分) +41.2 (2分)
(2)C D (2分)
(3)反应Ⅰ为放热反应,反应II为吸热反应,催化剂相同的条件下,升高温度有利于CO2转化为CO,不利于转化为CH3OH,甲醇的选择性降低。(1分)
相同温度下,催化剂Cat.2对反应I催化效率更高,相同时间内得到的甲醇较多,甲醇选择性提高。 (1分)
(5)阴 (2分)
CO2 + 6H+ + 6e-=CH3OH + H2O (2分)
20.(14分)
(1)[Ar]3d104s24p4(1分) 3(1分)平面正三角形(1分)
(2)大于(1分) 小于(1分)
(3)4 SiBr4>SiCl4>Si2H6>SiH4(1分) 11∶1 (2分)
(4)三者均为原子晶体,原子半径N
(5)12(2分) ×1030 (2分)
21.(14分)
(2)羟基、醚键 (1分);取代反应 (1分)
(4)保护酚羟基不被氧化(2分)
(5)3 (2分)
(6)
(3分)
责任编辑 李平安

