PPARβ调控硝化应激参与高糖对内皮细胞的损伤
阳 创,熊宝萍,郑雲丹,李斯曼,周上钧,蒋青松
(重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,重庆药物代谢学重点实验室,重庆 400016)
长期慢性高血糖是糖尿病的主要特征。持续血糖水平升高破坏血管内皮结构和功能,是糖尿病血管病变最重要的病理基础之一[1]。在内皮细胞中,高血糖诱导应激反应,包括氧化应激和硝化应激,产生过量的活性氧和活性氮,使自由基清除平衡被破坏,从而引起DNA、蛋白质和细胞膜的损伤。现有研究表明,抑制氧化应激反应可以改善血管内皮损伤[2],但对硝化应激在糖尿病内皮细胞损伤中的作用研究则相对较少。在病理过程中,过量活性氮物质如过氧亚硝酸盐(OONO-)的生成是硝化应激反应的重要特征,最终导致一氧化氮(nitric oxide,NO)生物利用度降低。既往研究表明,活性氮物质也可引起DNA损伤,损害内皮细胞功能[3]。因此,硝化应激在内皮损伤中相关机制的研究对糖尿病血管并发症的防治可能具有重要意义。过氧化物酶体增殖物激活受体β(peroxidase proliferator activated receptor,PPARβ)是核受体超家族成员之一,可能是预防和治疗糖尿病及其并发症的潜在靶标[4]。研究发现,激活PPARβ 可以减轻氧化应激,改善糖尿病小鼠的内皮功能[5-6]。然而,目前国内外尚未见PPARβ与硝化应激在高糖引起内皮细胞损伤中关系的研究。
本研究拟利用高糖孵育人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),分别给予PPARβ激动剂GW0742、PPARβ拮抗剂GSK0660和一氧化氮合成酶(nitric oxide synthase,NOS)抑制剂亚硝基左旋精氨酸甲酯(NG-nitro-L-arginine methyl ester,L-NAME),初步观察PPARβ与硝化应激在高糖损伤内皮功能中的作用。
1 材料与方法
1.1 材料
1.1.1细胞 HUVECs(SWEXB11506)购于武汉塞维尔生物科技有限公司。
1.1.2试剂 DMEM低糖培养基(C11885500BT)购于美国Gibco公司;胎牛血清(SMK110.01)购于赛米克生物技术公司;BCA蛋白定量测定试剂盒(B09900190)购自北京鼎国昌盛生物公司;peroxynitrite assay试剂盒(ab233468)购自美国Abcam公司;EdU-488细胞增殖检测试剂盒(C0071)、NO检测试剂盒(S0023)、L-NAME(S0006)、D-葡萄糖(D-glucose,ST1127)均购自上海碧云天生物技术有限公司;GW0742(HY-13928)、GSK0660(HY-12377) 均购于美国MCE公司;eNOS小鼠单克隆抗体(SC-136977)、PPARβ小鼠单克隆抗体(SC-74517)购自美国Santa Cruz公司;CCK-8细胞活力及毒性检测试剂盒(BA00208)、3-nitrotyrosine兔多克隆抗体(bs-8551R)购自博奥森生物科技公司;iNOS兔多克隆抗体(18985-1-AP)、GAPDH小鼠单克隆抗体(60004-1-Ig)购自武汉Proteintech公司;ECL化学发光显影液(BL520A)购自北京Biosharp公司。其余试剂为国产分析纯。
1.1.3仪器 细胞培养箱(Thermo);细胞培养超净台(安泰技术有限公司);倒置荧光显微镜(Nikon);低温离心机(Thermo);湿式转膜仪(Bio-Rad);垂直电泳槽(Bio-Rad);凝胶成像系统(Tanon);酶标仪(Thermo)。
1.2 方法
1.2.1细胞培养 HUVECs细胞在37 ℃、5%CO2的培养箱内用含10%胎牛血清的低糖DMEM培养液中培养,每48 h换液,待细胞生长达到80%~90%可进行传代,取第3~6代细胞进行实验。
1.2.2细胞活力检测 将HUVECs细胞以5×103个/孔接种于96孔细胞培养板中,每组4个复孔,待细胞贴壁后换为无血清的低糖DMEM同步化24 h,随后以含葡萄糖30、40、50 mmol·L-1以及甘露醇30 mmol·L-1(渗透压对照组)的培养液处理48 h,每孔加入10 μL CCK-8溶液,于培养箱孵育1 h后,在酶标仪450 nm处测定吸光度。
1.2.3实验分组 将细胞在不含血清的低糖DMEM培养基中同步化24 h后,给予相应药物干预48 h后检测。分组如下:① 正常葡萄糖对照组(NG,glucose 5.5 mmol·L-1);② 高葡萄糖组(HG,glucose 30 mmol·L-1);③ 高糖+PPARβ激动剂组(HG+GW0742 1 μmol·L-1);④ 高糖+PPARβ激动剂+PPARβ拮抗剂组(HG+GW0742 1 μmol·L-1+GSK0660 1 μmol·L-1);⑤ 高糖+PPARβ激动剂+NOS抑制剂组(HG+GW0742 1 μmol·L-1+L-NAME 10 μmol·L-1)。
1.2.4细胞增殖检测 将细胞以5×104个/孔接种于24孔细胞培养板中,根据实验分组采用相应药物干预后,去除培养液,按照EdU-488细胞增殖检测试剂盒说明书操作,将细胞与EdU染液于37 ℃孵育2 h,用4%多聚甲醛固定,使用Hoechst 33342进行细胞核染色,采用荧光显微镜观察结果,计算细胞阳性染色百分率作为增殖率。
1.2.5Western blot检测蛋白的表达 收集细胞,加入裂解液后冰上裂解30 min,14 000×g离心15 min,取上清,BCA法测蛋白浓度。蛋白上样量为30 μg。经SDS-PAGE凝胶电泳,转至PVDF膜后用5%的脱脂奶粉室温封闭2 h,分别加入相应抗体,即抗PPARβ(1 ∶500),抗eNOS(1 ∶500),抗3-nitrotyrosine(1 ∶500),抗iNOS(1 ∶1 000),抗GAPDH(1 ∶10 000),4 ℃孵育过夜,TBST洗膜后加入相应二抗(1 ∶5 000)室温孵育2 h,再次洗膜,通过ECL显影,采用化学发光成像系统曝光。
1.2.6OONO-水平检测 将HUVEC以2×104个/孔接种于黑色透明底的96孔酶标板中,过夜待细胞贴壁后,根据Peroxynitrite Assay试剂盒操作说明,按照实验分组,加入90 μL相应分组的培养液,与10 μL Peroxynitrite Sensor Green工作液共同在37 ℃孵育2 h后,在Ex/Em=490/530 nm处测量荧光强度,以相对荧光单位(relative fluorescence units,RFU)代表OONO-的水平。
1.2.7NO含量检测 将HUVEC以2×105个/孔接种于6 cm细胞培养皿中,按实验分组给予相应药物干预48 h,取培养液上清,按试剂盒操作说明,加入Griess Reagent I,Griess Reagent Ⅱ混匀,于酶标仪测定540 nm处吸光度,根据标准曲线计算NO浓度。

2 结果
2.1 高糖对HUVECs细胞活力的影响如Fig 1所示,高浓度葡萄糖(30、40、50 mmol·L-1)使细胞活力明显降低。与正常葡萄糖浓度(5.5 mmol·L-1)比较,分别降低至(79.95±2.36)%、(72.32±5.17)%和(65.05±3.60)% (P<0.01)。甘露醇(30 mmol·L-1)对细胞活力没有明显影响(P>0.05)。
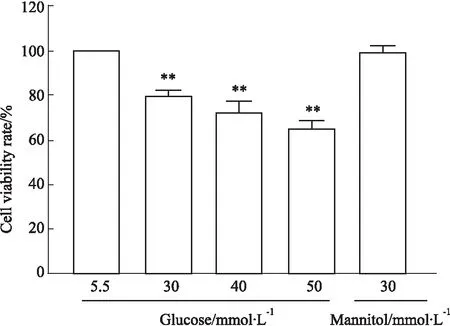
Fig 1 Effect of glucose at different concentrations on cell viability of HUVECs
2.2 高糖对HUVECs细胞增殖的影响综合文献[7]及细胞活力结果,以葡萄糖30 mmol·L-1为高糖(HG)进行后续实验。Fig 2结果显示,高糖处理明显抑制HUVEC的增殖能力(P<0.01)。GW0742(1 μmol·L-1)可恢复被高糖损伤的HUVECs的增殖能力(P<0.01)。GSK0660(1 μmol·L-1)和L-NAME(10 μmol·L-1)均可取消GW0742的作用(P<0.01)(Fig 2)。
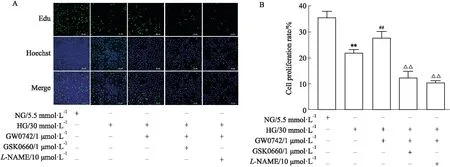
Fig 2 Effect of glucose at 30 mmol·L-1 (HG)on cell proliferation of HUVECs
2.3 高糖对PPARβ、eNOS、iNOS、3-nitrotyrosine蛋白表达的影响如Fig 3所示,高糖孵育使HUVECs的PPARβ及eNOS蛋白表达明显降低(P<0.05),但iNOS和3-nitrotyrosine表达增加(P<0.05)。GW0742(1 μmol·L-1)可上调PPARβ及eNOS蛋白的表达(P<0.05),并下调iNOS和3-nitrotyrosine蛋白的表达(P<0.05)。GSK0660(1 μmol·L-1)和L-NAME (10 μmol·L-1)均可取消GW0742的作用(P<0.05)(Fig 3)。
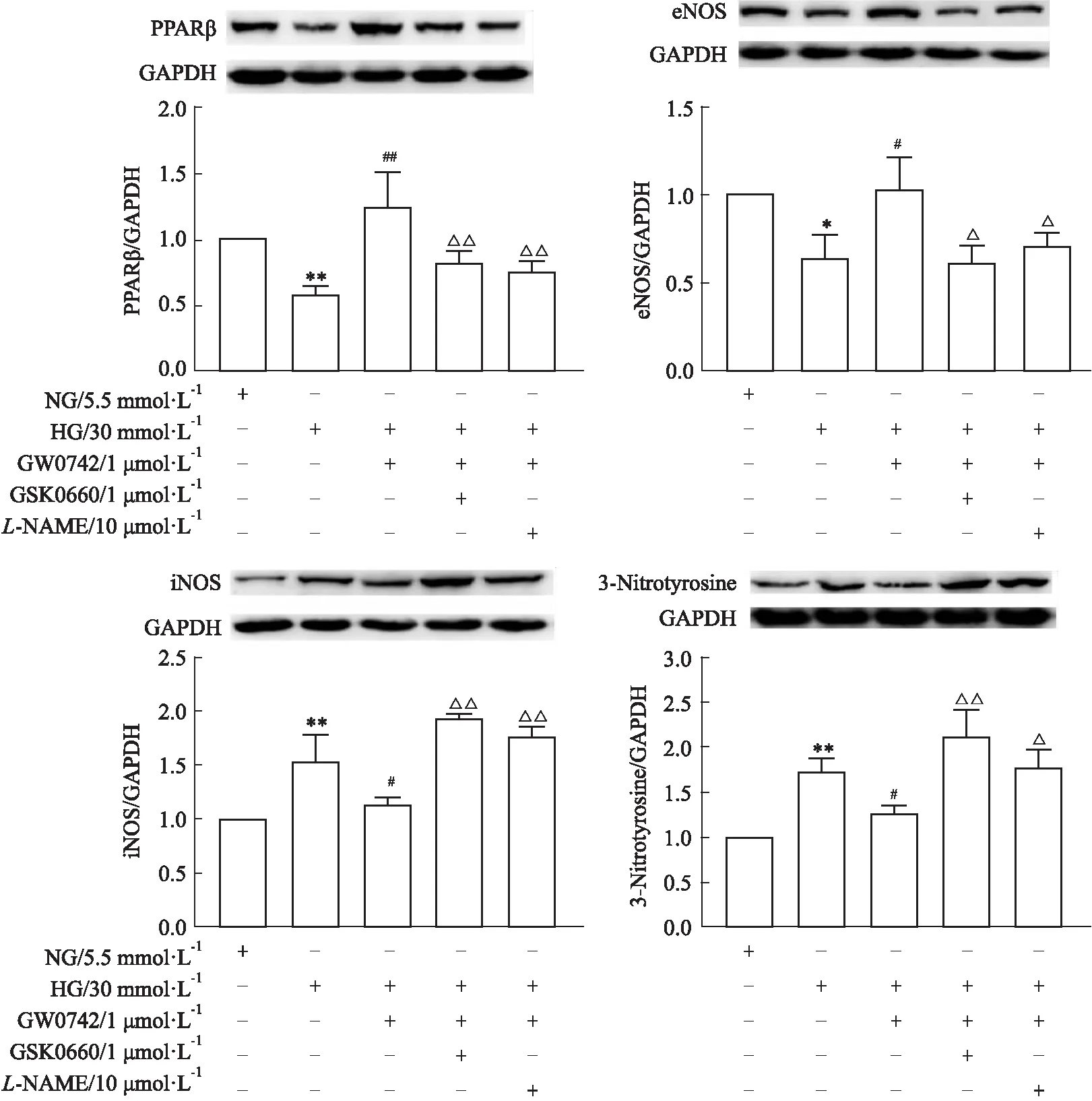
Fig 3 Effect of glucose at 30 mmol·L-1 (HG) on protein expression of PPARβ,eNOS,iNOS,and 3-nitrotyrosine )
2.4 高糖对OONO-水平的影响高糖刺激明显使OONO-水平增加(P<0.01)。GW0742(1 μmol·L-1)明显减少OONO-的水平(P<0.01),且该作用可被GSK0660(1 μmol·L-1)和L-NAME(10 μmol·L-1)阻断(P<0.01)(Fig 4)。
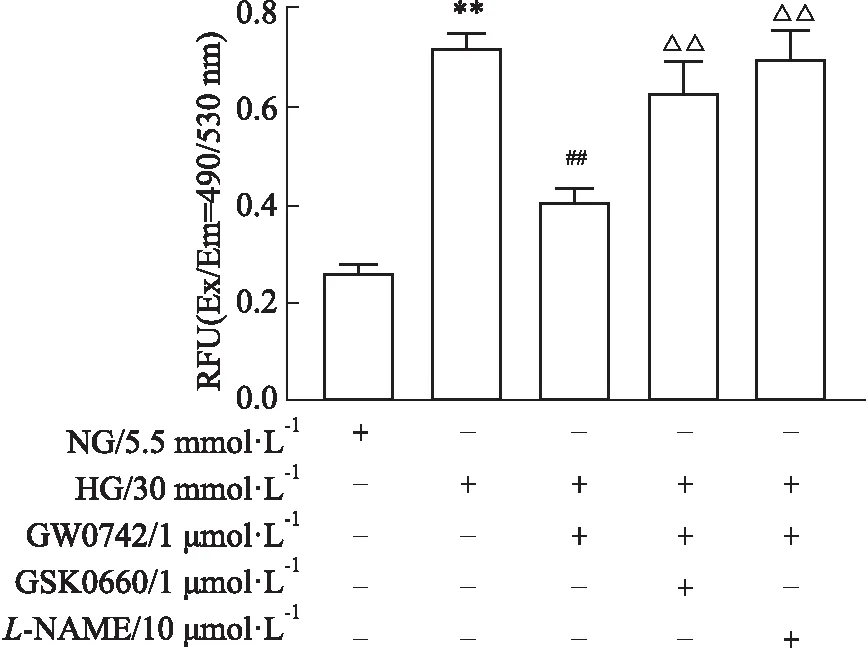
Fig 4 Effect of glucose at 30 mmol·L-1 (HG) on peroxynitrite (OONO-) level
2.5 高糖对NO含量的影响高糖孵育明显降低HUVEC中NO的含量(P<0.01)。GW0742(1 μmol·L-1)可增加NO含量,GSK0660(1 μmol·L-1)或L-NAME(10 μmol·L-1)均可阻断GW0742的作用(P<0.05)(Fig 5)。
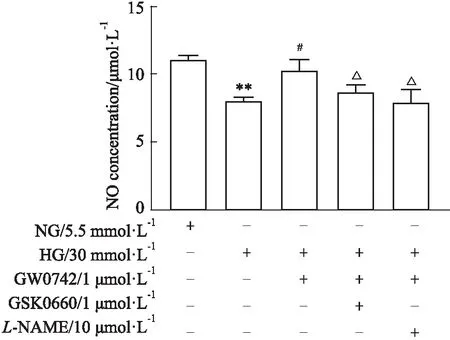
Fig 5 Effect of glucose at 30 mmol·L-1 (HG) on
3 讨论
糖尿病是一种累及微血管和大血管的多系统疾病,血管并发症是Ⅰ型和Ⅱ型糖尿病患者死亡的主要原因[8]。内皮细胞损伤可能是糖尿病血管并发症最早的病理事件[9]。长期高血糖状态引起内皮功能障碍、血小板高反应性、氧化应激和慢性炎症等病理变化,破坏血管壁[1]。本实验结果表明,随葡萄糖浓度增加(30、40、50 mmol·L-1),HUVEC细胞活力呈剂量依赖性下降,提示高浓度葡萄糖可损伤内皮细胞活性。同时,等渗透压的甘露醇(30 mmol·L-1)对HUVEC细胞活力没有影响,提示该损伤不是来自于渗透压的改变。30~50 mmol·L-1的葡萄糖常被用于模拟糖尿病时机体的高血糖环境,以建立糖尿病离体实验模型[7,10]。本实验条件下,30 mmol·L-1葡萄糖即明显损伤HUVECs活力,故以30 mmol·L-1为高浓度葡萄糖进行后续实验。本研究中,高糖作用也使HUVECs细胞增殖能力下降,提示高糖可能抑制HUVECs的增殖,引起内皮细胞损伤。大量临床前和临床数据表明,内皮功能障碍在糖尿病血管并发症中有重要作用[11-12]。因此,探索高糖状态下内皮细胞损伤的参与因素及相关调控机制对于预防或延缓糖尿病患者血管并发症具有重要意义。
现有研究表明,PPARs参与了多种慢性疾病(如糖尿病、癌症、炎症和动脉粥样硬化)的发生、发展。PPARβ是PPARs的亚型之一,广泛表达于全身各组织,在调节脂肪酸摄取、运输和 β-氧化以及胰岛素分泌和敏感性方面均有重要意义[13]。PPARβ受体激活可以改善小鼠的内皮功能障碍[14]。增加PPARβ表达和活性可保护氧化应激诱导HUVEC的凋亡[15]。这些研究显示,PPARβ在维持血管内皮结构和功能完整性方面可能也有重要作用。我们的结果显示,高糖作用使PPARβ蛋白表达下调;PPARβ激动剂GW0742上调PPARβ蛋白水平的同时,也改善高糖条件下HUVEC的细胞增殖能力;而PPARβ拮抗剂GSK0660可以取消GW0742的保护作用。上述结果提示,PPARβ可能参与了高糖对内皮细胞增殖的损伤作用。但PPARβ作用的相关分子机制,目前尚未完全清楚。
综上所述,PPARβ参与了高糖引起的血管内皮细胞损伤,该作用可能是由硝化应激途径介导的。本研究结果有助于进一步阐明糖尿病血管并发症相关信号通路的调控机制,为糖尿病血管病变的防治提供潜在的作用靶点。

