大黄虫丸调控ASIC1a/VEGF通路缓解肝纤维化
曹 锐,朱月琴,林慧敏,李洋洋,闻祥瑞,莫文汐,程欣然,吴 丽,黄 艳
[安徽医科大学1.药学院、2.重大自身免疫性疾病安徽省重点实验室、3.炎症免疫性疾病安徽省实验室,安徽 合肥 230032;4.中国科学技术大学附属第一医院(安徽省立医院)药剂科,安徽 合肥 230002;5.南京中医药大学药学院,江苏 南京 210023]
肝纤维化是由多种病因引起的肝脏修复反应,主要表现为肝星状细胞(hepatic stellate cells,HSC)的持续激活,以及细胞外基质(extra cellular matrix,ECM)的过度沉积[1]。其重要病理特征为肝内病理性血管的重构促进纤维间隔的产生,以及ECM过度沉积挤压血管,导致氧气输送受阻[2],肝脏局部产生低氧环境。HSC紧邻肝窦内皮细胞,激活后可在缺氧诱导因子的参与下转录、分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)等血管生成因子,加强与肝窦内皮细胞旁分泌通讯,驱动病理性血管的产生,破坏肝脏结构,加剧肝脏病理性损伤[3]。
酸敏感离子通道(acid-sensitive ion channels,ASICs)是广泛表达于细胞膜上的一类蛋白复合体,可感受胞外pH变化,通透阳离子。当胞外pH降低,ASICs通道开放,引起Ca2+、Na+内流,进而参与伴有缺氧和组织酸化的神经系统炎症、肿瘤等病理进程中[4]。ASIC1a作为通透Ca2+的主要亚基,激活后开放通道介导Ca2+内流[5]。课题组前期研究表明[6],在肝脏纤维化早期阶段伴随着炎症反应和局部组织酸化,ASIC1a表达上调,通过介导PI3K/Akt和ERK通路的激活,引起HSC的增殖与活化,加速肝纤维化的进程。进一步研究发现[7],活化的HSC中ASIC1a激活,介导Ca2+内流,促进钙调素依赖蛋白激酶β(Ca2+/Calmodulin-dependent protein kinase kinase,CaMKKβ)活化并高表达。CaMKKβ是一种由Ca2+激活的酶蛋白,广泛分布于肝脏和大脑,在炎症、造血、血管生成等生理过程中具有重要作用。有研究显示[8],ASIC1a可通过促进大鼠滑膜成纤维细胞VEGF的释放,调节大鼠滑膜血管翳的产生,进而参与大鼠关节炎的发展。

1 材料与方法
1.1 材料
1.1.1实验动物 60只SPF级♂SD大鼠,体质量(200±20) g,购于郑州市华兴实验动物养殖场,生产许可证编号:SCXK(豫)2019-0002,饲养于室内。温度(25±2) ℃,湿度60%,通风良好。
1.1.2药品与试剂 CCl4(汕头西陇化工厂公司);橄榄油(上海源叶公司)DHZCP(北京同仁堂公司,批号:国药准字Z11021241);秋水仙碱(西双版纳版纳药业公司,批号:国药准字H53021369);RIPA裂解液、PMSF蛋白酶抑制剂 (上海碧云天公司);Rabbit mAb anti-α-SMA、Rabbit mAb anti-VEGF、Rabbit mAb anti-Collagen-I、Rabbit mAb anti-β-actin (北京博奥森公司);Rabbit mAb anti-ASIC1a(美国Affinity公司);Rabbit mAb anti-CaMKKβ(武汉博士德公司);TRIzol裂解液(湖南艾科瑞公司);天冬氨酸转氨酶(aminotransferase,ALT)、 丙氨酸转氨酶(aspartate transaminase,AST)试剂盒(深圳迈瑞医疗器械公司)。
1.1.3主要仪器 Tissue-prp-03型组织破碎仪(上海净信公司);Western blot设备(美国Biorad公司);4 ℃低温冰箱 (青岛海尔公司);-20 ℃医用低温保存冰箱(安徽中科都菱);-80 ℃医用低温保存箱(日本Panasonic);、CFX Connect实时定量PCR仪(美国Biorad公司)、Microfuge 20R高速离心机(美国Beckman公司)。
1.2 方法
1.2.1分组及模型制备 60只雄性SD大鼠,随机均分成6组:对照组(n=10)、模型组(n=10)、DHZCP低剂量组(n=10)、DHZCP中剂量组(n=10)、DHZCP高剂量组(n=10)、秋水仙碱组(n=10)。适应性饲养1周后,模型组及药物处理组大鼠腹腔注射30%CCl4植物油混合溶液,每周2次,连续8周,对照组腹腔注射相同体积的植物油溶液。末次注射3d后,隔夜禁食,麻醉处死后取腹下腔静脉血以及肝组织留存。
1.2.2DHZCP给药方式 将DHZCP药物磨成粉末状,溶解于适量生理盐水中。以成人60 kg体重折算等效剂量。DHZCP高剂量组(1 200 mg·kg-1); DHZCP 中剂量组(600 mg·kg-1); DHZCP低剂量组(300 mg·kg-1);秋水仙碱组(0.2 mg·kg-1)。造模同时,不同剂量给药组大鼠每天灌胃300、600、1 200 mg·kg-1的DHZCP,对照组和模型组给予等量生理盐水灌胃,连续8周。
1.2.3血清学指标检测 大鼠麻醉后剖腹,腹部下腔静脉取血,4 ℃、3 000×g,离心20 min,取上层血清,根据试剂盒的说明书测定AST、ALT。
1.2.4肝组织病理染色 取大鼠肝脏右叶相同位置组织,4%多聚甲醛固定2 d后,石蜡包埋,切片,HE、Masson染色法,封片,玻片扫描仪下观察肝组织结构病理变化并拍照。
1.2.5免疫组化检测肝组织中ASIC1a、α-SMA蛋白表达 对肝组织右叶标本进行染色,微波抗原修复。封闭,PBS液冲洗,滴加一抗,放置4 ℃冰箱过夜。洗脱后滴加二抗,室温孵育1 h,DAB反应适量时间,流水冲洗,苏木精复染,切片烘箱烤干,树脂封片,镜检。
1.2.6q-PCR检测肝组织中目的基因的表达 取30 mg大鼠肝组织,组织研磨仪中剪碎,加入1 mL TRIzol试剂提取总RNA。使用定量仪测定各组 RNA 浓度,并逆转录为cDNA。参照逆转录试剂盒说明书,以10 μL逆转录反应体系,进行以下程序扩增:94 ℃预变性5 min,94 ℃ 20 s,60 ℃ 20 s,72 ℃ 20 s,87 ℃ 10 s;以此循环55次。以GAPDH 作为内参,2-ΔΔCt法计算各样本ASIC1a、CaMKKβ、α-SMA、Collagen-I、VEGF的相对表达量,引物序列如Tab 1所示。

Tab 1 RNA primer sequence
1.2.7Western blot检测肝组织中α-SMA、Collagen-I、ASIC1a、CaMKKβ、VEGF蛋白表达 切取30 mg大鼠肝组织,组织研磨仪中剪碎,加入1 mL含PMSF的RIPA裂解液提取总蛋白。根据BCA试剂盒对各组的蛋白浓度进行定量,调整蛋白浓度加入上样缓冲液。进行SDS-PAGE电泳分离:80 V 30 min,120 V 60 min。电泳结束,采用湿转200 mA恒流60 min转至PVDF膜上,5%脱脂奶粉封闭2 h。TBST清洗,加入一抗,4 ℃孵育过夜(孵育8 h以上)。次日,TBST清洗PVDF膜后,室温下与山羊抗兔二抗孵育1 h。1 ∶1配制适量ECL显影液,经化学成像系统成像,使用ImageJ软件进行定量分析,将各蛋白条带灰度值与内参β-actin比较,衡量各组蛋白的表达水平。

2 结果
2.1 各组大鼠血清ALT、AST水平变化如Fig 1显示,模型组与对照组相比,血清ALT、AST水平均明显升高(P<0.01);与模型组比较,DHZCP高、中、低治疗组和秋水仙碱治疗组ALT含量(P<0. 05或P<0. 01)和AST含量(P<0.01)明显降低,差异具有显著性。
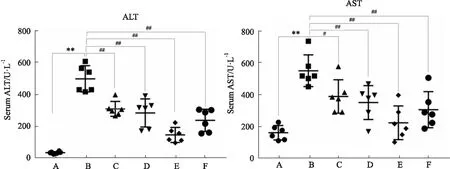
Fig 1 Serum ALT and AST levels of rats in each
2.2 各组大鼠肝组织病理学变化Fig 2所示,对照组大鼠肝细胞正常,排列整齐,肝组织结构完整。模型组肝组织结构严重破坏,肝细胞索排列异常,出现假小叶结构。肝细胞质中出现多个大小不等的圆形空泡,将核挤于一边,此外细胞出现广泛的脂肪变性,炎性坏死。Fig 2及Fig 3均显示,模型组有明显的纤维条索形成,胶原沉积明显。而DHZCP各剂量治疗组和秋水仙碱组相较于模型组肝细胞坏死及脂肪空泡明显减少,纤维组织增生及纤维间隔的形成有所减轻。
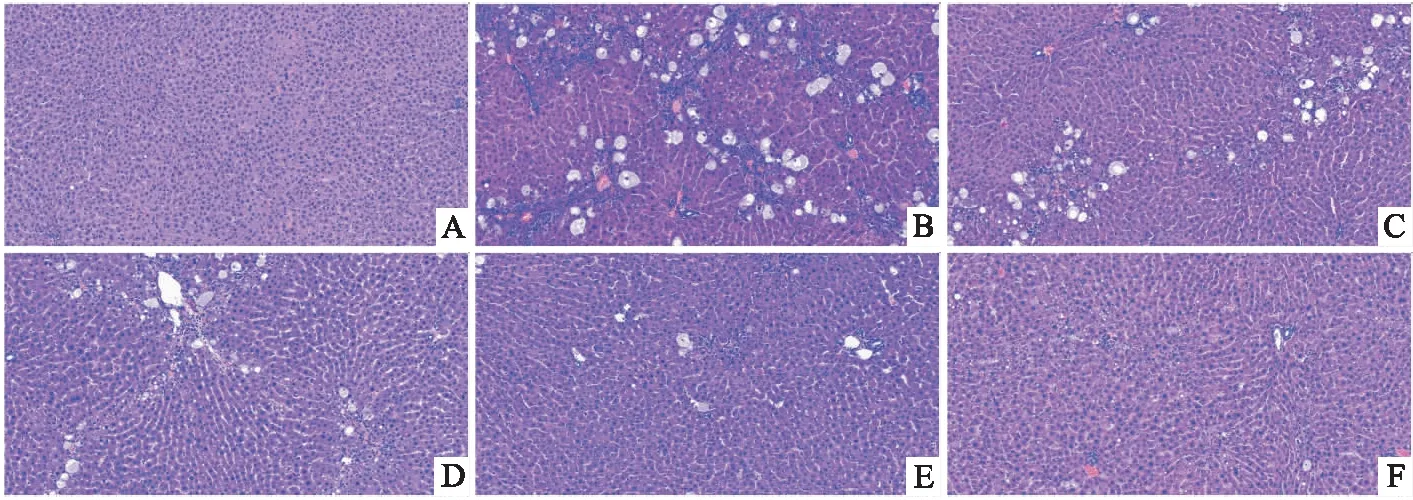
Fig 2 HE staining results of rat liver tissues in each group (100×)

Fig 3 Masson staining results of rat liver tissues in each group(100×)
2.3 各组大鼠肝组织中ASIC1a 、α-SMA的表达免疫组化结果如Fig 4和Fig 5显示,与对照组相比,模型组大鼠肝组织ASIC1a、α-SMA抗原阳性表达明显增加,DHZCP处理组可明显降低模型组大鼠肝组织ASIC1a、α-SMA表达水平,以中、高剂量组最为明显,提示DHZCP治疗肝纤维化的作用机制可能与调节ASIC1a的表达有关。
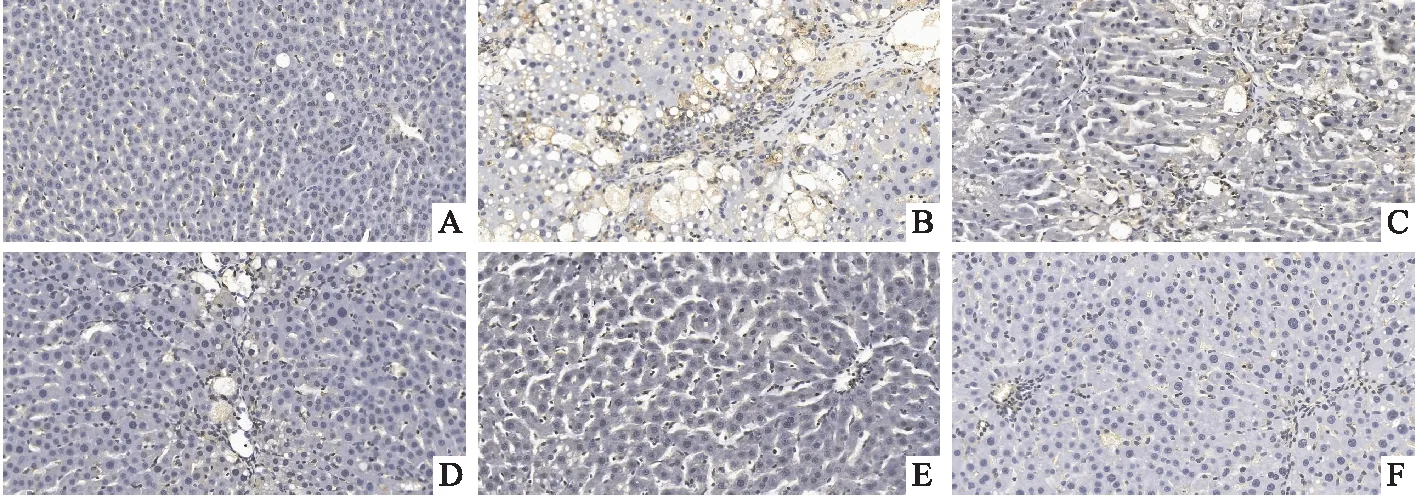
Fig 4 Immunohistochemistry of α-SMA in rat liver tissues of all groups(200×)
2.4 各组大鼠肝组织中ASIC1a、CaMKKβ、VEGF、α-SMA、Collagen-Ⅰ基因mRNA表达变化如Fig 6所示,模型组大鼠肝组织中ASIC1a、CaMKKβ、VEGF、α-SMA、Collagen-Ⅰ基因mRNA表达均高于对照组,差异具有统计学意义(P<0.01)。与模型组比较,DHZCP低剂量组对ASIC1a、VEGF基因mRNA表达基本无影响,中、高剂量组ASIC1a、VEGF基因 mRNA的表达水平均有不同程度降低,差异具有统计学意义(P<0.01)。DHZCP低、中、高治疗组CaMKKβ、α-SMA、Collagen-Ⅰ基因mRNA表达相较于模型组均有不同程度降低,差异具有统计学意义(P<0. 05或P<0. 01)。
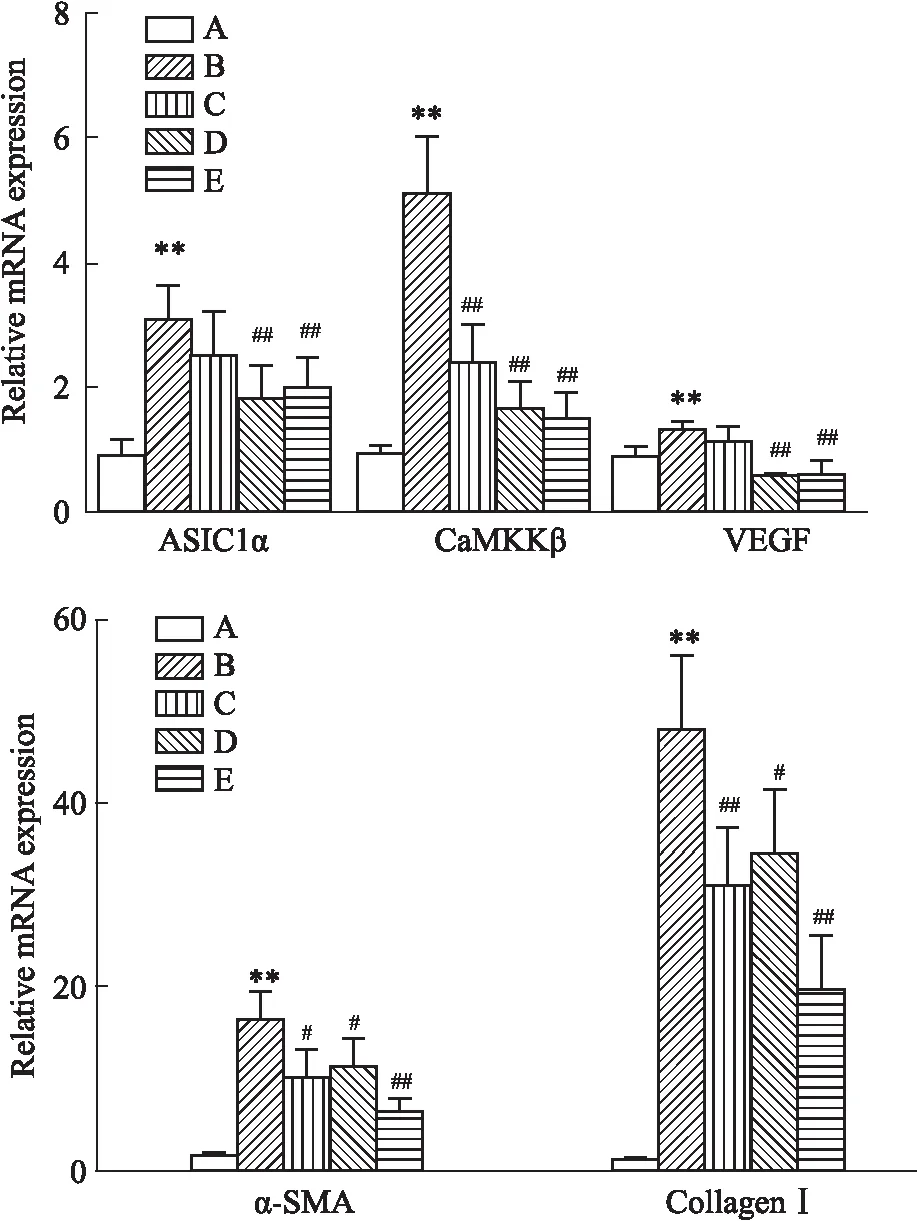
Fig 6 Expression of ASIC1a,CaMKKβ,VEGF,α-SMA,Collagen-Ⅰ,mRNA in rat liver tissues of various
2.5 Western blot 法检测各组大鼠肝组织 α-SMA、Collagen-Ⅰ、ASIC1a、CaMKKβ、VEGF蛋白表达变化如Fig 7所示,与对照组相比,模型组肝组织α-SMA、Collagen-Ⅰ蛋白表达明显升高,差异具有统计学意义(P<0. 05或P<0. 01)。与模型组相比,低剂量组α-SMA蛋白表达水平基本一致,差异无统计学意义。中剂量组、高剂量组和秋水仙碱组α-SMA蛋白表达低于模型组,差异具有统计学意义(P<0. 05或P<0. 01)。与模型组相比,低剂量组和中剂量组Collagen-Ⅰ蛋白表达基本持平,不具有统计学差异,高剂量组和秋水仙碱组Collagen-Ⅰ蛋白表达下降,差异具有统计学意义(P<0.05)。结果证实DHZCP对CCl4诱导的大鼠肝纤维化有明显的治疗作用。
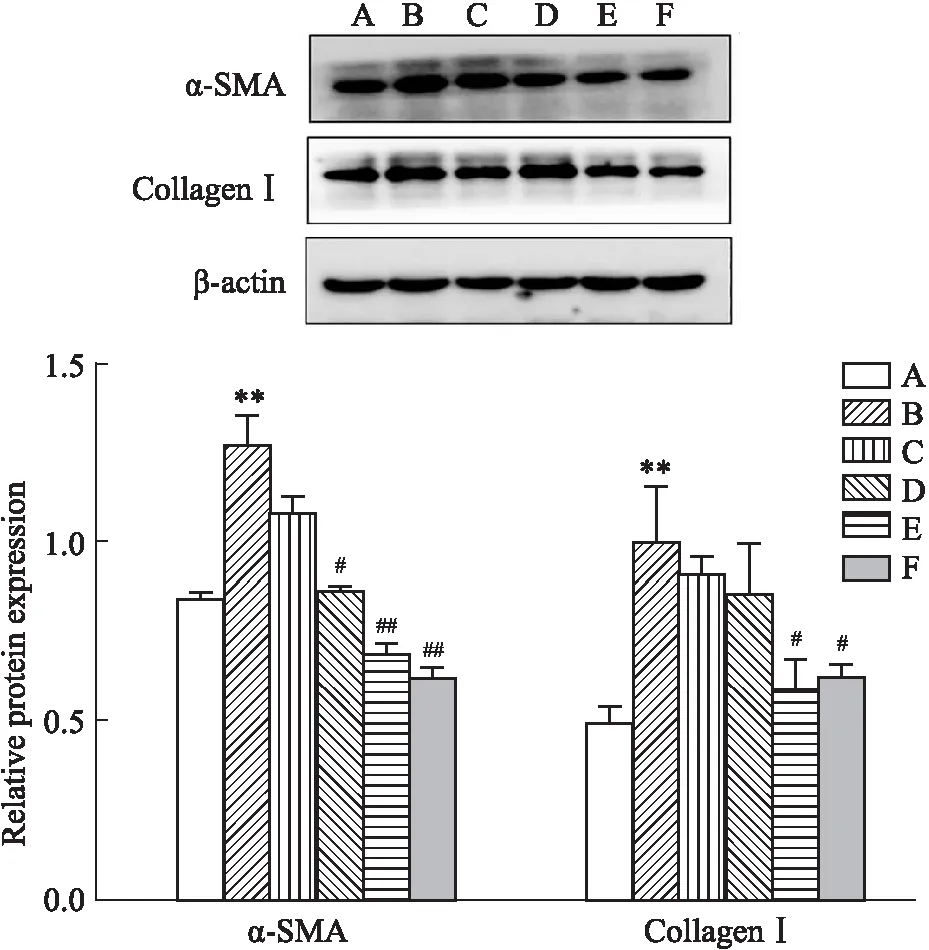
Fig 7 Expression of α-SMA and Collagen-Ⅰprotein in rat liver tissues of different
Fig 8显示,相较于对照组,模型组肝组织ASIC1a、CaMKKβ、VEGF蛋白表达明显升高(P<0.01)。与模型组相比,DHZCP不同剂量给药组可呈剂量依赖性降低肝组织ASIC1a、CaMKKβ、VEGF的蛋白表达,差异具有统计学意义。(P<0.05或P<0.01)。
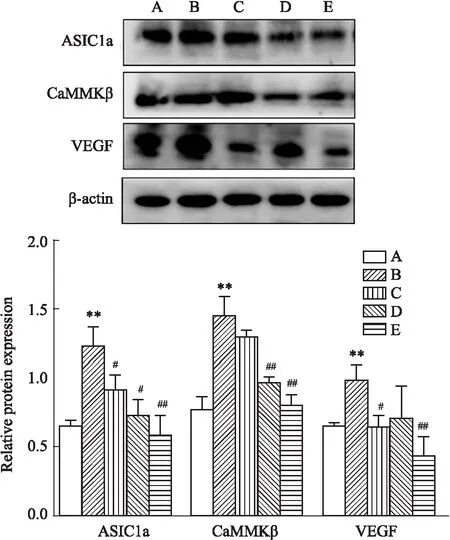
Fig 8 Expression of ASIC1a,CaMKKβ and VEGF protein in rat liver tissues of each
3 讨论
肝纤维化的鲜明特征是HSC的活化和以α-SMA和Collagen-I为主要成分的细胞外基质的沉积[12]。多项研究指出,HSC的活化在肝内血管重构,肝纤维化进展中起关键作用。越来越多的证据显示HSC活化所引起的细胞外基质的过度沉积,可压迫肝内血管,造成氧气输送受阻,为HSC分泌及释放促血管生成类因子如VEGF、血管生成素1(angiopoietin-1,Ang-1)等刺激病理性血管的生成创造缺氧前提[3]。同时,肝纤维条索、纤维间隔的产生可改变原有肝脏的小叶结构,常与新血管的生成并行,改变肝内血流流向,加重肝纤维化的病理性损伤。本实验采用经典的CCl4诱导的大鼠肝纤维化模型,血清ALT、AST结果及病理染色结果显示,CCl4诱导的肝纤维化组大鼠肝组织损伤严重,肝纤维化模型成功复制,并伴有假小叶及纤维索条产生等现象。DHZCP低、中、高治疗组肝纤维条索及假小叶结构均有不同程度减少,剂量依赖性降低血清ALT、AST水平,表明DHZCP可缓解CCl4诱导的肝脏病理性损伤,对肝纤维化有明显的治疗作用。
以往的研究多认为,缺氧是诱导VEGF表达的主要原因。低氧诱导因子HIF-1α可上调VEGF的表达促进肿瘤疾病中的血管增生[13]。另有研究发现[14],抑制ASIC1a表达及活性后,可减轻缺氧所致的神经元损伤。如之前所述,缺氧、局部组织酸化是肝纤维化前期阶段炎症反应的常见现象,炎症、缺氧不仅为增强ASIC1a的表达及活性创造了条件,也为ASIC1a参与肝组织VEGF表达及血管重构这一观点提供了一定的理论依据。课题组在前期研究发现[15],CCl4诱导的大鼠肝纤维化模型中,ASIC1a表达显著增加。体外研究显示,HSC活化后,ASIC1a表达及通道活性增加,Ca2+内流增多[5]。Ca2+作为重要的细胞信使,参与了胞间信息传递及包括血管生成在内的多种生理进程。进一步研究发现,ASIC1a可调节HSC中CaMKKβ/ERK通路,诱导HSC自噬发挥促纤维化作用[7]。CaMKKβ与Ca2+联系紧密,且研究已表明,CaMKKβ可上调强有效的促纤维化因子VEGF的表达水平,影响组织血管生成[16]。这表明:一方面ASIC1a的表达及活性上调与肝纤维化的发生发展密切相关,另一方面ASIC1a可能是调节VEGF释放、血管重构的重要环节。基于此,本实验探究了DHZCP对肝纤维化大鼠的治疗作用及其ASIC1a/VEGF相关机制。
本研究结果显示,模型组ASIC1a及VEGF蛋白与mRNA水平明显上升,DHZCP治疗组能够有效逆转ASIC1a 、VEGF蛋白水平的上调。此外,肝纤维化标志物α-SMA和Collagen-I的表达也随DHZCP剂量升高而逐渐降低,并与ASIC1a 、VEGF的表达变化呈相似趋势,进一步证实了DHZCP发挥治疗肝纤维化的作用可能与调控ASIC1a/VEGF的表达有关。中药因其循证、多组分、多渠道、多环节的综合治疗作用,在医治肝病方面可发挥独特的作用。既往研究指出[17]本方含有多种“活血化瘀”药味成分如大黄、地黄、水蛭等,且君药大黄中所富含的黄酮类物质如大黄酸、大黄素、大黄酚等,均可抑制血管生成类蛋白表达。但由于中药复方成分复杂,药味间不同配伍可产生不同的治疗作用,传统药理学方法不足以解释复方中所起效单体成分。因此,ASIC1a如何调控VEGF表达及DHZCP复方单体成分的筛选和机制仍需后续实验深入研究。
综上所述,DHZCP可缓解CCl4诱导的大鼠肝纤维化,其机制可能与调控ASIC1a/VEGF通路有关。后续将在体外分子水平上筛选DHZCP的活性成分,更加深入细致的研究肝纤维化、ASIC1a和VEGF间的联系。实验的研究结果将为纤维化的治疗和新的药物靶点筛选提供新的思路和依据。

