植入式心脏起搏器单/双极起搏模式下回路阻抗研究及离体实验方案
【作 者】丁鼎,林开斌,黄冬,郭心维,王延鹏,李帅,李京波,牛金海
1 上海交通大学 生物医学工程学院,上海市,200240
2 上海交通大学附属第六人民医院,上海市,200233
0 引言
在缓慢性心律失常和心力衰竭等心脏疾病的治疗中,植入式心脏起搏器是重要的治疗手段[1]。心脏起搏器系统分为电极导线和脉冲发生器两部分,电极导线通常经静脉路径植入,并将刺激电极放置在心室或心房,脉冲发生器连接导线,放入在患者体表(如左侧锁骨下方)制作的囊袋中,脉冲发生器在需要时通过电极导线发送电脉冲,刺激心肌使之收缩,帮助患者心脏起搏[1]。心脏起搏器作为一种植入式器械,其工作寿命几乎完全由电池电量和工作状态的电量消耗决定,由于不具备充电或更换电池的条件,心脏起搏器较短的工作寿命意味着患者需要进行较高频率的手术去更换心脏起搏器,这会给患者的身体状况带来影响,并增加经济负担。在导线设计上,早期心脏起搏器通常为单极设计,即电极导线只设置阴极对心脏进行刺激,电流回路经过人体组织返回起搏器表面的阳极,另一种设计方式为双极设计,即在导线束中设置互相绝缘的两根导线,在导线束头端设置阴极进行刺激,在头端不远处的导线外层设置阳极将电流回路引入导线束回到起搏器[2],目前双极导线已经成为临床上使用的主流,并且可以兼容单/双极两种起搏模式。双极起搏模式相比单极起搏模式在抗工频干扰能力[3]上存在优势,而在感知能力[4-5]方面尚存一定的争议。此外,不同起搏模式对阻抗及由此导致的对电量消耗的影响上,目前的临床研究结果也尚无定论:李京波、张旭东等[4,6]的临床研究发现双极起搏模式下的回路阻抗大于单极模式下的回路阻抗,而汪爱虎等[7]则持有相反的观点。本研究将通过离体实验的方式分析单/双极起搏模式的回路阻抗差异,对其进行分析并建立对应的电学模型,可以为降低电量消耗、提高心脏起搏器寿命起到一定的指导意义。
1 实验方法
本研究使用由Medtronic公司提供的单腔起搏器SES01与双腔起搏器E50A1各一台,两台起搏器在研究开始前均未被启用,采用Medtronic公司提供的程控仪对起搏器进行程控,可以对起搏器的脉冲幅度、宽度、起搏模式、起搏频率等进行调节,并可以通过程控仪对回路阻抗和起搏器电池内阻进行读取。研究中设计的离体实验方案如图1所示,图中①为浸没于电解质溶液中的起搏器,②为用于控制温度的恒温水浴锅,③为精度为0.1oC的水银温度计,④为程控探头,⑤为程控仪。

图1 离体实验方案Fig.1 Scheme of pacemaker in vitro experiment
其中,电解质溶液为临床上使用的0.9%生理盐水或自行配制的其他浓度NaCl溶液,该NaCl溶液采用食盐和蒸馏水,根据实验所需的浓度进行配制。恒温水浴锅测控温分辨率为0.1oC,此外实验中还同时采用分辨率为0.1oC的水银温度计对电解质溶液的温度进行测量。
为了确定一组比较符合植入人体的心脏起搏器实际工作环境的离体实验环境并探究起搏模式与回路阻抗之间的关系,研究中分别对于温度、起搏模式、电解质溶液浓度、电极表面接触状态等因素对回路阻抗的影响进行了实验。在所有实验中,起搏器的程控参数均设置为:脉冲幅度3.5 V、脉冲宽度0.4 ms、起搏频率70 bpm。
1.1 温度—回路阻抗特性实验
实验采用0.9%生理盐水,将盛放起搏器的室温下的生理盐水浸入40oC的水浴锅进行升温过程,在该升温过程中每2 min进行一次回路阻抗和生理盐水温度测量直到盐水温度达到37oC。
1.2 单/双极模式—回路阻抗特性
实验采用0.9%生理盐水,将起搏器浸入生理盐水并置于水浴锅中保温,在生理盐水的温度保持在37oC±0.5oC的范围内5 min后,开始测量,先采用双极模式,每隔2 min读取一次回路阻抗数据并保证生理盐水的温度始终维持在37oC±0.5oC的范围内,完成10组数据测量后调整为单极模式,再进行10组数据的测量。
1.3 电解质溶液浓度—回路阻抗特性
由于在电解质溶液中,溶液的电阻率与离子浓度成反比关系[8],而在回路阻抗中,液体阻抗理论上与溶液电阻率成正比,而电极导线的电阻则不随溶液电阻率发生变化,因此该实验采用了0.6%、0.9%、1.2%、1.8%、3.6% NaCl溶液产生电阻率梯度,借此将回路阻抗中导线电阻部分与液体电阻进行区分。实验中,将NaCl溶液温度控制在37oC±0.5oC的范围内,5 min后开始测量,每隔2 min读取一次回路阻抗数据,对每一种浓度的NaCl溶液,在单/双极起搏模式下各读取5次回路阻抗数据。
1.4 采用离体猪肉组织的回路阻抗实验
鉴于大量文献指出的,电极与人体组织间的接触阻抗在起搏器回路阻抗中具有不可忽视的比例,甚至有文献认为接触阻抗在起搏回路中起着决定性的作用[2,9],由于目前尚无与人体组织电学特性相近的人造仿生膜作为实验材料,因此,为确定电极与生物组织之间的接触阻抗与电极与盐水间的接触阻抗是否存在较显著的差异,我们采用了新鲜的猪肉作为人体组织的替代物进行实验。实验中将脉冲发生器与起搏电极分别埋入一块新鲜猪肉(尺寸约为12 cm×4 cm×5 cm)的切口中包裹起来并浸入自行配制的NaCl溶液中,NaCl溶液浓度选取了两种最接近相关研究中得到的健康人体平均血液电导率[9-10]的1.2%与1.8%。实验中,在NaCl溶液温度保持在37oC±0.5oC的范围内,5 min后开始测量,每隔2 min读取一次回路阻抗数据,并在完成单/双极起搏模式下各5个回路阻抗数据的测量后,将猪肉切割成2块并将脉冲发生器和导向电极分别埋入其中重复测试。
2 实验数据
2.1 温度—回路阻抗特性
实验过程中,浸泡起搏器的生理盐水的温度从室温升高到37oC,我们在两种起搏模式下各采集了20组数据,实验表明:升温过程中,双极模式的回路阻抗从538 Ω下降到419 Ω,而单极模式的回路阻抗从409 Ω下降到295 Ω,实验结果如图2所示。
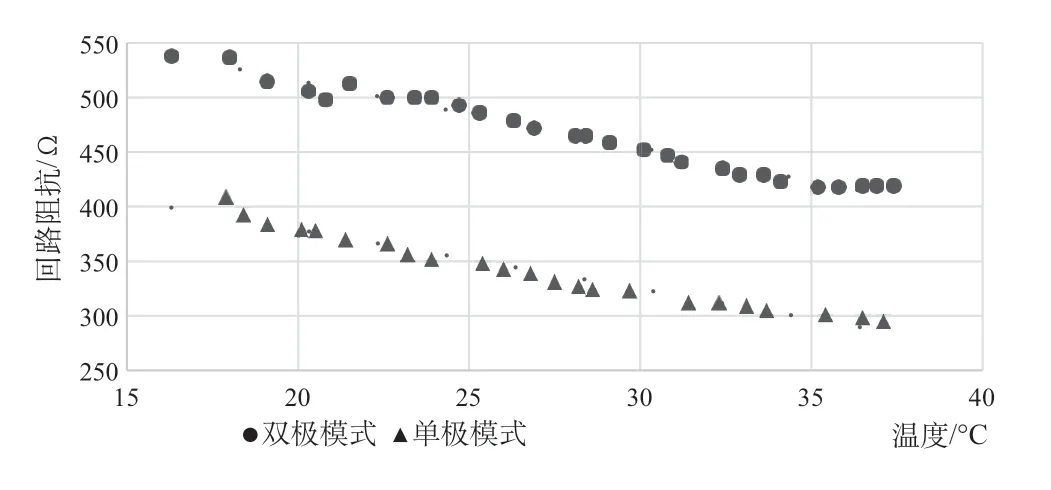
图2 不同起搏模式下环境温度—回路阻抗实验结果Fig.2 Temperature-circuit impedance experiment in both pacing modes
同时,实验中还测定了温度与电池内阻间的关系,在升温过程中,单/双极模式下电池内阻无明显差异,从约1700 Ω下降到约400 Ω,实验结果如图3所示。

图3 温度—电池内阻实验结果Fig.3 Connection between temperature and internal resistance of battery
上述结果说明:
(1)环境温度与电池内阻和回路阻抗均成负相关关系。
(2)在温度由15~37oC的变化范围内,电池内阻降低约75%,回路阻抗降低20%~30%。
(3)温度—回路阻抗的关系可以采用线性拟合,拟合公式为双极模式:y=-6.13x+638,R2=0.978;单极模式:y=-5.45x+488,R2=0.964。
2.2 起搏模式—回路阻抗特性
在这组实验中,双极起搏模式的平均阻抗为430 Ω,标准差为12 Ω,单极起搏模式的平均阻抗为297 Ω,标准差为2 Ω,实验结果如图4所示。
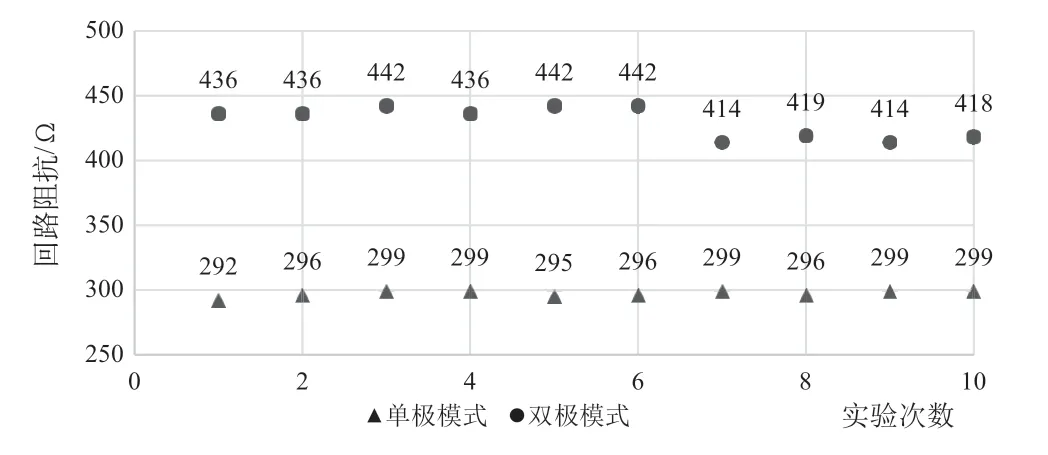
图4 起搏模式—回路阻抗结果Fig.4 Difference of circuit impedance between unipolar/bipolar pacing mode
对数据进行t检验发现P=1.57×10-10,P<0.001,结果说明双极起搏模式的回路阻抗显著大于单极起搏模式的回路阻抗,起搏器起搏模式的选择与其回路阻抗有密切的关联。
2.3 电解质溶液浓度—回路阻抗特性
实验中,对浸在每种浓度NaCl溶液中的起搏器回路阻抗在两种起搏模式下分别进行了5次测量,并取得回路阻抗的平均值。实验发现,随着溶液电阻率的逐渐提升,浸泡在该种溶液下的起搏器的回路阻抗也逐渐提升,单极模式下由146 Ω提升至345 Ω,双极模式下由251 Ω提升至522 Ω,实验结果如图5所示。
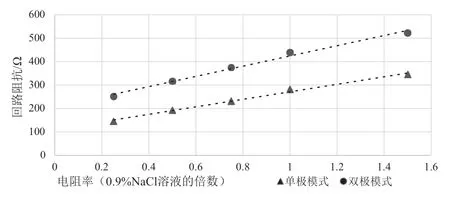
图5 溶液电阻率—回路阻抗结果Fig.5 Influence of solution resistivity on circuit impedance
从上述曲线的形态来看,其线性程度较高,两组数据的线性拟合公式分别为:双极模式:y=217.95x+206.24;单极模式:y=160.27x+110.78,R2分别为0.990和0.993。在线性拟合公式中,常数项代表回路阻抗中不随液体电阻率变化的部分,也就是导线产生的阻抗,在该组实验中双极和单极分别为206 Ω和111 Ω,表明双极模式下导线阻抗基本为单极模式的两倍,这一结果与双极模式起搏回路中两次流经导线的实际情况相符。拟合公式中的一次项则反映了起搏回路中与液体电阻率相关的成分,包括电极与液体的接触阻抗及回路流经模拟人体组织的液体部分的阻抗,在0.9%NaCl溶液的环境下,双极和单极模式由液体产生的阻抗分别为218 Ω和160 Ω,这说明起搏回路中电流经过液体产生的阻抗最多不超过160 Ω,同时,需要指出的是,在这种实验条件下,电极与液体之间的接触阻抗并不能很好地模拟在人体中电极与组织之间的接触阻抗。
2.4 采用离体猪肉组织的回路阻抗实验
在该组实验中,对两种起搏模式下每一种包裹状态的起搏器回路阻抗数据各自采集了5组数据,并取得平均值,发现双极起搏模式下回路阻抗显著大于单极起搏模式,双极模式的实验结果如图6所示。

图6 双极模式下采用不同包裹状态的起搏器回路阻抗图Fig.6 Circuit impedance with different wrapping situation under bipolar pacing mode
对该组实验数据进行处理可以得出如下结论:
(1)对比包裹脉冲发生器和不包裹脉冲发生器的情况,在不同溶液浓度下双极模式回路阻抗的P分别为0.10和0.16,单极模式下P分别为0.83和0.20,这说明脉冲发生器是否被包裹对回路阻抗无明显影响,即脉冲发生器机壳的接触阻抗可以忽略不计。
(2)将包裹电极的回路阻抗数据与不包裹电极的回路阻抗进行比较,在不同溶液浓度下双极模式回路阻抗的P分别为2.4×10-6和5.8×10-6,单极模式下回路阻抗的P分别为4.5×10-6和3.2×10-6。这说明导线电极的接触阻抗较大,不可被忽略,同时也说明电极与离体猪肉组织的接触阻抗显著大于电极与电解质溶液的接触阻抗。
3 讨论
在本研究采用的所有实验条件下,双极起搏模式的回路阻抗均显著大于单极起搏模式下的回路阻抗,其中在接近人体实际环境的离体环境下,两者的差值为120~200 Ω。在实验中,我们还将起搏回路中导线阻抗与组织阻抗相分离开来,在实验中发现电极与猪肉的接触阻抗和液体的接触阻抗存在一定的差异。结合这些结论,我们从起搏回路的等效电路的角度分析不同刺激模式的回路阻抗特性。
根据上述实验的结论以及以往的相关研究[1,4,11],依据电子在起搏回路中的流动方式(见图7),在忽略起搏器起搏回路中的容性成分后,可将起搏回路简化为如图8所示的等效电路。

图7 不同起搏下起搏回路中电子流动路线[4]Fig.7 Electron flow route in different pacing modes
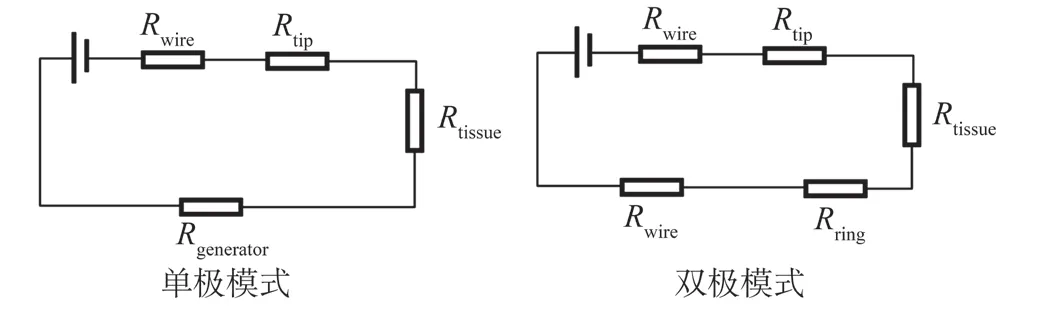
图8 不同起搏模式下起搏器工作回路的等效电路Fig.8 Equivalent circuit diagram of pacing circuit in different pacing modes
在双极模式下的起搏器工作回路中,电流通过电极导线在阳极环附近流出,经过受刺激的心肌部分后从导线端点的阴极流入并沿电极导线回到脉冲发生器,而在单极模式下,电流直接以脉冲发生器的机壳作为阳极,通过组织和血液抵达位于心肌的起搏电极,并从电极经过导线回到脉冲发生器。
由于心脏起搏器工作回路在人体组织中会倾向于流经电阻较小的血液而非流经电阻较大的肌肉、骨骼等组织,因此图8中流经组织的电阻(Rtissue)可以采用当前离体实验电解质溶液中的电阻进行模拟,通过上述实验结果可以发现虽然不同起搏模式下流经组织的电阻有所不同,但在电阻率较为接近血液的电解质溶液环境内该差异始终在100 Ω左右,而电流单次经过导线产生的电阻(Rwire)也在100 Ω附近,基本可以抵消这一差距,此外,之前的实验中还发现脉冲发生器作为阳极时,其接触阻抗(Rgenerator)极低,而在整个起搏回路中,不同起搏模式都不可避免地经过阴极端电极从而产生接触阻抗(Rtip)。因此根据上述实验的结果,我们推测双极模式下阳极环附近的接触阻抗(Rring)是两种刺激模式间最大的差异所在。
对于在人体中正常工作的一台心脏起搏器而言,其工作的脉冲电压和脉冲宽度是根据植入时及植入后的多次随访结果确定的,因此通常是恒定不变的,而在恒定的脉冲电压和脉冲宽度的情况下,较大的回路阻抗有助于降低脉冲电流,进而降低产生一次电脉冲所需要消耗的能量,起到延长电池寿命的作用。因此根据我们的研究结果,在单/双极模式下均能达到近似的临床治疗效果的情况下,理论上采用双极起搏模式可以一定程度上延长起搏器的使用寿命。
4 总结与展望
本研究构建了起搏器回路阻抗测试的离体实验环境,比较了不同起搏模式下心脏起搏器的回路阻抗差异并验证了前期临床研究中所得到的结论[6],提出起搏模式对回路阻抗的影响机理。本研究设计的心脏起搏器回路阻抗离体测试环境为后续开展心脏起搏器的离体放电实验及长期的电池电量消耗的研究提供了较为完善的实验设计参考。
致谢
感谢美敦力公司的卢洪阳博士、曹季军工程师的指导与支持。

