雌激素受体在骨肉瘤中的作用研究进展
孙小丹,刘鷖雯,何怡青,杜 艳,张国良,高 锋,杨翠霞
(1.上海交通大学附属第六人民医院检验科,上海 200233;2.上海交通大学附属第六人民医院中心实验室,上海 200233)
骨肉瘤是常见的原发性恶性骨肿瘤,占原发性恶性骨肿瘤的40%,致死率及致残率极高,预后极差[1]。骨肉瘤具有高度侵袭性和转移性,有80%的骨肉瘤患者在确诊时已伴有微小转移灶[2]。因此,单纯行手术截肢的患者5年生存率仅为20%[3]。控制骨肉瘤转移的主要方法是化疗,可显著提高患者的预期寿命。目前,临床多采用手术切除联合化疗的治疗方案,使骨肉瘤患者的5年生存率提高至70%[4]。甲氨蝶呤、阿霉素、顺铂和异环磷酰胺等被认为是有效治疗骨肉瘤的药物[3],但是大剂量使用化疗药物的副作用较多[5],如肝功能损伤、肾功能损伤、骨髓抑制、神经毒性等,且易产生耐药性[6],导致患者10年生存率较低[7]。因此,临床亟需寻找一种理想的药物治疗方案。
骨肉瘤可发生于任何年龄人群,但常见于10~20岁青少年,男性多于女性,其疾病特点是成骨细胞过度活跃、异常增殖[8],好发的年龄段是性激素最活跃的时期。性激素中的雌激素水平与骨肉瘤的发生、发展关系密切[9],且在骨肉瘤组织及细胞中均发现了雌激素受体(estrogen receptor,ER)的表达[10]。ER包括经典的核受体(ERα、ERβ)和膜受体[G蛋白偶联的雌激素受体(G protein-coupled estrogen receptor,GPER)]。ERα和ERβ除有共同的配体——雌激素外,还有各自的特异性配体。ER在多种肿瘤中表达,如乳腺癌、结直肠癌、甲状腺癌、骨肉瘤等[11]。在正常生理条件下,ER的主要作用是与雌激素发生特异性结合,形成激素-受体复合物,调节下游基因转录,使雌激素发挥生物学功能。在肿瘤进展过程中,雌激素与ER结合可调节肿瘤细胞的生长特性[12],抑制骨肉瘤细胞的增殖和转移,诱导骨肉瘤细胞向成骨细胞分化[9]。本文拟对ER在骨肉瘤发生、发展及治疗中的研究进展进行综述,以期为骨肉瘤的预防和治疗提供新思路。
1 ER的结构与功能
1.1 ER的结构
ER主要分为核受体(ERα、ERβ)和GPER。ERα和ERβ分别由基因ESR1和ESR2编码,于6q25.1和14q23.2转录。2种ER均由A、B、C、D、E和F 5个功能区组成,见图1。其中,A/B区含有1个转录激活区(activation function,AF)-1,可在不与配体结合的情况下反式激活下游靶基因的转录。C区被称为DNA结构域(DNA binding domain,DBD),包含2个锌指结构,在与DNA结合过程中发挥重要作用,参与ER的同源二聚化。D区是C区和E区的铰合区域。E区和F区被称为配体结构域(ligand binding domain,LBD),含有1个AF-2。E区和F区不仅与ER同源二聚化有关,而且与核易位以及靶基因表达的反式激活相关[13-14]。虽然ERα和ERβ的功能区组成相似,但其发挥的生物学功能却完全不同。GPER包括G蛋白偶联受体30(G protein-coupled receptor 30,GPR30)、Gαq蛋白偶联雌激素受体(Gαq protein-coupled estrogen receptor,Gαq-ER)和ER-X(一种假定的膜性ER)[11]。GPER通过蛋白激酶B(protein kinase B,PKB;又称Akt)、细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)等信号通路影响细胞的增殖、迁移、侵袭和耐药性[15]。但是,目前关于GPER的研究尚不多见,其具体的生物学功能尚不明确。因此,本文将重点阐述核内的受体ERα、ERβ和GPER在骨肉瘤进展中的作用。
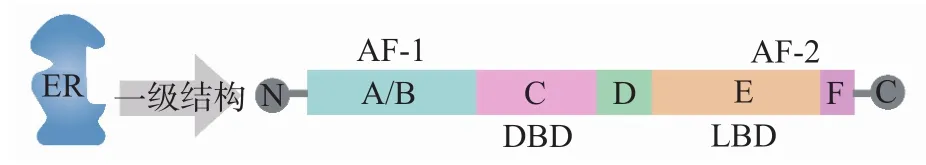
图1 ER的功能区组成
1.2 ER的功能
ER与肿瘤的发生、发展有关。在骨肉瘤微环境中,ERα和ERβ发挥完全不同的生物学功能,ERα与雌激素结合可抑制骨肉瘤细胞的增殖,影响肿瘤侵袭性和患者预后[6];激活ERβ则可诱导骨肉瘤细胞的凋亡[9]。
1.2.1 ERα的功能 ERα与肿瘤细胞增殖、侵袭及药物敏感性关系密切[16]。在乳腺癌[17]、卵巢癌[18]、子宫内膜癌[19]、宫颈癌[20]等生殖系统肿瘤中,ERα影响着肿瘤细胞的增殖。ERα发挥作用的机制有以下几种途径:(1)细胞内钙的动员;(2)环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的产生和激活;(3)增加磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)的活性,激活Akt和内皮型一氧化氮合酶[21-22];(4)膜酪氨酸激酶受体的激活[23];(5)Src同源结构域的磷酸化[24]。有研究发现,激活骨肉瘤细胞的ERα可抑制骨肉瘤细胞的增殖[10]。另外,ERα在抑制肿瘤细胞上皮-间质转化(epithelial-mesenchymal transformation,EMT)进程和延缓肿瘤进展中发挥重要作用[25]。动物实验结果显示,在小鼠皮下成瘤模型中过表达ERα可抑制骨肉瘤细胞的增殖和转移[9]。这提示ERα功能的变化在骨肉瘤的进展中发挥重要作用。
1.2.2 ERβ的功能 ERβ具有促进细胞凋亡,抑制细胞增殖、侵袭、转移和EMT的功能[26]。在结肠癌[27]、乳腺癌[12]、骨肉瘤[26]等肿瘤中均被证实激活ERβ可以显著抑制肿瘤细胞的增殖。敲降ERβ可激活Wnt信号通路,促进骨肉瘤细胞的侵袭和迁移[28]。在小鼠模型中,过表达ERβ可使异种移植瘤的肿瘤生长显著减慢,血管新生显著减少[18]。因此,ERβ被认为是肿瘤治疗的潜在靶点。
1.2.3 GPER的功能 GPER与肿瘤细胞增殖和转移密切相关,激活GPER可促进乳腺癌细胞[29]、甲状腺癌细胞[30]、前列腺癌细胞[31]的增殖。GPER的特异性活化可激活ERK信号通路,进而影响细胞周期蛋白CyclinA和CyclinD1启动子的转录及翻译,促使肿瘤生长[32]。在骨肉瘤细胞中,GPER呈低水平表达,GPER可通过多种机制调节肿瘤的进展,包括调节细胞内cAMP、促进细胞内钙动员、活化PI3K信号通路、激活表皮生长因子受体(epidermal growth factor receptor,EGFR),促进骨肉瘤细胞增殖[33-34]。然而有研究发现,过表达或激活GPER可显著抑制骨肉瘤细胞的迁移和侵袭[15]。因此,学者们对GPER的活化与骨肉瘤进展的关系仍存在争议。
1.2.4 ERα与ERβ之间的相互作用 ERα和ERβ功能之间存在相互作用,主要表现为ERβ对ERα功能的抑制作用。ERβ能够抑制约70%的ERα依赖的调控基因,包括参与增殖和代谢的基因[35]。HALL等[36]的研究结果显示,当雌激素处于亚饱和水平时,ERβ可抑制ERα的活性,从而降低肿瘤细胞对雌激素的敏感性。PARUTHIYIL等[37]的研究结果显示,过表达ERβ可以抑制ERα阳性乳腺癌细胞的增殖,并阻碍雌激素诱导的裸鼠体内乳腺癌异种移植瘤的形成。肿瘤细胞中的ERα和ERβ可能会相互作用,共同调节肿瘤的进展。ER调节示意图见图2。
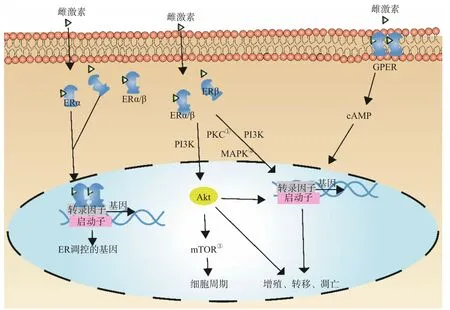
图2 ER调节示意图
2 ER在骨肉瘤进展中的作用
有研究发现,骨肉瘤发生中伴随着ER的持续减少[9],骨肉瘤细胞中ER的表达量显著低于成骨细胞[10,18]。ERα在骨肉瘤组织中几乎无表达[36],ERβ在骨肉瘤组织中的表达亦明显低于癌旁组织[28],GPER在骨肉瘤细胞中的表达水平显著低于成骨细胞[15]。骨肉瘤发生时ER减少的机制是该领域的研究热点之一。LILLO OSUNA等[10]的研究结果显示,骨肉瘤细胞中有1 379个启动子区域被高度甲基化,其中包括ER相关的启动子区域,这是导致骨肉瘤细胞ER表达低于成骨细胞的原因之一。
虽然在骨肉瘤细胞中ER呈低水平表达,但激活ER相关通路仍会对骨肉瘤细胞的生物学特性产生重要影响。雌激素可通过与ER结合诱导骨肉瘤中成骨细胞分化基因的转录,如促进碱性磷酸酶的表达等[10],具有促进骨肉瘤细胞分化的作用。有研究发现,植物雌激素大豆苷元、姜黄素等可通过不同的信号途径抑制骨肉瘤细胞的增殖,促进其凋亡,抑制细胞迁移及侵袭,对骨肉瘤有一定的疗效[38]。LILLO OSUNA等[10]发现,在骨肉瘤细胞中,ERα可通过调控碱性磷酸酶来降低波形蛋白、基质金属蛋白酶(matrix metalloproteinase,MMP)9的表达,进而影响细胞转移;过表达ERα可增强碱性磷酸酶的表达,降低骨肉瘤细胞中SOX2、OCT4、NANOG基因的表达,进而使肿瘤干细胞的干性减弱[10]。沉默ERβ的表达可激活骨肉瘤细胞的Wnt通路,降低MMP-7和MMP-9的表达,使其侵袭转移能力增强[28]。GPER通过MAPK信号通路抑制白细胞介素-6(interleukin-6,IL-6)mRNA的稳定性,使骨肉瘤细胞的侵袭、转移能力减弱。ER在调控骨肉瘤细胞生物学特性中的具体机制见表1。

表1 ER在骨肉瘤进展中的机制
3 ER在骨肉瘤治疗中的作用
有研究结果显示,接受规律化疗的骨肉瘤患者5年生存率为78.5%,而进行非规律化疗患者的5年生存率仅为35.2%[40]。化疗耐药是导致骨肉瘤患者疗效较差的主要原因之一。ER参与了肿瘤细胞耐药的发生过程。有研究结果显示,患者在化疗过程中发生顺铂耐药时,ER的表达水平有所降低[41]。在转移性乳腺癌的耐药过程中,ER表达减少,甚至消失,使乳腺癌细胞失去对雌激素的依赖性[12,42],诱发内分泌治疗耐药和转移。因此,ER与肿瘤细胞对化疗药物的敏感性密切相关,肿瘤细胞耐药的发生通常伴随着ER表达的减少和异常激活。当骨肉瘤患者发生顺铂耐药时,多药耐药相关蛋白(multidrug resistance-associated protein,MRP)表达增加,促进细胞内药物的排出,从而减少药物在细胞内蓄积[43]。但是有研究发现,在发生顺铂耐药时,ER的表达水平降低了,而提高ER的活性或者表达水平可影响肿瘤细胞对化疗药物的敏感性[42]。参与凋亡的信号通路有多种,如PI3K/Akt通路[44]、p38-MAPK通路[45],凋亡信号通路的抑制或缺失也会减弱顺铂的细胞毒性作用。凋亡信号通路的异常改变可影响ER的表达及活性,进而降低骨肉瘤细胞对顺铂的敏感性[46]。DNA甲基转移酶抑制剂地西他滨可使骨肉瘤细胞的ER重新表达,进而与雌激素协同作用,显著抑制骨肉瘤细胞的增殖[9],而敲除ERα基因则可抑制地西他滨的药效[10]。因此,ER的表达水平与活性改变与骨肉瘤的化疗耐药密切相关。
由于ER在调控骨肉瘤细胞的增殖、转移和药物敏感性中发挥着重要的作用,因此调控ER的功能或活性可能会影响骨肉瘤的进展。目前,选择性ER调节剂有三苯乙烯类(他莫昔芬)、苯并噻吩类(雷洛昔芬)和萘类(拉索昔芬)3类[47]。他莫昔芬在乳腺组织内表现为ER拮抗,通常用于ER阳性乳腺癌患者的内分泌辅助治疗,可增强雌激素对肿瘤生长的抑制作用[48];而在骨组织、心血管系统中,他莫昔芬具有激活ER的作用[49]。因此,他莫昔芬可作为化疗增敏剂,增强肿瘤患者对化疗药物的敏感性[50]。有研究发现,他莫昔芬联合多柔比星在体外实验中协同抑制了骨肉瘤细胞U2OS的增殖[51]。因此,选择性ER调节剂对骨肉瘤细胞侵袭、转移的影响具有潜在的临床价值。
4 ER在骨肉瘤治疗中的作用展望
骨肉瘤的临床特点是疾病进展快、易出现转移、易产生化疗耐药性,因此预后极差。在骨肉瘤的发生中常伴随着ER水平的持续降低,且骨肉瘤细胞中ER的表达水平显著低于成骨细胞[10,18]。虽然ER在骨肉瘤细胞中呈低水平表达,但其对骨肉瘤的侵袭、转移及药物敏感性仍具有重要的调节作用[10]。提高ER的表达水平或活性可有效改变雌激素/ER依赖的转录因子的表达,进而抑制骨肉瘤细胞的转移[15]、促进骨肉瘤细胞的凋亡[35]。未来有望将内分泌治疗和化疗的联合用药方案用于骨肉瘤治疗,以达到增加药物疗效、降低化疗药物毒性反应的目的。

