兽用碱性恩诺沙星粉的制备和稳定性研究
林章秀 厦门惠盈动物科技有限公司 福建厦门 361023
恩诺沙星也叫做乙基环丙沙星,药物是属于喹诺酮类的抗生素,是指定为动物的专用药物,属于广谱的杀菌药。主要是对支原体有比较强的抗菌作用,也对大肠杆菌、克雷伯杆菌、沙门氏菌、变形杆菌、嗜血杆菌以及金黄色葡萄球菌、溶血性巴氏杆菌有一定抗菌作用。对绿脓杆菌、链球菌作用较弱,对厌氧菌作用微弱。对敏感菌有明显的抗菌后效应。但恩诺沙星难溶于水,临床应用时,很容易造成药物损失,增加了养殖成本。为提高恩诺沙星溶解度,本试验利用无水碳酸钠与恩诺沙星通过混合法制备碱性恩诺沙星粉,并进行稳定性试验,为该制剂的临床应用提供试验依据。
1 材料和方法
1.1 主要药品与试剂恩诺沙星(浙江国邦药业,批号151015-10,含量99.0%);无水碳酸钠(唐山三友化工股份有限公司,批号180109);恩诺沙星对照品(中国兽医药品监察所,批号H0081206,含量99.9%);乙腈为色谱纯,磷酸、三乙醇胺均为分析纯,购自西陇科学股份有限公司;水为超纯水,实验室自制。
1.2 仪器和设备电子天平(梅特勒-托利多仪器(上海)有限公司,型号MS105DU);超声波清洗器(天津市东康科技,型号DS-3120);实验型pH计((雷磁)上海仪电科学仪器股份有限公司);电热恒温干燥箱(上海精宏实验设备有限公司,型号DHG-9247A),;高效液相色谱仪(上海伍丰科学仪器有限公司,型号LC-100);电子秤(厦门懿恒电子有限公司,型号TCS-150);振荡筛(常州市范进干燥设备厂,型号10022);V型高效混合机(常州市范进干燥设备厂,型号V-1000)。
1.3 碱性恩诺沙星粉制备按质量比M(恩诺沙星)∶M(无水碳酸钠)=1∶9,称取原辅料,进行过筛。过筛顺序为先恩诺沙星,后无水碳酸钠;筛网目数为60目。过筛后的物料投入V型混合机中进行混合(总物料体积应为混合机总容积的30%~70%)[1]。混合时间10 min,混合结束后采用随机取样法,在混合粉体的不同部位随机取10份样品,进行含量均匀度测定,并以此为评价指标对混合时间进行验证。另取样品,进行水中溶解度、1%水溶液pH测定。产品制备3批次,批号分别为180301、180302、180303。
1.4 碱性恩诺沙星粉检测
1.4.1 碱性恩诺沙星粉含量均匀度的测定 称取碱性恩诺沙星粉样品10份,按恩诺沙星粉(水产用)[2]质量标准进行含量检测,测定以标示量为100的相对含量X,求其均值和标准差S,以及标示量与均值之差的绝对值A。若A+2.2S≤15.0,则供试品的含量均匀度符合规定[3]。
1.4.2 碱性恩诺沙星粉溶解度的测定 分别称取碱性 恩 诺 沙 星1.00 g、2.00 g、3.00 g、4.00 g、5.00 g、6.00 g、7.00 g、8.00 g、9.00 g、10.00 g、11.00 g、12.00 g,分别置于100 mL的容量瓶中,加入适量纯化水(25±2℃),定容,每隔5 min强力振摇30 s;观察溶解情况,观察30 min,当看不见恩诺沙星颗粒时,即视为完全溶解[3]。
1.4.3 碱性恩诺沙星粉1%水溶液pH测定 称取3批次碱性恩诺沙星粉各1.00 g,加入100 mL纯化水,搅拌使溶解,按溶液pH检测方法进行检测,对检测结果取平均值。
1.5 碱性恩诺沙星粉稳定性试验配制3批恩诺沙星与无水碳酸钠(1∶9)样品,混合10 min,其中1批进行影响因素试验,取3批进行加速试验和长期稳定性试验[2]。
1.5.1 影响因素试验 取1批碱性恩诺沙星粉样品,用纯铝袋包装进行试验。(1)高温试验:置于60℃恒温箱中;(2)高湿试验:置于25℃、相对湿度92.5%的恒温恒湿箱中;(3)强光照射试验:置于照度为4 000 Lux的光照箱中。
每项试验期为10 d,于第5 d、第10 d取样,观察外观和性状,检测pH值、水分及恩诺沙星含量。考察结果与第0 d的检测结果进行比较,进行统计分析,数据以平均值表示。
1.5.2 加速试验 碱性恩诺沙星粉样品取3批,用纯铝袋包装,放置在恒温恒湿箱中,设置温度40℃、相对湿度75%,放置6个月。在第1、2、3、6月时取样,检测外观与性状、水分、pH值、恩诺沙星含量。检测结果分别与第1 d的检测结果进行比较,进行统计分析,结果以平均值表示。
1.5.3 长期稳定性试验 碱性恩诺沙星粉样品取3批,用纯铝袋包装,在25℃、相对湿度60.0%的条件下遮光密封保存24个月,分别于第3、6、9、12、18、24个月月末取样1次,检测外观性状、色泽、pH值、水分及恩诺沙星含量变化。恩诺沙星含量测定采用HPLC法,色谱条件:用十八烷基硅烷键合硅胶为填充剂;以0.025 moL/L磷酸溶液(用三乙醇胺调节pH值至3.0)-乙腈(83∶17)为流动相;进样量为10μL;检测波长为278 nm;流速为1.0 mL/min。理论塔板数按恩诺沙星峰计算不低于2 500。分别与第1 d的检测结果进行比较。
2 结果与分析
2.1 碱性恩诺沙星粉含量均匀度结果碱性恩诺沙星粉通过混合机混合10 min,3批次的A+2.2S数值都小于15,含量均匀度符合兽药典要求,因此,以恩诺沙星与无水碳酸钠1∶9混合10 min的生产工艺合理。见表1。
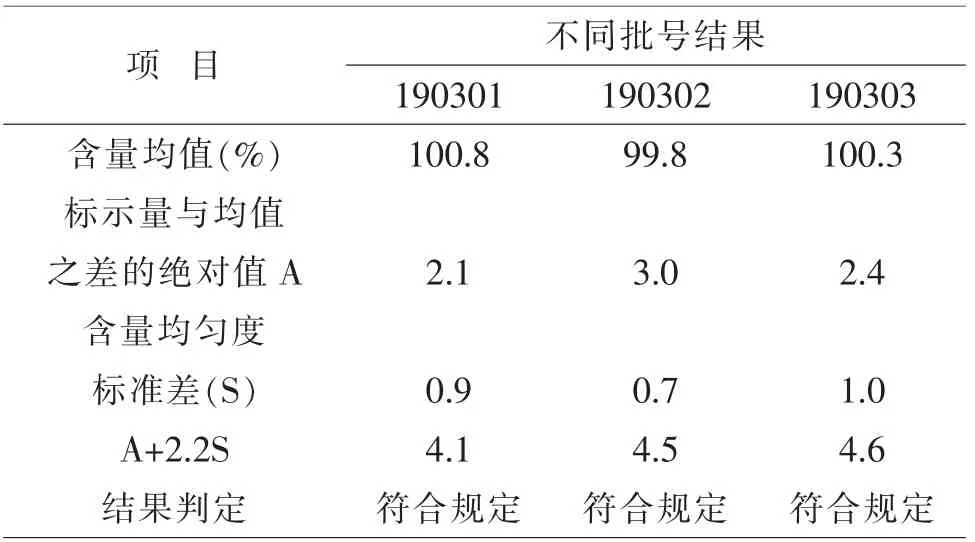
表1 含量均匀度结果
2.2 碱性恩诺沙星粉溶解度的测定结果当100 mL水中的碱性恩诺沙星为10.00 g时,溶液无可见颗粒,视为完全溶解;而当碱性恩诺沙星粉为11.00 g时,还有可见颗粒,视为不完全溶解(见表2)。因此,确定该碱性恩诺沙星溶解度约为10.00 g/100 mL(不完全精确),完全能满足对于需要通过加药器给药的养殖场。
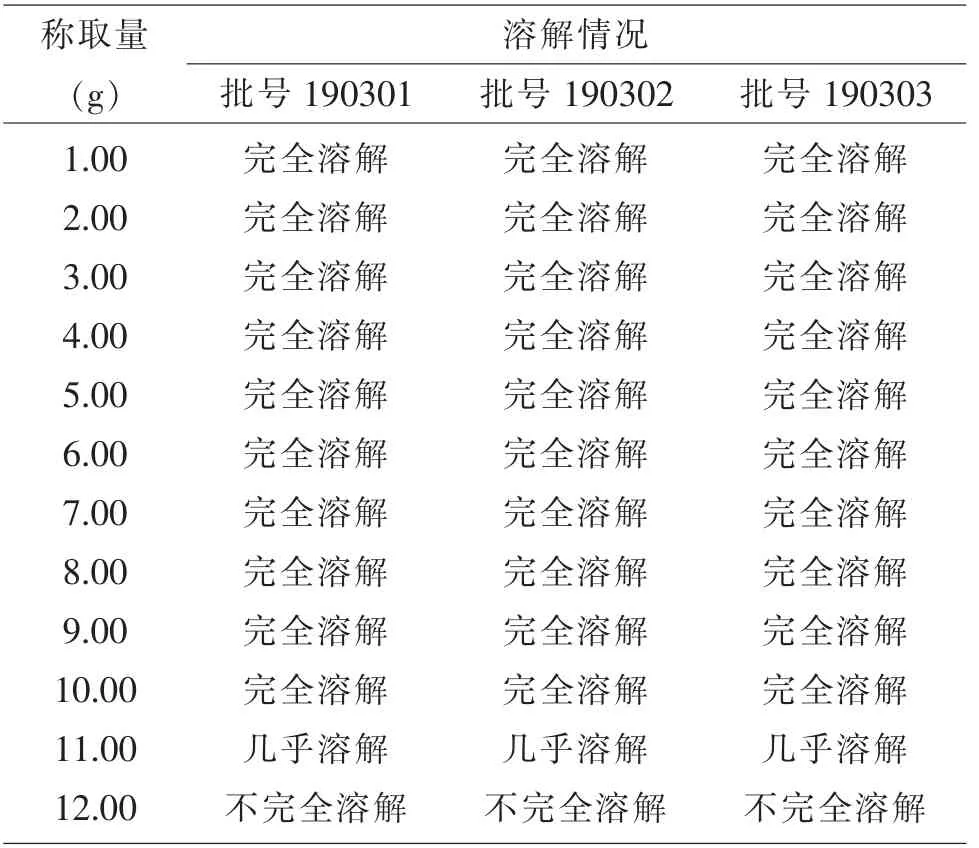
表2 溶解度测定结果
2.3 碱性恩诺沙星粉1%水溶液pH测定结果由表3测定结果可知:碱性恩诺沙星粉1%水溶液的pH在11.12~11.25。

表3 1%水溶液pH测定结果
2.4 稳定性试验结果由表4可知:碱性恩诺沙星粉在高温、高湿、强光照射条件下放置时,外观和性状、pH均无明显变化;水分逐渐升高,恩诺沙星含量逐渐下降。
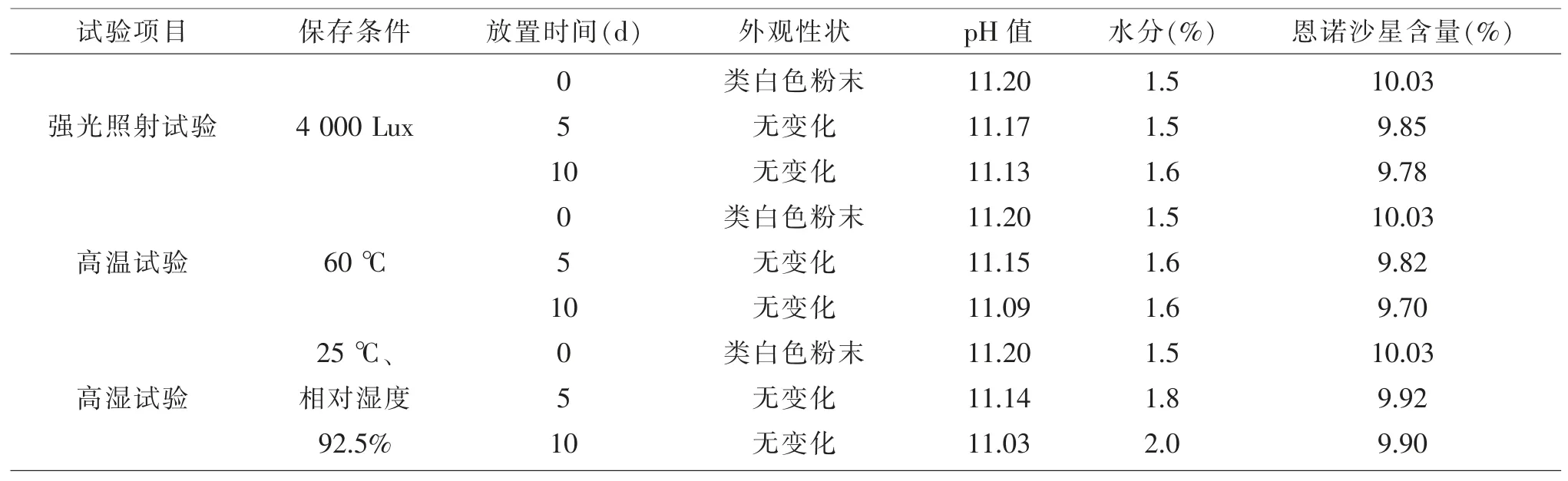
表4 碱性恩诺沙星粉影响因素试验结果(n=1)
由表5可知:在加速试验整个过程中,碱性恩诺沙星粉的外观、pH值基本无变化,水分随时间延长逐渐升高,恩诺沙星含量随时间延长逐渐降低。
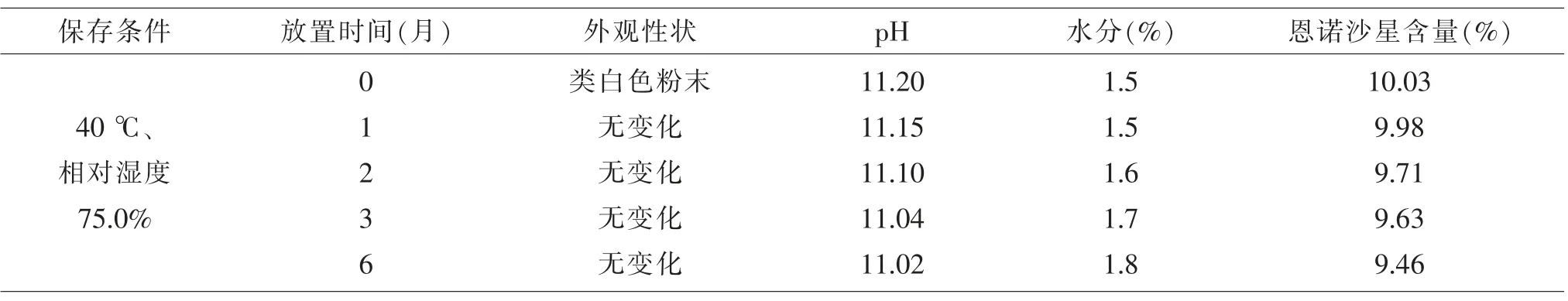
表5 碱性恩诺沙星粉加速试验结果(n=3)
由表6可知:样品存放2年期间,外观性状未发生明显改变,pH值有降低趋势;水分由1.5%增加至2.5%;恩诺沙星含量由10.03%下降至9.62%,含量下降未超过标示量百分含量的10%,符合规定。说明该碱性恩诺沙星可溶性粉配方及工艺科学、合理、简单易操作,产品质量稳定,有效期暂定2年。
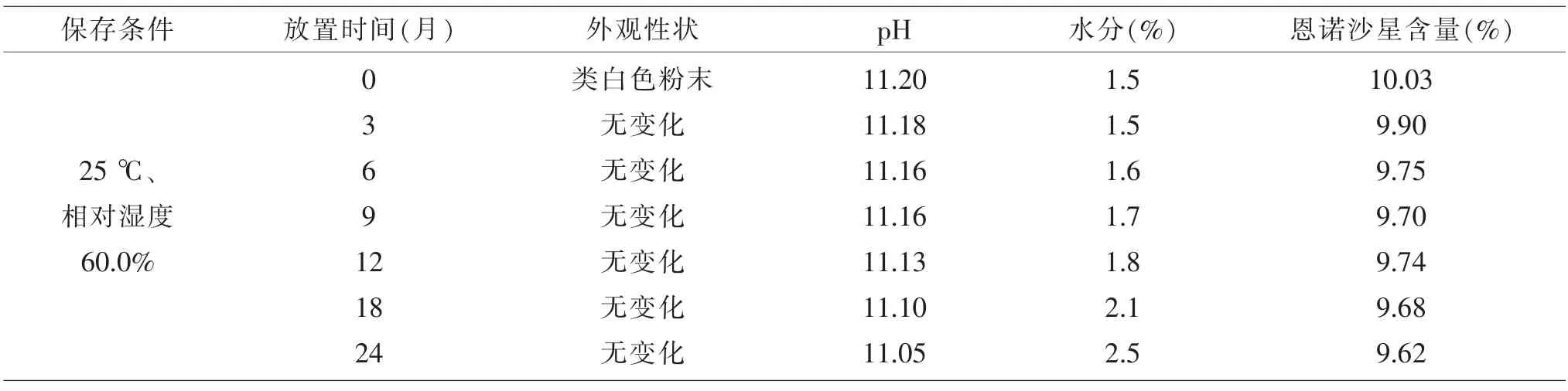
表6 碱性恩诺沙星粉长期稳定性试验结果(n=3)
3 结 论
经过前期小样测试,可以确定该配方比例为质量比M(恩诺沙星)∶M(无水碳酸钠)=1∶9,碱性恩诺沙星粉的含量规格为10%。
稳定性试验,是考察药物随着温度、湿度、光线的变化,放置不同时间变化的规律,为兽药的生产过程、包装材料、保存期、运输条件提供了科学依据,可确定产品的有效期限[4]。兽药的有效期,是衡量药物稳定性的重要指标,一般指的是在(25±2)℃、相对湿度(60%±10%)条件下,当药物含量降解至标示量的90%时所需要的时间[5]。本试验中,包装样品用的纯铝袋,具有很好的遮光、防潮性能,密封性好。用该纯铝袋分装碱性恩诺沙星粉,密封保存24个月,其外观和性状、pH值均无明显改变,水分和恩诺沙星含量略有变化,但检测结果合格、均符合兽药典的要求,因此,有效期可暂定为2年。
该碱性恩诺沙星可溶性粉配方合理、工艺科学,简单易操作,产品质量稳定,可以进行规模生产。

