人工智能辅助诊断系统对主动脉夹层CTA诊断的价值
齐海成 张焕文 辛 娟 刘 倩 栗 岩 邢 艳
主动脉夹层(aortic dissection,AD)是心血管疾病中的一种高危疾病,发病突然,进展迅速,急性致死率高达65%~70%,手术治疗为其主要治疗手段,及时正确的诊断和精准的术前影像评估在AD 治疗中发挥重要作用[1-3]。在可疑AD 的患者中,主动脉CT血管成像(computed tomography angiography,CTA)是首选的成像方式,因为与其他成像方式相比,它具有广泛的可用性以及快速的图像采集和处理能力,以及95%的出色灵敏度,但主动脉CTA 对AD 的诊断及后处理过程需大量医疗资源和人力资源,在主动脉直径测量方面,是主观、费时的,所以需更高效、精准的AD 的诊断方法[3-5]。近来,人工智能(artificial intelligence,AI)等前沿技术逐渐应用于医疗领域,如AI 应用于肺结节检测、动脉瘤、心血管图像重建等领域中,AI对于AD 完成了自动分割及测量,而其对于AD 的诊断效能、对影像医师工作效率提高的研究较少[6]。本研究采用自身对照的方法,探讨AI 辅助诊断系统对AD的诊断价值。
方 法
1. 研究对象和方法
本研究前瞻性收集2020 年7 月1 日至2020 年12月31 日在本院经主动脉CTA 诊断为AD 的患者(n=72),其中排除假腔内血栓较大的患者(n=4)、图像质量差的患者(n=6)、主动脉主要分支起源异常的患者(n=1),局限性夹层患者(n=3),最后共纳入58 例患者,其中男45 例,女13 例,年龄(52.75±11.41)岁。
选择7 个测量位置,包括心脏病学会(European Society of Cardiology,ESC)2014 指南中推荐的位置:头臂干动脉开口前(P1),左颈总动脉开口前(P2),左锁骨下动脉开口前(P3),左锁骨下动脉开口以远(P4),腹腔干水平(P5),最下肾动脉远端(P6)和髂动脉分叉前(P7)。邀请2名在血管图像后处理和诊断方面的高年资放射科医师(R1 和R2)进行直径测量、诊断分型及确定破裂口数量,所有直径都是基于多平面重组法测量的,这种方法被认为是最准确和可靠的,并且观察者之间的差异最小[7],参考标准中直径测量是R1 和R2 的平均值,同时比较R1和R2 的直径测量、诊断结果及破裂口数量,以评估两者组间差异。
2. CT检查及图像分析
主动脉CTA 是使用多种CT 设备采集,包括Discovery CT 750HD、 LightSpeedVCT (GE Healthcare,美国威斯康星州Waukesha)。患者仰卧位,从胸腔入口到耻骨联合的水平进行CT 扫描,并用0.625 mm 或1.25 mm 重建。体重指数(BMI)>30 kg/m2的患者管电压为120 kV,20~30 kg/m2的患者管电压为100 kV,<20 kg/m2的患者管电压为80 kV,X射线管电流自动调整。数据传入工作站(GE Advantage Workstation 4.6),获得三维重组图像,包括多平面重组(multiple planar reformation,MPR)、曲面重建(curved planar reformation,CPR)、最大密度投影(maximum intensity projection,MIP)、容积再现技术(volume-rendered technique,VRT)等。医师在三维重建图像上进行各点位直径测量,给出诊断结果及分型、破裂口数量等,同时记录后处理分析、测量及诊断时间。
3. AI图像重建及分析
主动脉CTA 扫描获得的原始图像上传至主动脉AI 辅助分析软件(AortaDoc,数坤科技),主动脉AI的算法流程如下。①自动识别主动脉:通过3D U-net网络实现主动脉整体(EA)的分割。②通过IoU 追踪技术实现对真腔(TL)和假腔(FL)的识别。③自动生成中心线:体数据完成构建后,算法自动定位管腔的中心点,管腔向中心收缩,形成血管中心线。④判断夹层类型,并根据中心线走向找到升主动脉段、降主动脉段等,若假腔区域累及升主动脉段则诊断为A型夹层,若假腔区域仅累及降主动脉段则诊断为B 型夹层[3]。⑤自动测量:依据ESC 2014 指南推荐的主动脉位置,AI 算法可自动识别主要分支,按推荐位点对应层面进行自动测量整体EA、TL 和FL的直径,旋转内腔选择最大值及最小值。⑥自动诊断:根据2D、3D 图像上撕裂内膜范围,然后输出诊断、管腔直径、主要分支的累及情况,破裂口数量及诊断时间[8]。
4. 统计学分析
采用SAS9.4软件及Medcalc进行统计学分析。计量资料以均数±标准差(±s)表示,使用配对t检验(用于正态分布的变量)或Wilcoxon 秩检验(用于非正态分布的变量)进行比较,P<0.05 具有统计学意义,比较AI 和参考标准之间的测量值和测量时间,线性相关图、Bland-Altman图用于显示参考标准与AI之间的差异;组内相关系数(ICC)评估参考标准观察者之间手动测量的可重复性(ICC>0.8 为一致性较好);诊断结果及破裂口数量的一致性采用kappa 检验(kappa≥0.75 为二者一致性较好,0.75<kappa<0.4为一致性一般,kappa<0.4为一致性较差)。
结 果
1. AI测量和诊断的准确度评估
1.1 直径测量
线性相关图(图1A~C)结果显示,AI 在识别EA、TL、FL 时与参考标准之间的相关系数分别为0.912、0.901、0.873(均P<0.001)。在Bland-Altman图(图1D~F)中,蓝色实线表示差值的平均值,红色虚线分别表示95%一致性界限的上限和下限,参考标准与AI 结果的对比,分别为整体0.1(-6.2~6.5)mm,真腔-0.1(-7.5~7.2)mm,假腔0.8(-10.6~12.2)mm。
1.2 诊断结果
根据主动脉夹层累及的范围,按Stanford 分型为A 型和B 型,AI 和参考标准之间诊断分型kappa=1,两者一致性较好(表1)。
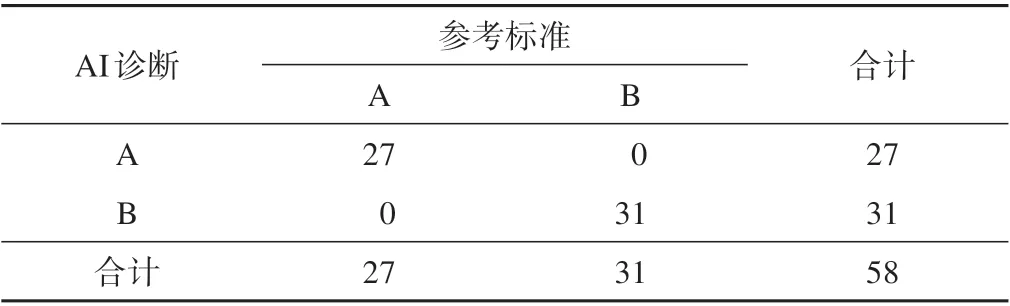
表1 AI和参考标准诊断分型的一致程度
1.3 破裂口数量
在诊断破裂口数量中AI 和参考标准之间kappa=0.50,两者一致性一般(表2)。
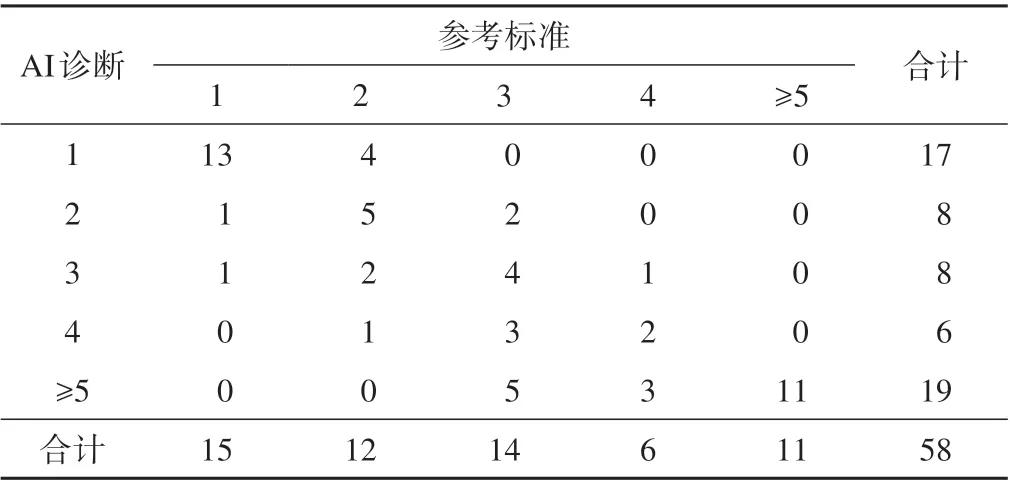
表2 参考标准和AI破裂口数量的一致程度
1.4 时间对比
AI 与手动方式对图像处理及分析的时间比较:AI 在获取图像后自动分割、测量、诊断,此计算过程需要的时间为(19.34±1.44)min;医生手动处理图像及报告的时间为(67.97±7.26)min;AI 对图像重建及分析的时间少于医生手动(P<0.001)。
2. 组间差异
参考标准R1和R2在直径测量中整体、真腔、假腔 的ICC 值 分 别 为0.986、0.996、0.998,P<0.001(双向随机绝对一致性且单一度量模型),直径测量一致性较好,可重复性较好;R1 和R2 之间的诊断分型kappa=1,两者一致性较好;R1 和R2 之间破裂口数量判断kappa=0.827,两者一致性较好(表3~5)。

表3 R1和R2直径测量的差异
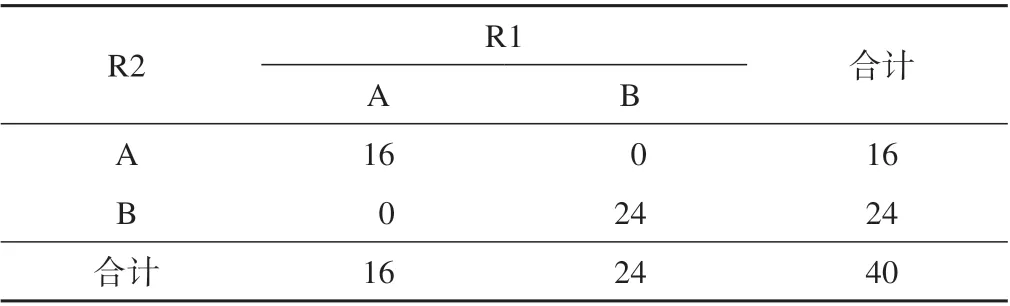
表4 R1和R2诊断结果的一致程度
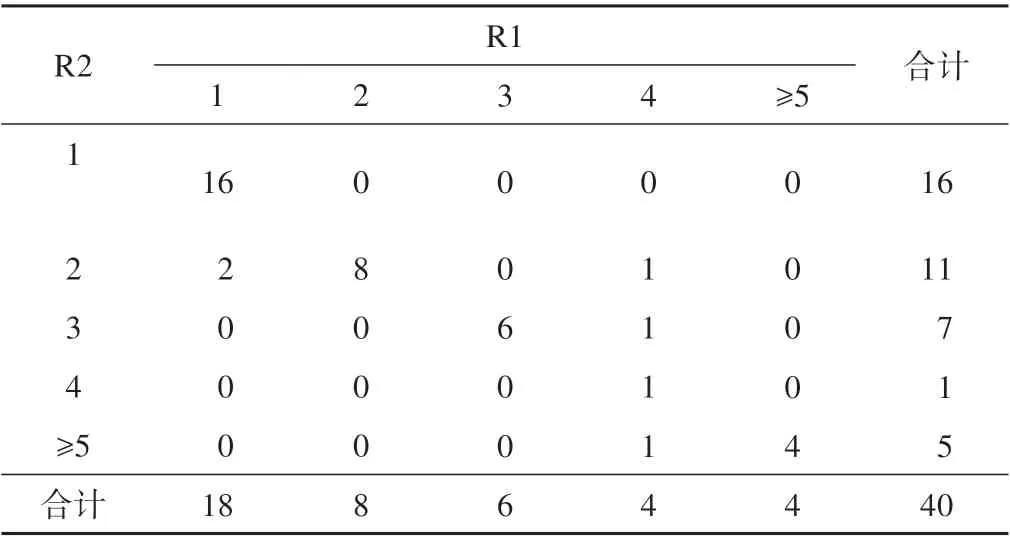
表5 R1和R2破裂口数量的一致程度
讨 论
随着人们生活水平及健康意识的提高,加上中国人口老龄化现象越来越严重的现状,如今心血管疾病筛查面临巨大的增量市场。近年来,基于对疾病辅助诊疗和防治的信息化及便捷化的极大需求,研究者们逐渐将AI 的应用聚焦于医学领域[9-10]。AI 技术近几年来在医学方面发展迅速[11-12]。
目前AI 只是初步应用于心血管影像领域,过于依赖现有数据,缺乏创新思维和独立整合分析能力[13]。因此,单纯依赖AI 还是很难在心血管医学上取得全面突破。只有将AI与临床医生的思维相结合,才能有望提高其对心血管疾病预测的准确性和整体医疗水平,从而促进心血管医学更加精确的发展。
本研究参考标准中高年资医生间直径测量、诊断结果、破裂口数量均具有高度一致性。AI 与参考标准在EA、TL 和FL 直径测量的相关系数均大于0.85(P<0.001),Bland-Altman 图显示AI 和参考标准之间的直径偏差对于EA、TL 和FL 分别为0.1(-6.2~6.5)mm、-0.1(-7.5~7.2)mm 和0.8(-10.6~12.2)mm,说明AI 与参考标准在AD 直径测量方面的一致性较好,EA、TL 和FL 均显示出较好的性能和精度,诊断结果一致性较好(kappa=1),AI 对图像重建和分析的时间明显少于高年资医生(P<0.001)。自动化的主动脉分割方法已得到广泛研究,AI 可以评估模型的准确性和一致性,显示真正的主动脉形态[14]。因此,AI 有助于准确判断血管腔的大小,正确的诊断和精准的术前影像评估,可加快诊断评估的速率,有利于选择合适的支架以及其他治疗方式。此外,工作效率明显少于传统人工后处理时间,这不仅可以减轻医务工作人员的负担,而且也减少患者获取报告时间,缓解医疗资源紧张,从而降低医疗费用等,最终使广大患者获益。但在本研究中,AI 和参考标准间破裂口数量的一致性一般(kappa=0.50),在今后AI模型研究中仍需进一步加强对破裂口数量的识别。
本研究有几个局限性:首先,由于主动脉夹层的患病率较低,收集病例是单中心数据,样本含量较少,在以后的研究中应该扩大样本量并多中心研究,减少偏倚,将有助于进一步检测人工智能的性能。其次,本次研究对于假腔内血栓较大者未进行研究,在以后将进一步研究;最后,没有进行Stanford 分型检测,以后的研究中应该按照Stanford 分型,分别进行A和B型的诊断效能检测。
结论,AI 现如今能够很好地识别出主动脉夹层的真腔、假腔及内膜片,并分别测量EA,TL 和FL的直径,对于AD的CTA图像能够自动化处理并准确度较高,且此过程时间较短,在AD 的CTA 诊断方面,诊断效能较好,但AI 在判断破裂口数量方面一般,因此AI 可作为辅助诊断AD 的手段。AI 对于呼吸伪影较大、假腔内血栓较大、先天性变异等的诊断差异较大,若是能克服以上问题,AI可成为诊断AD更有效的手段。

