CT引导下肺肿瘤射频术中多平面重组的应用价值
孙 军 付 玏 潘嘉炜 孙华平
CT 引导下射频消融术是介入放射学中经常使用的治疗手段,因其能发现较小体积的肿瘤并精准定位,手术过程快捷安全、创伤小、恢复快,并发症少等优点,已广泛应用于临床治疗。近年来随着影像设备、技术的发展,肺肿瘤的检出率呈逐年增长的趋势[1]。本研究通过比对在CT 引导下射频消融术中采用常规定位扫描(常规组) 和多平面重组(multiplanar reformation,MPR)辅助(MPR 组)治疗肺肿瘤时的调整进针次数、操作时间及术中并发症等各项指标,来探讨MPR 在CT引导下射频消融术中的应用价值。
方 法
1. 研究对象
回顾性收集本院2016 年至2019 年经细胞学、组织学确诊的,且接受CT 下射频消融术治疗的肺肿瘤患者,并根据术中定位方法分组:①术中射频针定位采用常规轴位扫描组:②术中射频针定位结合MPR重建组。
2. CT扫描参数及手术器材
CT 扫描仪采用佳能Aquilion tsx-101A。常规轴位扫描参数:120 kV,140 mA,螺距0.9,FOV 400 mm×400 mm,重建层厚5 mm,重建间隔5 mm,单次扫描时间1~3 s。发现病灶后进行靶向重建,重建层厚1 mm,重建间隔1 mm。
射频针采用迈德医疗(上海)公司生产的射频消融电极针,功率0~90 W,选用21-A63671 型号的多极爪形针,如图1 所示(针杆直径16 G,长10~15 cm,消融范围3~5 cm),温度设置为100℃,功率设置为70 Wo
3. 方法及图像后处理
3.1 常规轴位扫描组
①患者术前禁食禁水6 h,采用局麻方式,术中心电监护仪监测生命体征。②根据既往影像学资料选择检查体位(仰卧位、俯卧位或侧卧位),并选择扫描范围和放置定位条。扫描过程中嘱咐患者平静状态下屏气[2]。③扫描结束后,观察肿块最大径、肿块离胸膜的距离,并模拟最佳进针点、测量进针角度、设定射频功率、评估因肿瘤位置可能导致的术中并发症等,选取已计划的最佳进针点进行体表定位,并进行铺巾、消毒、局麻步骤。④在射频针进针过程中可多次进行CT 扫描(图2),以反复确认射频针主干部分与肿瘤的关系并及时做出调整[3]。⑤当射频针主干部分靠近肿瘤边缘时,根据肿瘤最大径来释放伞形射频电极的长度,并通过CT 扫描来确认伞形射频电极是否已覆盖整个肿瘤并保证消融有效范围超过肿瘤边缘0.5~1 cm[4],确认范围后可进行射频消融治疗。⑥当肿块体积较大或形态极为不规则等情况时,可选取肿块不同部位分次重叠消融。⑦射频消融结束后,在退针过程中,须进行针道消融,避免发生肿瘤细胞通过针道转移的可能性。⑧术后即刻复查全肺CT,观察有无气胸、出血等并发症。
3.2 MPR组
相比于常规轴位扫描组,MPR 组不同的步骤主要是④和⑤这两个过程。在射频针进针过程中以及打开伞形射频电极的过程中,多次进行CT 扫描后,立即重建1 mm 薄层容积数据,并结合MPR 重组成矢状位和冠状位图像来观察进针点、射频针主干部分、射频针针尖位置、肿瘤中心、瘤体边缘和周围结构之间的三维立体空间关系(图3)。这样操作的优势在于:①快速定位,能较快地确定射频针和肿瘤中心的位置;②完善有效的射频消融范围,能三维立体地观察射频电极远端和肿瘤边缘的关系;③可有效避免术中并发症的发生,并可以通过三维立体的观察角度来避开肿瘤附近的血管、气管、膈肌、心包等组织结构。
4. 统计学分析
使用SPSS 22.0软件分别比较对两组肿块最大径、肿块离胸膜的距离、调整进针次数、手术操作时间、术中并发症人数,并采用t检验进行比较;P<0.001设为显著性差异。
结 果
共收集40 例患者,所有患者均在射频消融术前行病理活检,其中腺癌24 例、鳞癌12 例、肺转移瘤3 例、软骨肉瘤1 例。统计常规轴位扫描组和MPR 组的病灶最大径、肿块至胸膜距离、调整进针次数、手术时间、并发症人数得出数据(表1)。
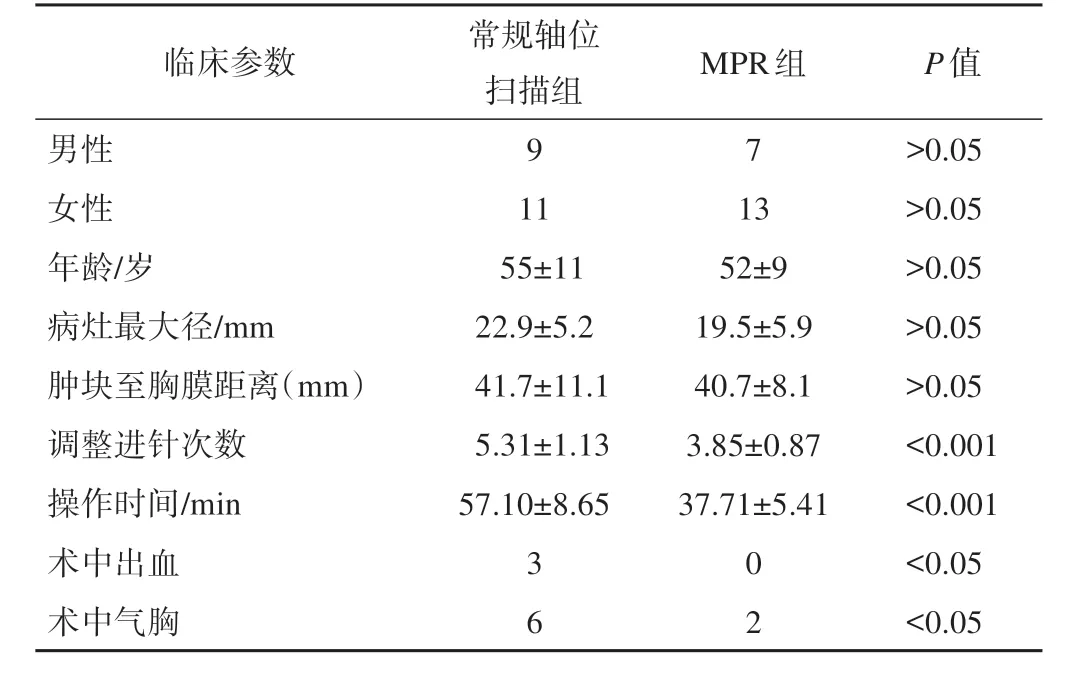
表1 常规轴位扫描组和MPR组的临床参数比较结果
综上,CT 引导下肺肿瘤射频消融术在结合MPR多平面重建技术后,能有效减少手术时长,能有效降低并发症的发生率。
讨 论
1. CT引导下射频消融术
肺肿瘤外科手术已逐步趋向于微创化、腔镜化,但仍有部分患者因各类原因不能或不愿接受外科手术切除肿瘤。CT 引导下肿瘤射频消融技术应运而生,成为了一个新兴的治疗手段。
CT引导下射频消融术是应用消融电极,在CT引导下经皮穿刺,使射频针进入实体肿瘤组织,然后在消融电极针前端伸展出多个伞形细电极丝,穿过肿瘤组织并通过射频输出,使病变区组织细胞离子震荡摩擦产生热量,局部温度可达100℃,通过高温使肿瘤组织发生凝固性坏死,最终形成液化灶或纤维化组织,从而达到局部消融及治疗的目的[5]。
2. MPR技术在射频消融术中的作用
2.1 准确显示病灶与周围结构的关系
应用MPR 技术对原始扫描数据处理后,可获得精确的多平面重建图像,有助于直观显示病灶部位、大小、形态以及与相邻层面的组织如血管、支气管、心包等之间的解剖关系,可有效避免肿瘤周围重要结构等的损伤。
2.2 减少进针次数
以定位扫描后重建的MPR 图像为参照,模拟进针路线的角度和深度进针,术中一般无需频繁调整穿刺的方向和深度,可减少穿刺针反复进出肋间和胸膜的次数,同时减轻患者术中的不适感。
2.3 减少操作时间
在CT 扫描后的20 s 之内即可获取MPR 图像供术者使用,在射频针到达预定位置边缘和打开伞型电极时各扫描1 至2 次即可确定针尖位置是否达到操作要求,既节省了常规定位时的CT 反复扫描时间,又因定位精确,穿刺次数减少,总的操作时间可大大缩短[6]。
2.4 减少并发症
CT 引导射频消融术主要的并发症是气胸和出血。因射频针进入肺组织过程中会损伤胸膜及针道旁肺组织,易引发气胸。肺内出血与射频针路径及血管分布情况有关。在进针入路时,应尽量避开血管,以免出血。此外,当肿瘤靠近膈肌、主支气管、心包等时,常规定位极有可能会损伤邻近组织器官、甚至破裂出血,且消融有效范围需要超出病灶边缘0.5~1 cm,而在打开射频电极时,电极远端存在超出肿瘤边缘损伤到邻近重要解剖结构的可能,也加大了手术风险。本研究中并发症发生率为27.5%(11/40),其中气胸8例,出血3例,较以往文献报道略低[6]。
3. 术中影响因素
在CT 引导的射频消融术中,影响MPR 图像质量的主要因素有两个:①患者呼吸配合度,患者的呼吸移动度是直接影响手术进程和图像成像质量的重要因素,肺内肿瘤的位置受呼吸运动影响较大,影响穿刺进针的准确性和射频消融的治疗效果[7]。②金属伪影,由于射频针属于金属材质,在CT 扫描中,金属异物产生的放射状伪影在一定程度上会对诊断造成影响。
CT 引导下射频消融术作为一项微创治疗技术,具有创伤小、手术时间短、并发症少等优点,已广泛应用于临床。如能在术前利用多平面重建功能,为消融术提供可靠的多平面解剖数据,选择最优化穿刺路径,尽可能避开血管、神经,精确定位,使经皮穿刺的准确度提高[8],对提高治疗效果会有重要的临床价值。

