脑淀粉样血管病与阿尔茨海默病18F-FDG PET/CT代谢改变图型对比研究
贾琛皓,吴美其,郭瑞杰,倪 俊,崔瑞雪
中国医学科学院北京协和医院 1核医学科 2神经科, 北京 100730
脑淀粉样血管病(cerebral amyloid angiopathy,CAA)是临床常见的年龄相关性脑小血管病,以反复出现多部位脑叶自发性出血和/或认知功能下降为主要临床表现,其病理基础为β淀粉样蛋白(amyloid β-protein,Aβ)沉积于皮质和软脑膜小血管壁[1- 4]。目前CAA的诊断依据主要基于修订版Boston标准[5],其将CAA诊断水平分为确诊(definite)、病理支持的很可能(probable with supporting pathology)、很可能(probable)和可能(possible)4个级别,实现了临床水平的CAA诊断。
对于很可能CAA的诊断,主要依据临床资料与头颅MRI显示脑叶皮层或皮层下出血。尽管该诊断标准在尸检病例中具有较高的诊断特异度(约90%),但对脑出血人群的诊断灵敏度较低(约40%)[5]。18F-AV45正电子发射断层显像/计算机体层成像(positron emission tomography/computed tomography, PET/CT)可探测到人体内沉积的Aβ,既往研究中对CAA具有较高的诊断灵敏度(约90%)[6- 9],但其他认知功能障碍性疾病如阿尔茨海默病(Alzheimer’s disease,AD)患者亦存在脑组织Aβ沉积,以致其诊断的特异性减低[9]。除具有相似的病理特征外,以认知功能障碍为主要改变的CAA在临床表现方面亦易与AD混淆,且二者在同一病例中可同时存在[2]。因此,相似的临床表现和交叉重叠的病理特征,使得临床实践中CAA与AD鉴别诊断的难度增大。18F-脱氧葡萄糖(fluorodeoxy glucose,FDG) PET/CT可反映脑组织糖代谢情况,是应用最广泛的脑功能显像方法,在AD、帕金森综合征等多种神经变性疾病中均呈特征性代谢减低模式[10- 13]。目前,CAA患者18F-FDG PET/CT显像特征相关研究罕有报道[14]。本文旨在分析CAA患者18F-FDG PET/CT脑显像的代谢特点和代谢异常区域,并与AD患者比较,评估18F-FDG PET/CT在CAA与AD鉴别诊断中的应用价值,筛选可用于二者鉴别诊断的脑代谢参数。
1 资料与方法
1.1 研究对象
回顾性纳入2020年12月至2021年6月北京协和医院核医学科行18F-FDG PET/CT脑显像的很可能CAA患者和AD患者。纳入标准:(1)CAA患者依据修订版Boston标准判定为很可能CAA[5]:①限于脑叶、皮质或皮质-皮质下区域多灶性出血(自发性脑出血或脑微出血,包括小脑出血),或单个脑叶、皮质或皮质-皮质下出血和皮质表面铁沉积(局灶性或播散性);②年龄≥55岁;③排除其他脑出血原因。(2)AD患者依据国际工作组(International Working Group, IWG)- 2标准诊断为典型或非典型AD(包括脑脊液生物标志物检测)[15],头颅MRI未显示脑叶微出血或皮质表面铁沉积,且年龄与CAA患者相近。(3)于18F-FDG PET/CT脑显像2周内行18F-AV45 PET/CT脑显像,视觉分析均为阳性,脑内可见Aβ沉积。(4)同时期行头颅MRI检查获取磁敏感加权成像。排除标准:(1)18F-FDG PET/CT图像质量不合格者;(2)合并中枢神经系统感染性疾病、中枢神经系统肿瘤、头部外伤、有颅脑手术史及酒精和/或药物滥用者;(3)合并代谢性疾病、系统性疾病者;(4)严重心、肝、肾功能不全者。
随机纳入认知功能正常的人群为对照组,建立认知功能正常者数据库。纳入标准:(1)与很可能CAA或AD患者同期行18F-FDG PET/CT检查且图像质量合格;(2)年龄在45~90岁之间;(3)无神经系统疾病;(4)无认知障碍相关的神经系统疾病家族史。排除标准:(1)患有密闭恐惧症;(2)近一年内因其他临床医疗或科研需要,接受过本研究范畴以外的电离辐射,年辐射暴露剂量超过50 mSv。
本研究已通过北京协和医院伦理审查委员会审批(审批号:JS2423)。
1.2 方法
1.2.118F-FDG PET/CT脑显像
接受18F-FDG PET/CT脑显像检查前需禁食6 h以上。均静脉注射示踪剂18F-FDG约5.55 MBq/kg(注射前保持血糖<6.67 mmol/L),安静、避光环境下平卧约60 min后行颅脑PET/CT显像(赛诺,Pole star m680)。18F-FDG注射液由北京协和医院核医学科自行制备(Siemens RDS111型回旋加速器生产18F,TRASIS厂家ALL IN ONE合成模块制备18F-FDG,放化纯度>95%)。
图像采集方式:10 s低剂量头颅CT扫描(电压120 kV,电流150 mA),1个床位,用于衰减矫正;三维模式下进行10 min脑部PET扫描。采用有序子集最大期望值迭代法(迭代次数为4,子集数为10),获得脑横断面、冠状面及矢状面图像进行PET图像重建。
1.2.2 视觉分析
由两位核医学科医师在不参考临床资料的情况下进行图像判读,观察研究对象各脑区的代谢减低情况。
1.2.3 图像处理与定量分析
基于脑功能分析平台MATLABversionx(美国Mathworks公司)及配备的分析软件SPM12完成图像预处理。首先将医学数字成像和通信(digital imaging and communications in medicine,DICOM)格式的原始图像转化为神经影像信息技术计划(neuroimaging informatics technology initiative,NIfTI)格式,然后使用SPM12软件以蒙特利尔神经病学研究所脑图谱对PET图像进行标准化处理,转化为标准解剖空间的图像,并采用8 mm×8 mm×8 mm各项同性高斯平滑核对标准化图像进行平滑处理,消除图像中高频噪声对统计结果的影响,并获得分析图像。
1.2.3.1 基于体素的脑代谢图像定量分析
采用SPM12软件对预处理图像进行基于体素的两样本t检验(体素大小1 mm×1 mm×1 mm),获得很可能CAA患者和AD患者相较于对照组人群具有统计学差异(以P<0.01为差异具有统计学意义)的脑代谢改变图像。
1.2.3.2 脑区分析
基于SPM12软件中的脑区分割模版获得各脑区二值图像,计算很可能CAA患者与AD患者的枕叶/后扣带回(occipital/posterior cingulate,O/PC)标准摄取值比值(standardized uptake value ratio,SUVr),并进行组间比较。
1.3 样本量估算
根据既往研究结果[16],以检验效能β=0.90和检验水准α=0.05进行双侧检验,很可能CAA患者和AD患者至少各需6例。
1.4 质量控制
(1)CAA与AD的发病率均与年龄密切相关[17- 18],本研究入组的很可能CAA患者和AD患者要求年龄相近,以减少年龄的干扰;(2)研究对象进行18F-FDG PET/CT脑显像时,均采用相同的仪器,以减少设备参数不同导致的误差。
1.5 统计学处理
采用SPSS 25.0软件进行统计学分析。年龄、SUVr、简易精神状态检查量表(mini-mental state examination,MMSE)评分等计量资料符合正态分布,以均数±标准差表示,组间比较采用方差分析或t检验。采用操作者工作特征(receiver operating characteristic,ROC)曲线评估O/PC SUVr鉴别诊断CAA与AD的效能。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入和排除标准的10例很可能CAA患者(CAA组)、10例AD患者(AD组),以及11例同期行18F-FDG PET/CT检查、认知功能正常的对照人群(对照组)。其中CAA组男性4例、女性6例,平均年龄(69±11)岁,MMSE评分为(25±7)分,以认知功能减退为主要表现者7例、以脑叶出血起病者3例;AD组男性2例、女性8例,平均年龄(69±11)岁,MMSE评分为(21±5)分;对照组男性6例、女性5例,平均年龄(70±10)岁,MMSE评分为(29±1)分。3组年龄、性别无统计学差异(P均>0.05),CAA组、AD组MMSE评分无统计学差异(P>0.05),且均低于对照组(P均<0.05)。
2.2 视觉分析结果
与对照组比较,AD组典型表现为双侧基本对称的颞顶叶代谢减低,以颞叶内侧、后扣带回代谢减低最为显著(图1A~1D)。CAA组皮层代谢减低区呈无特定规律分布,代谢减低或缺损区与出血区域相关(图1E~1H)。
2.3 基于体素的脑代谢图像定量分析
以P<0.01为显著性差异水平。相较对照组,AD组后扣带回、海马旁回、顶叶、颞叶内侧的代谢显著减低;CAA组广泛白质区以及尾状核头、胼胝体、前扣带回、颞叶外侧皮层等处代谢显著减低(图2)。
2.4 O/PC鉴别诊断AD与很可能CAA的效能
CAA组O/PC SUVr明显低于AD组(0.91±0.05比1.07±0.08,P<0.001)。ROC曲线分析显示(图3),O/PC SUVr鉴别很可能CAA、AD的曲线下面积(area under the curve,AUC)为0.98(95% CI:0.93~1.00),最佳临界值为0.96,灵敏度为100%,特异度为90%。

图 1 75岁女性AD患者,进行性记忆力下降4年余,伴精神、行为异常,MMSE评分19分,18F-FDG PET/CT示后扣带回、双侧颞叶内侧代谢对称性减低(A、B,箭头),18F-AV45 PET/CT示大脑皮质Aβ弥漫沉积(C),头颅SWI未发现皮层或皮层下明确微出血灶(D);58岁男性很可能CAA患者,进行性反应力、记忆力下降5年余,双下肢乏力、行走变慢3年余,MMSE评分29分,18F-FDG PET/CT示后扣带回代谢保留、双侧颞叶内侧代谢略低(E、F,箭头),余皮层呈无规律、不均匀、不对称多处代谢减低,18F-AV45 PET/CT示大脑皮质Aβ弥漫沉积(G),头颅SWI示双侧大脑半球皮层及皮层下多发微出血灶(H)
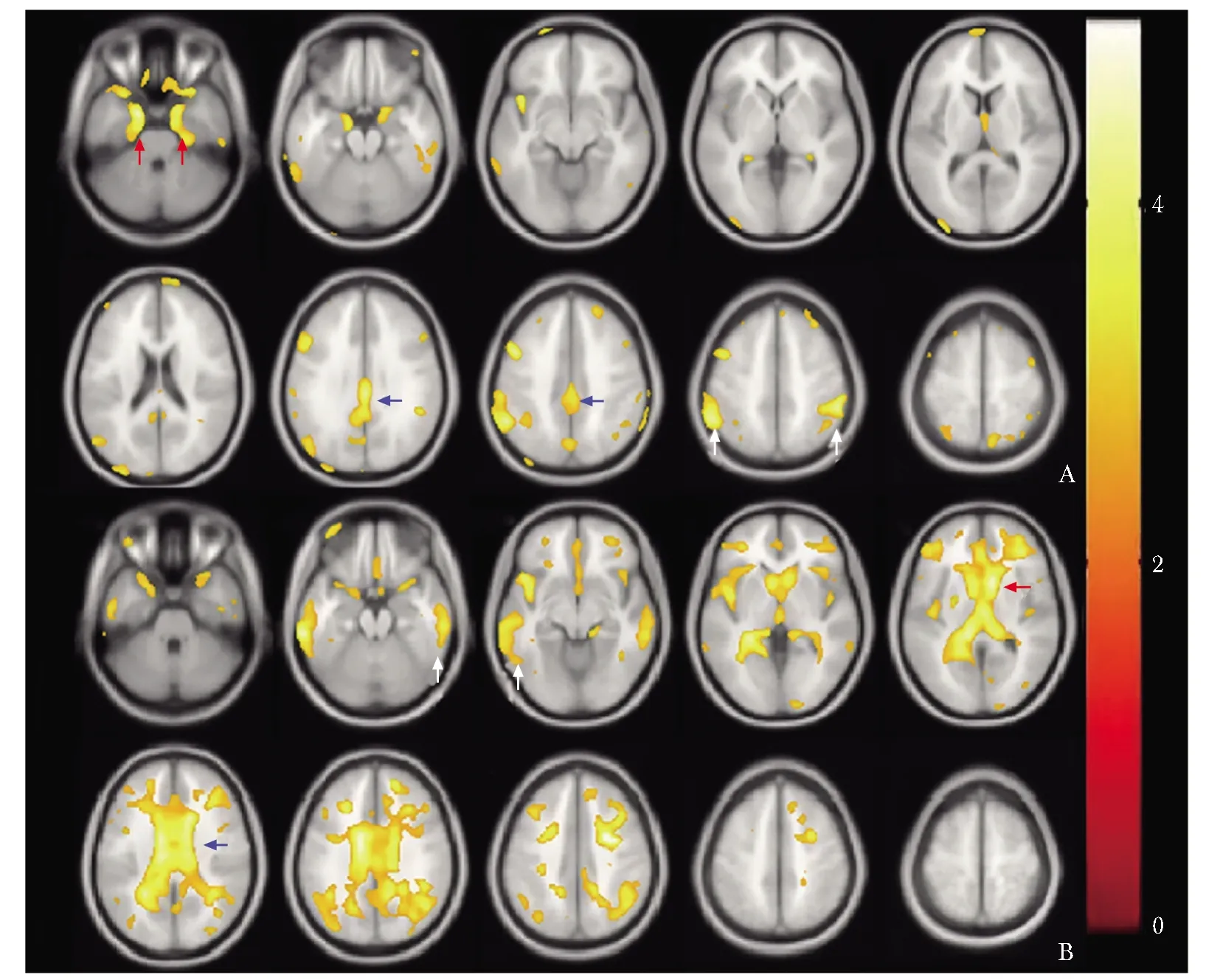
图 2 AD和很可能CAA患者基于体素的脑代谢改变图像

图 3 O/PC SUVr鉴别AD与很可能CAA的ROC曲线图 AD、CAA:同图1; O/PC:枕叶/后扣带回;SUVr:标准摄取值比值; ROC:操作者工作特征
3 讨论
精确诊断是对CAA患者进行精准干预的前提,亦是改善其预后的关键。从发病机制方面看,CAA出现认知功能障碍的原因既涉及血管性机制,也与Aβ异常沉积相关。CAA患者既可表现为血管性认知功能障碍的临床特征,即部分性认知缺失,病情呈阶梯状发展,认知障碍的发展和患者预后取决于血管病变的严重程度;也可呈类似于AD的渐进性隐匿性发展,以致其早期症状与AD难以区分。从病理方面看,CAA与AD均可表现为Aβ异常聚集,AD患者脑脊液中异常的Aβ或TAU蛋白生物标志物亦可在CAA患者中发现[19- 20]。既往研究中,约1/4的AD患者在尸检时发现中重度CAA,约1/2的CAA患者符合AD的诊断标准[19,21- 22]。因此,临床需对以认知功能减退为临床表现的CAA与AD进行精准鉴别[1]。本研究基于18F-FDG PET/CT图像比较了很可能CAA和AD患者的脑代谢特征,发现虽然二者均呈代谢降低模式,但前者呈无规律性改变,以广泛白质区以及尾状核头、胼胝体、前扣带回、颞叶外侧皮层等处代谢显著减低。后者呈双侧基本对称性颞顶叶代谢减低,以后扣带回、海马旁回、顶叶、颞叶内侧的代谢显著减低。对脑区定量分析发现,O/PC SUVr鉴别很可能CAA、AD具有较高的AUC(0.98)、灵敏度(100%)和特异度(90%),有望作为重要的影像学标志物辅助CAA的诊断。
神经影像和图像分析技术的快速发展为AD的研究提供了有力工具,特别是多种Aβ与Tau蛋白正电子示踪剂的应用,为AD的诊断、鉴别诊断、疾病分期以及疗效评定均产生了重大促进作用。常规Aβ PET/CT显像(如11C-PIB、18F-AV45 PET/CT)有助于AD的早期诊断,但在AD与CAA的鉴别中优势不突出。既往多项研究比较了AD与CAA患者常规Aβ PET/CT显像基于像素或脑区的摄取差异,均未提取具有鉴别意义的摄取参数[8-9]。一项2015年开展的Aβ PET/CT显像研究利用早期动态摄取参数代替组织灌注,发现O/PC SUVr可有效鉴别CAA与AD[23]。但Aβ PET/CT显像为非临床常规检查,尤其在基层医院普及度低、可及性差,且动态显像的获取与分析复杂繁琐,临床应用可行性降低。18F-FDG PET显像呈现的脑糖代谢在多数情况下与组织灌注存在平行关系,与18F-AV45 PET/CT相比,18F-FDG PET/CT的应用更加广泛,通过对代谢分布情况的分析可帮助诊断认知功能障碍类型和评估疾病严重程度[24]。目前,基于18F-FDG PET/CT静态脑显像对CAA、AD进行诊断和鉴别诊断已有阳性结果报道[14,16]。
Bergeret等[14]纳入14例以认知功能减退为主要症状且经修订版Boston标准诊断为很可能CAA的患者,将皮层分为13个感兴趣区进行脑区分析并与认知功能正常者进行比较,发现其后部皮层脑区(含上顶叶、后顶叶、初级视觉中心、外侧枕叶、外侧颞叶、楔前叶、后扣带回)代谢显著减低,部分前部皮层代谢亦具有减低趋势,而小脑未见代谢减低[14];后部皮层/前部皮层代谢比值对CAA患者的诊断具有辅助作用。该项研究结果与既往研究认为CAA患者病理结果示后部皮层具有更多的Aβ沉积相符[20,25]。基于上述研究,Bergeret团队进一步探究了CAA与AD患者的18F-FDG PET/CT图像代谢差异[16],得出CAA患者的18F-FDG PET/CT图像O/PC SUVr显著低于AD患者的结论。但上述研究未排除CAA与AD相互重叠的现象。
本研究在尽量排除CAA与AD同时存在的情况下对上述研究结果进行了验证。排除CAA与AD同时存在采取的措施:(1)AD患者的18F-FDG PET/CT代谢特点均具有AD代谢网络特征性,且头颅磁敏感加权成像均未显示脑叶出血或微出血或皮质表面铁沉积,可排除明显合并CAA的患者;(2)多数以认知功能减退为主要表现的CAA患者(5/7)进行了脑脊液AD相关生物标志物检测,结果均为阴性,排除了AD的存在。
本研究视觉分析和基于体素的脑代谢图像分析显示,AD组以颞叶内侧、后扣带回代谢减低最为显著,呈对称性改变。CAA组皮层代谢减低与出血区域相关,代谢降低区主要累及广泛白质区以及尾状核头、胼胝体、前扣带回、颞叶外侧皮层。CAA组代谢减低脑区分布与Bergeret等[16]研究结果不完全一致,主要原因为纳入的患者存在差异,本研究除认知功能减退为主要表现的CAA患者外(n=7),同时入组了少数以脑叶出血起病者(n=3),该类患者的认知障碍更接近于有特定区域相关认知缺失的血管性痴呆,发生出血的脑区表现为较大范围的代谢减低区,与经典皮层/皮层下微出血不同。
与既往研究结果一致,本研究亦发现很可能CAA患者的O/PC SUVr较AD患者显著减低,其对二者进行鉴别诊断的AUC为0.98,灵敏度高达100%,特异度高达90%,提示O/PC SUVr有望成为CAA与AD鉴别诊断的重要影像学参数。
本研究局限性:(1)由于为回顾性研究,存在一定的信息偏倚,如头颅MRI检查扫描仪与磁场强度(1.5T/3T)存在异质性,对微出血的检测效能可能不一致,但CAA与AD组患者中使用3T扫描或1.5T扫描的患者分布结构相似;(2)CAA患者的临床表型存在差异且缺乏病理学资料,一定程度上影响了结果的稳健性;(3)临床特征、治疗信息等资料缺失,可能存在混杂因素。
综上,CAA与AD患者18F-FDG PET/CT脑代谢减低模式具有明显差异,O/PC SUVr 或可作为二者鉴别诊断的敏感指标。在Aβ PET/CT阳性的情况下,如CAA患者具有AD的特征性代谢图型表现,提示二者可能共存。未来需进行大样本前瞻性研究,并对CAA脑出血、认知障碍或CAA相关炎症患者的功能显像特征进行深入研究。
作者贡献:贾琛皓、吴美其负责研究设计、数据分析、论文撰写与修订;郭瑞杰负责影像资料收集;倪俊负责临床资料收集、数据分析;崔瑞雪负责指导研究设计、数据审核及论文审校。
利益冲突:所有作者均声明不存在利益冲突

