基于不同回收方法的肌浆蛋白对鲢鱼糜冻融稳定性的影响
丁娇娇,黄琪琳
华中农业大学食品科学技术学院/国家大宗淡水鱼加工技术研发分中心(武汉),武汉 430070
冷冻作为鱼糜及其制品常见的加工和贮藏手段,能够有效延长鱼糜的保存期限,但是鱼糜在冻藏过程中会发生蛋白质冷冻变性和脂肪氧化等,严重影响其加工特性,导致鱼糜的持水性、凝胶品质、色泽及风味等发生劣变[1-3],近年来学者们研究发现,糖类[4]和磷酸盐类[5]均能作为冷冻保护剂应用于鱼糜中,而蛋白质类水解物作为一种新型的抗冻保护剂已成为近些年的研究热点[6-8]。
在鱼糜工业生产过程中会产生大量富含肌浆蛋白的鱼糜漂洗液,增加了企业处理压力和成本,造成鱼糜加工副产物资源的浪费,不符合企业绿色低碳生产的理念[9-10]。而肌浆蛋白是一种水溶性蛋白,占鱼肌肉蛋白总质量的20%~40%,富含多种人体必需氨基酸,极具利用价值[11]。因此,若能将鱼糜漂洗液中的肌浆蛋白回收并加以利用,既能降低企业废水处理成本,还能增加鱼糜制品的附加值,充分利用鱼糜加工副产物,从而产生极佳的环境效益和经济价值。笔者所在课题组研究发现回收的肌浆蛋白可作为一种鱼糜凝胶增强剂应用于鱼糜生产中,且不同回收方法的肌浆蛋白理化性质存在较大差异,然而目前不同回收方法的肌浆蛋白对冻融鱼糜的蛋白质、脂肪性质和凝胶品质的影响鲜有报道。
本研究通过3 种不同方法(加热法、酸偏移法和酸偏移-耦合壳聚糖絮凝处理)回收鲢鱼糜漂洗液中肌浆蛋白,研究肌浆蛋白对冻融循环过程中鱼糜的蛋白质冷冻变性、脂肪氧化以及凝胶品质的影响,评价其对鲢鱼糜的抗冻性和抗氧化效果,旨在为肌浆蛋白在鱼糜工业生产中的扩大应用提供参考。
1 材料与方法
1.1 材料与试剂
鲢,购于华中农业大学校内农贸市场;鲢鱼糜(AAA级),购于湖北洪湖井力水产食品股份有限公司。
NaCl、HCl、NaOH、Na2HPO4、NaH2PO4、三氯乙酸、乙醇、十二烷基硫酸钠、脲、乙二胺四乙酸、氯化钙、硫酸铜、硫代巴比妥酸、2,4-2 硝基苯肼、2-硝基苯甲酸等,分析纯,购于国药集团化学试剂有限公司;牛血清蛋白购于阿拉丁试剂有限公司;酶活试剂盒购于南京建成生物工程研究所。
1.2 仪器与设备
FJ-200 高速分散均质机,上海标本模型厂;Avanti J-26 XP 高速冷冻离心机,美国贝克曼公司;UltraScan XE 色度仪,美国亨特立公司;TA-XT2i/25质构分析仪,英国Stable Micro System 公司。
1.3 鱼糜理化指标的测定
1)肌浆蛋白的回收。参考周文燕等[12]的方法制备鲢鱼糜漂洗液备用。①取1 L 鱼糜漂洗液,水浴加热(70 ℃,30 min)后置于冰水中静置1 h 后离心(10 000 r/min,4 ℃)15 min,弃去上清液得到加热法肌浆蛋白(heating flocculation sarcoplasmic protein,HSP);②取 1 L 鱼糜漂洗液,用 6 mol/L 盐酸调节pH 值 至 3.0 后 用 6 mol/L NaOH 将 漂 洗 液 pH 调 至7.0,室温静置90 min 后离心(10 000 r/min,4 ℃)15 min,弃去上清液得到酸偏移法肌浆蛋白(pH-shifting flocculation sarcoplasmic protein,PHSP);③取1 L 鱼糜漂洗液,加入3%壳聚糖溶液(质量分数为1%),随后按照酸偏移法调节pH,得到酸偏移-耦合壳聚糖絮凝法肌浆蛋白(pH-shifting/chitosan flocculation sarcoplasmic protein,PHCSP)。
2)鱼糜样品的制备。不添加肌浆蛋白的鱼糜作为空白组,记为Control;加热法肌浆蛋白、酸偏移法肌浆蛋白和酸偏移-耦合壳聚糖絮凝法肌浆蛋白添加量分别为总质量的4%、4%和6%,分别记为HSP组、PHSP 组和PHCSP 组。将鱼糜和肌浆蛋白放入食品调理机内混合斩拌3 min,并调节水分含量至78%,用真空袋分装鱼糜并密封,于-18 ℃冻藏。在冻融循环实验中,制备好的鱼糜样品每48 h 全部取出,在4 ℃冰箱解冻24 h,每次取1组用于测定相关指标,剩余样品继续冻藏,如此冻融循环9次。
3)鱼糜蛋白冷冻变性及氧化指标的测定。盐溶性蛋白含量和总巯基含量的测定参考文献[4]的方法;Ca2+-ATPase 酶活性按照试剂盒使用说明进行测定;表面疏水性的测定参考文献[13]的方法;蛋白质羰基含量的测定参考文献[14]的方法并稍作修改:用2 mL 10 mmol/L 2,4-二硝基苯肼溶液(用0.5 mol/L H3PO4溶解)与2 mL 适当稀释后的蛋白溶液混合,室温下避光反应10 min 后加入1 mL 6 mol/L溶液,继续室温下避光静置10 min。以不含蛋白的磷酸缓冲液作空白,在450 nm 处记录各组的OD 值。摩尔消光系数以22 308 L/(mol·cm)计算;硫代巴比妥酸值(TBARs)的测定参考文献[15]的方法。
4)pH 值的测定。鱼糜与0.1 mol/L 氯化钾溶液按1∶10 的质量比混合,均质后用pH 计进行测量,读数精确至0.05。
1.4 鱼糜凝胶品质的测定
1)鱼糜凝胶的制备。称取150 g 解冻后鱼糜,切成小块后空斩2 min,添加2.0%NaCl 溶液,盐斩1 min,同时用冰水调节最终水分含量为78%,斩拌后的鱼糜灌入直径20 mm 的肠衣后封口。采用两段式加热(先40 ℃水浴1 h,后90 ℃水浴0.5 h),捞出后冷却并于4 ℃冰箱中贮藏,备用。
2)凝胶强度和质构特性的测定参考文献[16]的方法。凝胶色泽的测定参考文献[17]的方法。凝胶持水性的测定参考文献[18]的方法。
1.5 数据统计分析
用Origin 2018、SPSS 22.0 软件处理和分析试验数据,最终结果以“平均值±标准差”的形式呈现,方差分析采用ANOVA,显著性分析采用Duncan’s 检验(α=0.05)。
2 结果与分析
2.1 不同回收方法的肌浆蛋白对冻融过程中鱼糜蛋白冷冻变性及氧化程度的影响
如图1A 所示,4 组冷冻鱼糜样品的盐溶性蛋白含量随着冻融次数的增加均呈现不断下降的趋势。与空白组相比,添加酸偏移法肌浆蛋白和酸偏移-耦合壳聚糖絮凝法肌浆蛋白组的鱼糜在前7 次冻融循环过程中盐溶性蛋白含量下降较慢,具有一定抑制盐溶性蛋白含量下降的效果,但是到了第9次冻融循环后,盐溶性蛋白含量与空白组差异并不显著(P>0.05)。而加热法肌浆蛋白的添加具有明显抑制鱼糜冻融循环中盐溶性蛋白含量下降的效果,在整个冻融循环过程中都显著高于空白组(P<0.05),到了第9次冻融循环之后比空白组的盐溶性蛋白含量要高3.71%。
由图1B 可知,随着冻融次数的增加,总巯基含量呈现先缓慢下降后快速下降的趋势。冻融循环过程中前期巯基氧化速率小于巯基暴露的速度,后期受到冰晶体生长等环境因素的影响,巯基氧化成二硫键速度加快,因此前期的巯基含量上升较慢而后期上升速度加快。经过9 次冻融循环后,空白组、加热法肌浆蛋白组、酸偏移法肌浆蛋白和酸偏移-耦合壳聚糖絮凝法肌浆蛋白组的含量较新鲜鱼糜分别降低了53.47%、43.43%、47.64%和45.07%。添加3 种肌浆蛋白的鱼糜总巯基含量明显高于空白组,具有明显抑制鱼糜蛋白总巯基含量下降的效果,其中加热法肌浆蛋白组抑制下降效果最为明显。
由图1C 可知,Ca2+-ATPase 酶活性随着冻融次数增加呈现出不断下降的趋势,经过前3次冻融循环后Ca2+-ATPase 酶活就明显下降,后6 次冻融循环下降速度开始变缓。经过9次冻融循环之后,与新鲜鱼糜相比,空白组、加热法肌浆蛋白组、酸偏移法肌浆蛋白组和酸偏移-耦合壳聚糖絮凝法肌浆蛋白组的酶活性分别下降95.73%、81.12%、83.99%、87.13%。与酸偏移法肌浆蛋白组和酸偏移-耦合壳聚糖絮凝法肌浆蛋白组相比,加热法肌浆蛋白组抑制Ca2+-ATPase 酶活性下降的效果最为明显,在冻融9 次后仍具有保护肌球蛋白结构的效果。Ca2+-ATPase 酶活性与肌球蛋白球状头部的巯基密切相关,因此,巯基的氧化也会导致Ca2+-ATPase 酶活性的下降,在本研究中Ca2+-ATPase 酶活性和巯基含量也有明显相似的趋势。
由图1D 可知,随着冻融次数的增加,4 组鱼糜表面疏水性都呈现先上升后下降的倒“V”型变化趋势,前7 次冻融循环先逐渐上升,达到峰值后在第9 次冻融循环后开始下降。第7 次冻融后,与新鲜鱼糜相比,空白组、加热法肌浆蛋白组、酸偏移法肌浆蛋白和酸偏移-耦合壳聚糖絮凝法肌浆蛋白组的鱼糜表面疏水性指数分别上升了 11.65、8.46、8.67 和 9.44,相较空白组,添加肌浆蛋白有明显的抑制表面疏水性上升的作用。添加肌浆蛋白组的鱼糜表面疏水性始终低于空白组,其中加热法肌浆蛋白组在第9次冻融循环后鱼糜的表面疏水性仍是最低值。
如图1E 所示,4 组样品的蛋白质羰基含量都呈现不断上升的趋势,说明冻融循环过程中鱼糜蛋白发生了不同程度的蛋白质氧化现象。前3 次冻融循环过程中,各组的蛋白质羰基含量上升趋势较为缓慢,第5 次冻融循环之后,空白组鱼糜的蛋白质羰基含量上升速度明显加快,到了第9 次冻融循环,空白组的蛋白质羰基含量最高,而添加加热法肌浆蛋白、酸偏移法肌浆蛋白和酸偏移-耦合壳聚糖絮凝法肌浆蛋白组的鱼糜蛋白羰基含量均明显较低。说明肌浆蛋白的添加能够显著抑制鱼糜冻融循环过程中蛋白质的氧化修饰现象(P<0.05)。
如图1F 所示,到第9 次冻融循环后,空白组、加热法肌浆蛋白、酸偏移法肌浆蛋白、酸偏移-耦合壳聚糖絮凝法肌浆蛋白组的TBARs 值分别为1.19、1.17、1.08、0.96 mg/kg。与空白组相比,添加肌浆蛋白组的TBARs 值并没有显著差异,说明添加肌浆蛋白不会促进鱼糜冻融过程中的脂肪氧化。

图1 冻融循环期间鱼糜盐溶性蛋白含量(A)、总巯基含量(B)、Ca2+-ATPase酶活性(C)、表面疏水性(D)、蛋白质羰基含量(E)和TBARs值(F)的变化Fig.1 Changes of salt soluble protein content(A),total sulfhydryl content(B),Ca2+-ATPase activity(C),surface hydrophobicity(D),protein carbonyl content(E)and TBARs value(F)in surimi during freeze-thaw cycles
因此,添加3种肌浆蛋白均能抑制冻融过程中鱼糜盐溶性蛋白含量、总巯基含量和Ca2+-ATPase 酶活性的下降,以及表面疏水性和蛋白质羰基含量的上升,说明肌浆蛋白能够抑制冻融鱼糜蛋白质冷冻变性和蛋白氧化现象,其中加热法回收的肌浆蛋白的抑制效果最优。但是添加肌浆蛋白并不会促进冻融鱼糜的脂肪氧化现象。
2.2 不同回收方法的肌浆蛋白对鱼糜冻融过程中pH值的影响
由图2可知,随着冻融循环次数的增加,鱼糜pH值呈现先下降后上升的“V”型变化趋势,第3次冻融循环时4组鱼糜的pH值下降到最低点,分别为6.45、6.47、6.46和6.43,第9次冻融循环后4组pH值又分别上升到6.95、6.93、6.92和6.92,4组鱼糜pH值之间并没有显著差异(P>0.05),说明肌浆蛋白对鱼糜pH值并没有不良影响,添加肌浆蛋白并不会降低鱼糜的新鲜度。
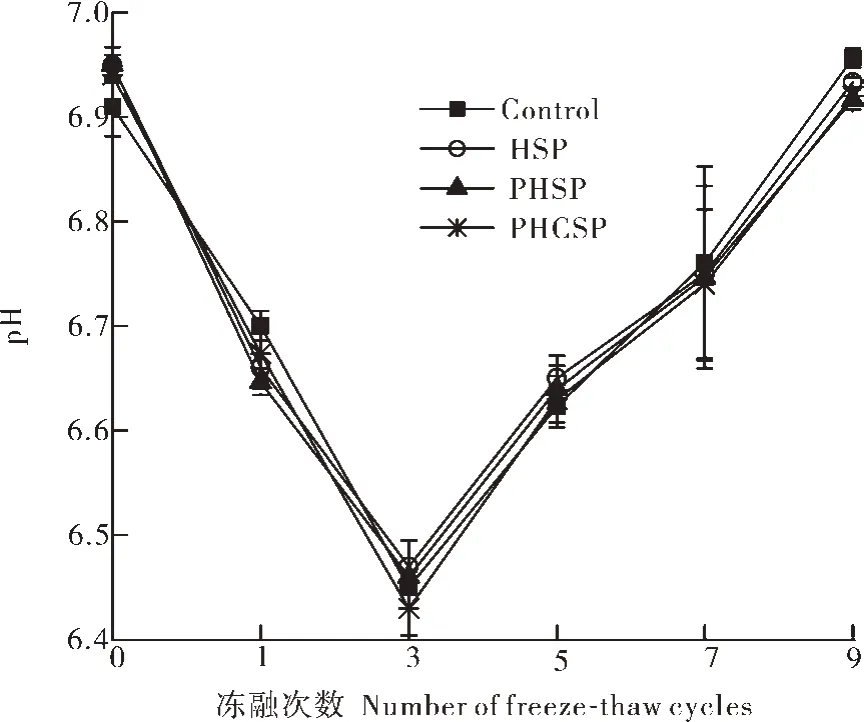
图2 冻融循环期间鱼糜pH值的变化Fig.2 Changes of pH value in surimi during freeze-thaw cycles
2.3 不同回收方法的肌浆蛋白对鱼糜冻融过程中凝胶强度的影响
如图3所示,鱼糜凝胶强度随着冻融次数的增加呈现不断下降的趋势,空白组、加热法肌浆蛋白组、酸偏移法肌浆蛋白组、酸偏移-耦合壳聚糖絮凝法肌浆蛋白组在第9次冻融循环后鱼糜的凝胶强度分别降低到251、410、456和508 g·cm。与空白组相比,添加肌浆蛋白能够显著抑制鱼糜冻融循环过程中鱼糜凝胶强度的下降(P<0.05)。这可能是因为回收的肌浆蛋白含有一定浓度的游离氨基酸,带负电荷的氨基酸与蛋白质结合,抑制了蛋白质分子间的聚集,起到了冷冻保护的作用。值得注意的是添加酸偏移-耦合壳聚糖絮凝法肌浆蛋白组的抑制凝胶劣化效果最佳,这可能是因为通过壳聚糖絮凝的肌浆蛋白中含有壳聚糖,而壳聚糖与鱼糜蛋白相互作用改善了鱼糜凝胶强度。

图3 冻融循环期间鱼糜凝胶强度的变化Fig.3 Changes of gel strength of surimi during freeze-thaw cycles
2.4 不同回收方法的肌浆蛋白对鱼糜冻融过程中凝胶质构特性的影响
由表1 可知,随着冻融循环次数增加,鱼糜凝胶的硬度和咀嚼性呈现不断下降的趋势,与新鲜鱼糜相比,第9 次冻融循环后空白组、加热法肌浆蛋白组、酸偏移法肌浆蛋白组和酸偏移-耦合壳聚糖絮凝法肌浆蛋白组的硬度值依次为1 781.63、1 952.68、1 908.84 和 1 976.16 g;咀嚼性分别为 1 360.73、1 552.74、1 497.57和1 588.76 g。与空白组相比,添加肌浆蛋白能够显著抑制冻融后鱼糜凝胶硬度值和咀嚼性的下降(P<0.05);9 次冻融循环中,添加肌浆蛋白的鱼糜凝胶的硬度值和咀嚼性始终显著高于空白组,并且在3 种肌浆蛋白中,酸偏移-耦合壳聚糖絮凝法肌浆蛋白抑制下降效果最为显著。4 组鱼糜凝胶的弹性和回复性呈现先下降后上升的变化趋势,但是其数值在整体上没有显著的变化(P>0.05),与空白组相比,添加肌浆蛋白组的鱼糜凝胶的弹性和回复性在数值上的变化也不显著(P>0.05)。随着冻融次数的增加,4 组鱼糜凝胶的内聚性均呈现下降的趋势,这说明反复冻融循环会影响鱼糜凝胶网络结构的形成,而添加肌浆蛋白组的鱼糜凝胶质构特性在整个冻融循环过程中始终优于空白组鱼糜的质构特性,这与本文“2.4”节的结果一致。

表1 不同冻融次数下鱼糜凝胶质构特性的变化Table 1 Changes of textural properties of surimi during freeze-thaw cycles
2.5 不同回收方法的肌浆蛋白对鱼糜冻融过程中凝胶持水性的影响
如图4 所示,随着冻融次数的增加,鱼糜凝胶持水性呈现不断下降的趋势,第9 次冻融循环后空白组、加热法肌浆蛋白组、酸偏移法肌浆蛋白组和酸偏移-耦合壳聚糖絮凝组的持水性分别为69.51%、74.97%、74.41%和75.02%。冻融循环后鱼糜形成的凝胶网络结构会变得疏松,因此,凝胶的持水性也随之下降。而与空白组相比,添加肌浆蛋白组的鱼糜凝胶持水性始终优于空白组,说明添加肌浆蛋白能增强鱼糜凝胶截留水分的能力。添加酸偏移-耦合壳聚糖絮凝组的鱼糜凝胶在第9 次冻融循环后持水性仍有75.02%,这可能是因为酸偏移-壳聚糖絮凝肌浆蛋白中有壳聚糖,壳聚糖亲水基团赋予鱼糜凝胶更优的保水能力。

图4 冻融循环期间鱼糜凝胶持水性的变化Fig.4 Changes of water holding capacity of surimi during freeze-thaw cycles
2.6 不同回收方法的肌浆蛋白对鱼糜冻融过程中凝胶色泽的影响
由表2 可知,随着冻融次数的增加,a*值呈现不断下降的趋势,而b*值呈现不断上升的趋势,而W*和L*值呈现先下降后上升的趋势,这说明冻融循环使得鱼糜凝胶色泽变红、变黄并且亮度下降,这是由肌浆蛋白本身的颜色以及冻融循环过程蛋白质变性和脂肪氧化导致的。但是到了第9次冻融循环,亮度值和白度值有所上升,这是因为多次冻融循环后鱼糜汁液流失严重,鱼糜表面变得潮湿,对光线折射能力增加了。而添加不同回收方法肌浆蛋白均能够一定程度上提升鱼糜凝胶的白度值和亮度值。

表2 不同冻融次数下鱼糜凝胶色泽的变化Table 2 Changes of color of surimi during freeze-thaw cycles
3 讨 论
3.1 不同回收方法的肌浆蛋白对鱼糜理化指标的影响
蛋白质发生冷冻变性主要是因为随着冷冻-解冻次数的增加,鱼糜内部小冰晶体逐渐聚集形成大冰晶体[2],一方面,肌原纤维蛋白受到大冰晶体挤压带来的机械损伤,与水分相互作用的能力下降;另一方面,冰晶升华水分流失,溶质浓缩,导致鱼糜中肌原纤维蛋白变性聚集[6]。脂肪氧化则是因为冰晶体体积增大导致原本细胞膜被破坏,内部的促氧化剂如血红素蛋白被释放出来,并且解冻后冰晶体融化造成较大孔隙的出现,增加与空气中氧化的接触面积从而进一步加速了脂肪的氧化[19]。
添加不同回收方法的肌浆蛋白均能抑制鱼糜冻融循环过程中盐溶性蛋白含量、Ca2+-ATPase 酶活性、总巯基含量的下降和表面疏水性的上升,这种作用效果因回收方法的不同而存在不同程度的差异。肌浆蛋白抑制蛋白冷冻变性源自其游离的多肽和亲水性的氨基酸基团,一方面,亲水性氨基酸能与水分结合,抑制冻结过程中大冰晶体的形成,稳定肌原纤维蛋白的构象[20];另一方面肌浆蛋白能够与肌原纤维蛋白结合或者是包裹在肌原纤维蛋白外部[7],减少肌原纤维蛋白的聚集变性。其中加热法回收的肌浆蛋白由于其溶解性最好抑制效果最为显著。据文献[20]报道不同回收方法的肌浆蛋白的理化性质存在差异,加热法回收的肌浆蛋白溶解度更高,亲水性氨基酸比例大,所以能更充分与水分子相互结合,减少巨大冰晶体的形成,避免肌原纤维蛋白受到机械损伤,而酸偏移法回收的肌浆蛋白和酸偏移-耦合壳聚糖絮凝回收的肌浆蛋白,其溶解性比加热法回收的肌浆蛋白要差[10],蛋白水解物比例小,因此抑制蛋白变性效果不如加热法肌浆蛋白明显。周文娟等[21]研究了鲢副产物蛋白水解物对经过6 次冻融循环的鱼糜的低温保护作用,发现蛋白水解物的分子质量分布、总氨基酸和游离氨基酸组成的差异是其对冻融鱼糜有不同低温保护效果的主要原因。
肌浆蛋白的添加还能抑制鱼糜冻融循环过程中蛋白质的氧化修饰现象。有研究表明,冻融循环过程中的蛋白质变性和脂肪氧化现象会促使蛋白的氨基酸残基转化为羰基[22]。肌浆蛋白通过加热回收或酸碱处理回收后,会产生小分子的多肽和氨基酸,氨基酸中的吲哚基、酚基等官能团,能作为质子供体终止自由基链式反应,进而抑制由脂肪氧化引起的蛋白质羰基化[23]。李向红等[6]也研究发现蛋白酶解物能够抑制氨基酸侧链自由基的氧化,降低蛋白羰基含量。与空白组鱼糜相比,添加不同回收方法的肌浆蛋白的鱼糜,其TBARs 和pH 值并没有显著的变化,说明肌浆蛋白的添加并不会促进鱼糜的脂肪氧化降解。
3.2 不同回收方法的肌浆蛋白对鱼糜凝胶品质的影响
鱼糜凝胶品质随着冻融周期延长表现出劣化的现象,这主要是因为肌原纤维蛋白在多次冻融后发生了蛋白变性和聚集,用于形成凝胶网络结构的盐溶性蛋白数量和质量下降,因此形成三维蛋白凝胶结构不如冻融之前致密。此外,凝胶劣化现象也受水分和脂质等因素的综合影响。
对冻融鱼糜凝胶品质保护效果最好的是酸偏移-耦合壳聚糖絮凝法肌浆蛋白,导致这一现象的原因可能是回收的肌浆蛋白中有许多小分子亲水基团,如天冬氨酸、谷氨酸能够与自由水结合,稳定肌肉蛋白结构[18,22]。而添加酸偏移-耦合壳聚糖絮凝法肌浆蛋白的鱼糜样品持水性在经过多次冻融循环后仍显著高于空白组主要是因为同肌浆蛋白一起絮凝的还有壳聚糖,壳聚糖能够通过氢键与鱼糜蛋白结合[24],进而改善鱼糜凝胶特性,提高持水性。添加肌浆蛋白组的鱼糜在前5 次冻融循环过程中能够抑制鱼糜凝胶色泽的变暗,这可能是因为添加肌浆蛋白的鱼糜凝胶与空白组相比有更好的持水性,而具有较高持水性的鱼糜凝胶外观会更白[19]。说明添加不同回收方法的肌浆蛋白能够一定程度上提升鱼糜凝胶的白度值。
总之,肌浆蛋白的添加能够抑制鱼糜冻融循环中蛋白质的冷冻变性和凝胶品质劣变现象,将肌浆蛋白应用于鱼糜制品中有利于增强鲢鱼糜抗冻性,稳定其凝胶品质,有利于充分利用鱼糜加工副产物。

