油菜细胞质雄性不育基因orf138、orf288的功能分析
魏强燕,葛晓宇,赵伦,文静,易斌,涂金星,傅廷栋,沈金雄
华中农业大学作物遗传改良国家重点实验室/国家油菜工程技术研究中心,武汉 430070
油菜是我国栽培面积最大的油料作物,是第一大自产食用植物油来源。利用杂种优势提高油菜产量和抗性等,对油菜生产发展和我国食用油供应安全有着重要意义[1]。细胞质雄性不育(CMS)是杂种优势利用的重要途径,油菜中已经发现和创制了10多个CMS 类型[2],但对于不育基因作用机制的认识还很有限。目前关于CMS 的分子机制主要有毒蛋白、能量缺陷和异常的PCD 假说等3 种主流的假说[3]。多数 CMS 类型存在能量缺乏和 PCD 异常的现象[4-8],部分不育基因编码的蛋白被证实具有毒性,但进一步的研究发现部分蛋白如水稻WA CMS 的WA352[9]和油菜hauCMS 的 ORF288[10],其毒性与雄性不育无关。因此,毒蛋白假说的合理性还需要在更多的CMS类型中进行验证。
油菜中的oguCMS 胞质来源于日本萝卜[11],是目前世界上研究和应用较为广泛的一种胞质不育类型。其不育相关基因orf138[12]编码的 ORF138 是毒蛋白,通常以寡聚体形式存在[13],可能通过在线粒体内膜上形成大的复合物来发挥作用[14]。核恢复基因Rfo编码的线粒体蛋白通过阻止ORF138 蛋白翻译的延伸过程,从而恢复油菜的育性[15]。hauCMS 胞质是傅廷栋教授发现的芥菜型油菜胞质不育材料,后被转入甘蓝型油菜[16]。其雄性不育性彻底稳定,适用于杂交育种。hau胞质不育基因orf288编码的ORF288 同样是毒蛋白[17],但其毒性区域位于含有3个跨膜螺旋的N 端,截去N 端后,剩余的C 端无毒性的ORF215仍可以引起植物雄性不育[18]。
orf138和orf288均是较长的线粒体基因,其中可能存在一些功能域,其关键的作用区域是基因的全长还是其中的一段不得而知。本研究进行不同截短片段的原核表达和拟南芥、油菜遗传转化,确定油菜oguCMS 不育基因orf138编码蛋白的毒性与雄性不育的关系以及hauCMS 不育基因orf288的核心功能区域,旨在为解析植物细胞质雄性不育基因的作用机制及植物细胞质雄性不育分子设计育种提供参考。
1 材料与方法
1.1 材 料
本研究所用的载体包括pMD18-T、pET-32a、pCAMBIA2300,其中 pMD18-T 为 TA 克隆载体,用于外源片段的整合及测序;pET-32a 为原核表达载体,用于目标片段的原核表达;pCAMBIA2300 作为表达载体用于插入目标片段进行拟南芥和油菜遗传转化。研究中所用的菌株包括大肠杆菌宿主菌DH5α、BL21(DE3)pLysS,农杆菌菌株GV3101。植物材料包括哥伦比亚型拟南芥(Col,Columbia)、甘蓝型油菜hau胞质不育系6-102A、ogu胞质不育系浙油50A、oguCMS 的保持系浙油50B 以及polCMS的恢复系丙409。
1.2 载体构建
根据 TMHMM 网站(http://www.cbs.dtu.dk/services/TMHMM/)预测的ORF138的跨膜区域,以浙油50A 的gDNA 为模板,扩增orf138不同长度的截短片段,选择BamHⅠ和Hind Ⅲ酶切位点,将截短片段连接到原核表达载体pET-32a 上;分别以浙油50A 和 6-102A 的 gDNA 为 模 板 ,扩 增orf138和orf288不同长度的截短片段,并通过重叠延伸PCR在截短片段前加上线粒体信号肽(polCMS恢复基因Rfp的前159 bp),内切酶BamHⅠ和PstⅠ酶切PCR回收产物,并将其连接到含有双35S启动子的超表达载体pS2300 上。连接产物转化大肠杆菌DH5α 挑取单克隆测序,序列正确的单克隆质粒于-20 ℃保存,质粒命名为 pET32a1-138、pET32a1-93、pET32a45-138和 PS∶Rfp13835-138、PS∶Rfp13845-138、PS∶Rfp288104-288、PS∶Rfp288134-288、PS∶Rfp288164-288、PS∶Rfp288194-288。
1.3 原核表达
将构建好的原核表达载体连同对照空载质粒转化大肠杆菌表达菌株BL21(DE3)pLysS,涂皿,挑取单克隆,摇菌,PCR 检测阳性的单克隆菌液加灭菌甘油于-80 ℃保存备用。按1∶1 000 的比例取100 μL菌液加入到100 mL 含终质量浓度50 μg/mL 氨苄青霉素和 30 μg/mL 氯霉素的液体 LB 培养基中,37 ℃摇床(200 r/min)培养至OD 值达到0.6 时,将菌液分成2 等份,向其中1份加入终浓度为0.5 mmol/L 的IPTG 诱导目的蛋白表达,另1份不加IPTG;之后每隔30 min 用UV1601 紫外分光光度计检测1 次菌液OD值。
1.4 SDS-PAGE凝胶电泳
将经IPTG 诱导10 h 的菌液离心,弃上清,用PBS 缓冲液重悬菌体,再用超声破碎仪(ZQST-150,上海争巧科学有限公司)进行破碎,离心,向上清和沉淀(沉淀用PBS 缓冲液重悬)中分别加入5×SDSPAGE Loading Buffer(CWBIO,货 号 :01411/50426),98 ℃孵育10 min 进行蛋白变性。样品处理好后取10 μL 上样进行SDS-PAGE 凝胶电泳。本研究采用12%分离胶和5%浓缩胶。电泳完成后,对凝胶进行染色、脱色,观察蛋白条带。
1.5 拟南芥的遗传转化
利用农杆菌蘸花法进行拟南芥的遗传转化。将转化的农杆菌进行培养,采用浸花法侵染野生型拟南芥植株。将所收种子干燥春化后消毒播于含50 μg/mL卡那霉素的1/2 MS 培养基上,置于光照培养室中培养10 d 左右,选取生长正常的植株移栽于温室培养。
1.6 油菜的遗传转化
采用农杆菌介导的方法进行油菜的遗传转化,具体操作参考高长斌[19]的方法。
1.7 阳性苗鉴定
用 CTAB(hexadecyl trimethyl ammonium bromide,十六烷基三甲基溴化铵)法提取转基因油菜和拟南芥幼苗叶片基因组DNA。以提取的DNA 为模板,1 条载体上的引物、1 条基因内部的引物进行PCR 鉴定(引物序列见表 1)。PCR 体系包含 1 μL模板、3 μL ddH2O、引物各 0.5 μL、5 μL PCR Mix(擎科)。PCR 程序为 95 ℃ 5 min;95 ℃ 30 s;55 ℃30 s;72 ℃ 1 min,共34个循环;72 ℃ 5 min。使用1%琼脂糖凝胶电泳检测PCR产物。

表1 本研究所用的引物序列Table 1 Primers used in this study
1.8 RNA提取
采用Eastep® Super 总RNA 提取试剂盒(普洛麦格(北京)生物技术有限公司,货号:0000465711)提取拟南芥花蕾总RNA。
1.9 反转录及定量PCR
采用PerfectStart Uni RT&qPCR Kit(北京全式金生物技术有限公司,货号:#P30618)进行反转录,反转录产物稀释50倍作为模板,然后设计特异引物,在Bio-Rad CFX96 仪器上进行目的基因的qPCR(quantitative real-time PCR)反应,以Actin基因作为内参。qPCR 具体操作步骤参考钱佳丽[20]的方法。使用2-ΔΔCt方法[21]计算基因的相对表达量。
2 结果与分析
2.1 ORF138的毒性区域
1)蛋白毒性检测。在 TMHMM 网站(http://www.cbs.dtu.dk/services/TMHMM/)对 油 菜oguCMS 的不育基因orf138编码的ORF138 进行跨膜螺旋预测,发现其22~44 aa 处存在1 个跨膜螺旋(图1)。根据跨膜螺旋的位置对orf138进行不同长度的截短,构建3 个原核表达载体:pET32a1-138(全长)、pET32a1-93(截去C 端部分序列但保留跨膜螺旋)和pET32a45-138(不含有跨膜螺旋),利用BL21(DE3)pLysS 菌株进行原核表达。通过测定菌液OD值发现,未加入IPTG 诱导蛋白表达时,所有转入不同长度截短的orf138的大肠杆菌的生长趋势与空载对照基本相同,但加入IPTG 后,转入包含跨膜螺旋的pET32a1-138和pET32a1-93的大肠杆菌的生长受到了明显的抑制,而转入去掉跨膜螺旋的pET32a45-138的大肠杆菌的生长基本不受影响(图2)。表明ORF138的毒性区域位于包含跨膜螺旋的N 端,而非C端。
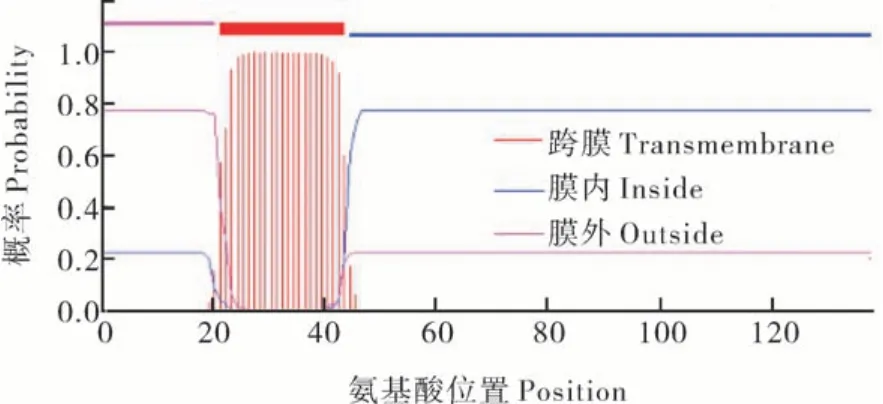
图1 ORF138跨膜螺旋预测Fig.1 Prediction of transmembrane helix in ORF138
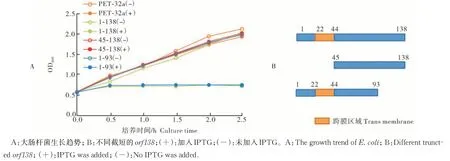
图2 表达不同截短orf138的大肠杆菌的生长趋势Fig.2 Growth trend of E.coli expressing different truncted orf138
2)蛋白表达验证。为验证大肠杆菌生长的抑制是由诱导表达的目的蛋白所引起的,利用SDSPAGE 凝胶电泳检测蛋白的表达(图3)。空载pET-32a 经 IPTG 诱导后,表达 TrxA、S-tag 和 2 个 His-tag的标签蛋白,大小约20.4 ku,用ExPASy ProtParam tool(http://web.expasy.org/protparam/)计算不同截短长度蛋白的分子质量,pET32a1-138、pET32a1-93和pET32a45-138分别表达大小约 36.4、31.4 和 31.2 ku 的融合蛋白。上清中检测到的蛋白是可溶性蛋白,而沉淀中检测到的是包涵体形式的蛋白。PAGE 胶经染色、脱色,能观察到加入IPTG 后,无毒性的pET-32a和pET32a45-138被大量诱导表达,且它们既有可溶性表达,也有包涵体形式的表达;而无论是上清还是沉淀,凝胶上都没有观察到明显的pET32a1-138和pET32a1-93对应大小的蛋白条带,可能是因为它们具有毒性,大肠杆菌体内存在某种机制抑制其表达,以致表达量过低,不足以形成肉眼可见的蛋白条带。

图3 不同截短ORF138的蛋白表达情况Fig.3 Protein expression of different truncated ORF138
2.2 不同长度截短orf138的转基因验证
ORF138 的第35 个氨基酸处存在1 个起始密码子(ATG),结合毒性检测结果,本研究以polCMS恢复基因Rfp的前159 bp 作为线粒体信号肽构建2 个截短载体 PS∶Rfp13835-138和 PS∶Rfp13845-138,转化拟南芥和甘蓝型油菜浙油50B。转基因阳性苗中并未出现不育表型,用亚历山大染色液和醋酸洋红染液分别对拟南芥和油菜的花粉进行染色,花粉粒均被染成深红色,表明花粉具有活力。因此,ORF138 包含跨膜螺旋的毒性区域是其引起植物雄性不育所必需的。
2.3 不同长度截短orf288的转基因验证
本研究构建了4个不同长度截短orf288的超表达载 体 :PS∶ Rfp288104-288、PS∶ Rfp288134-288、PS∶Rfp288164-288和PS∶Rfp288194-288,将它们分别通过农杆菌介导的方法转化拟南芥。其中转PS∶Rfp288104-288、PS∶Rfp288134-288和 PS∶Rfp288164-288的阳性植株中出现雄性不育表型,转PS∶Rfp288194-288的阳性植株全部可育(表2)。
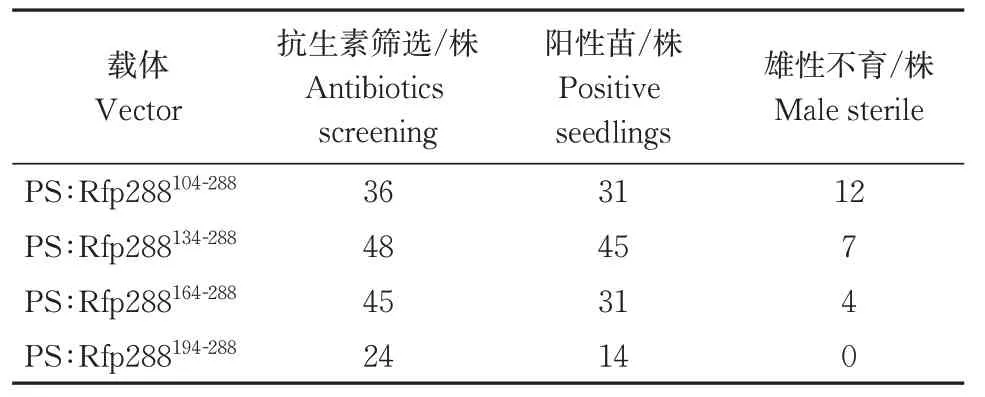
表2 不同截短orf288转基因拟南芥阳性苗的育性鉴定Table 2 Fertility identification of transgenic Arabidopsis thaliana of different truncated orf288
1)转基因拟南芥植株表型。与野生型拟南芥(WT)相比,转基因拟南芥不能产生角果,彻底不育,其他部位生长发育状况与WT无明显差异(图4)。
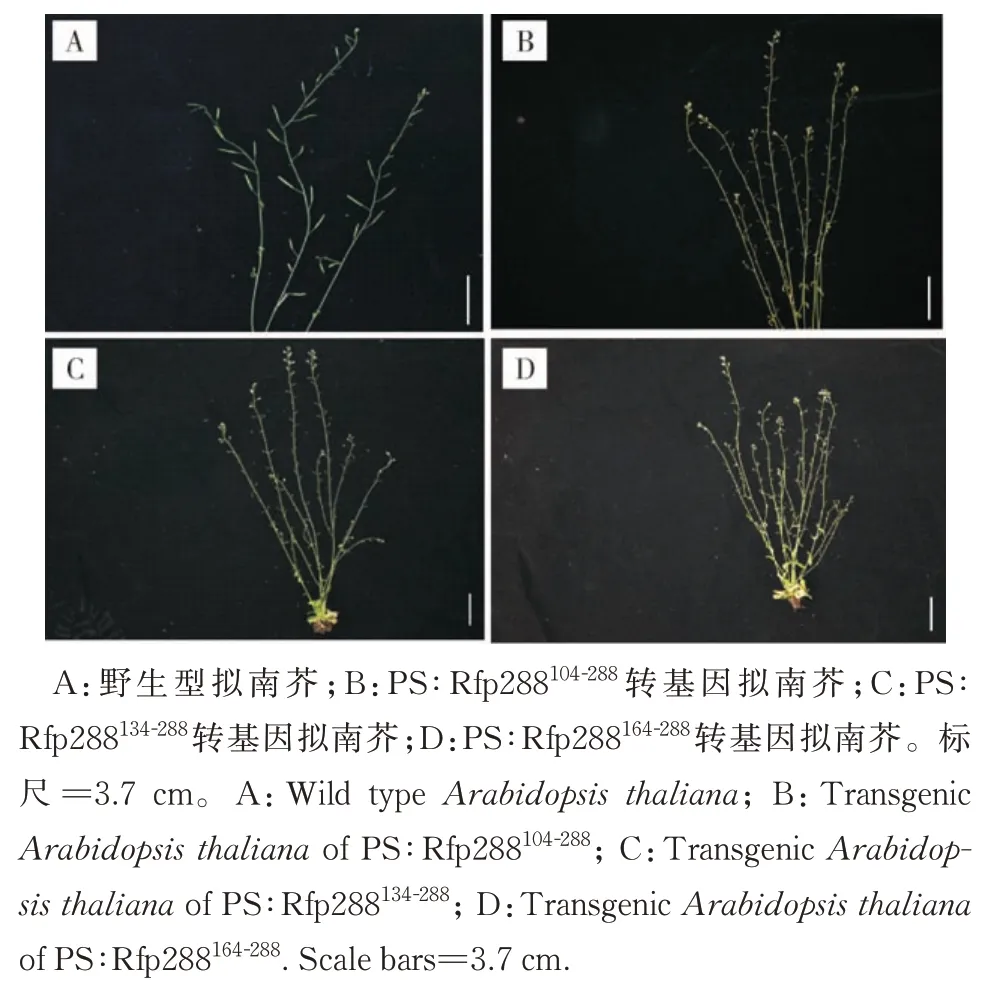
图4 不同截短orf288转基因拟南芥Fig.4 Transgenic Arabidopsis thaliana of different truncted orf288
2)转基因拟南芥花药形态观察。与WT 相比,PS:Rfp288104-288的雌蕊发育正常,但雄蕊的花丝明显缩短,在物理距离上限制了花粉传到柱头上,且花药不开裂,花粉粒无法散出,不能完成授粉;PS:Rfp288134-288的雌蕊发育正常,但原本应该发育成由花药和花丝组成的雄蕊变成了上宽下窄的片状结构,且上面稍膨大的类似于花药的地方没有开裂,无法正常授粉,最终导致雄性不育(图5)。
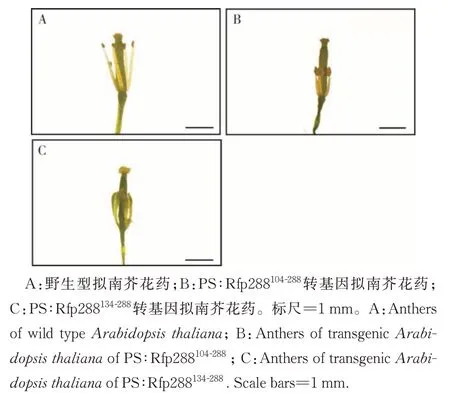
图5 不同截短orf288转基因拟南芥花药Fig.5 Anthers of transgenic Arabidopsis thaliana of different truncated orf288
3)转基因拟南芥花粉活力检测。本研究使用染色法对拟南芥的花粉活力进行检测。在载玻片上用亚历山大染色液对花粉进行染色,发现虽然转基因拟南芥的花药中含有大量清晰可见的花粉粒,但除WT 的花粉粒能被染成紫红色外,PS:Rfp288104-288、PS:Rfp288134-288和PS:Rfp288164-288的花粉粒未被染成红色(图6)。表明3种转基因拟南芥中无法产生有活力的花粉,最终导致败育。
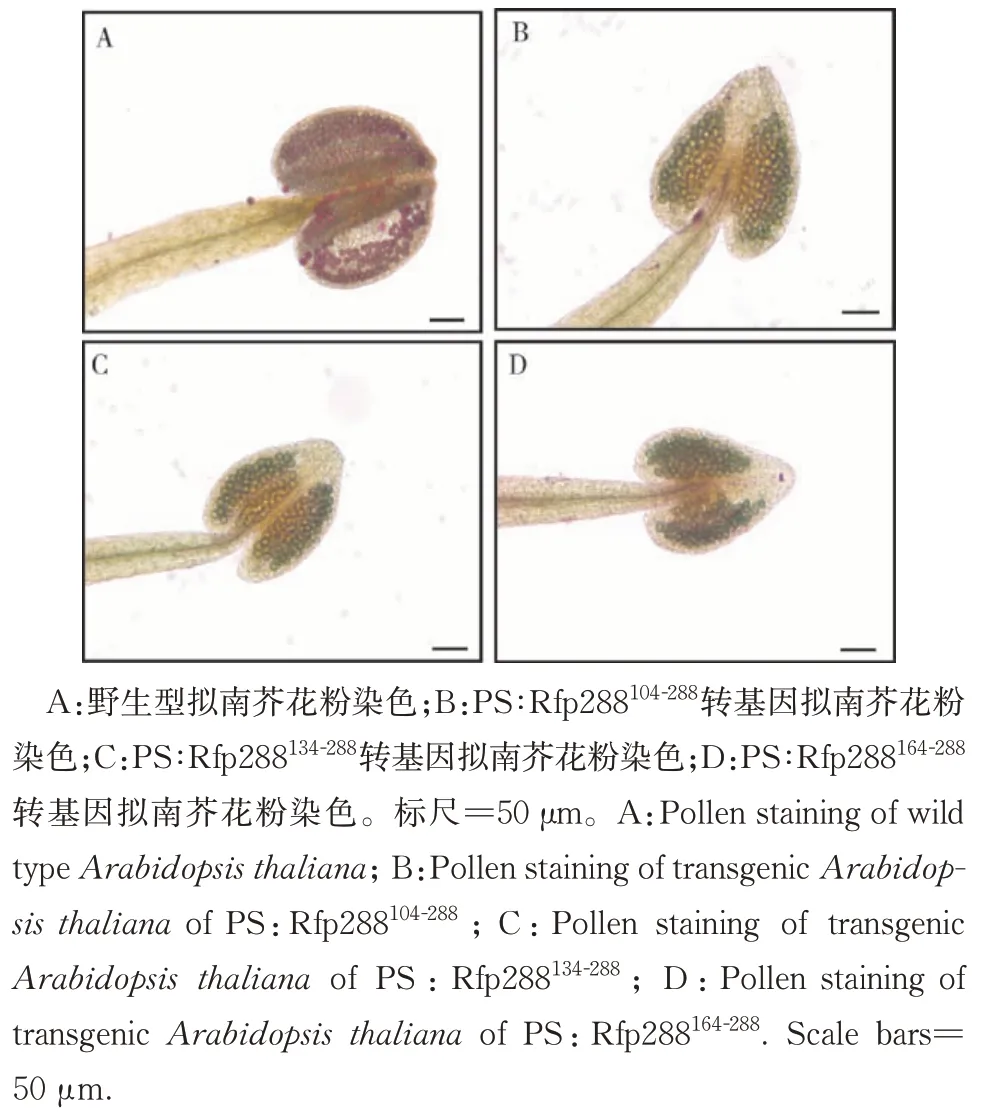
图6 不同截短orf288转基因拟南芥花粉染色Fig.6 Pollen staining of transgenic Arabidopsis thaliana of different truncated orf288
4)Rfp288104-288基因表达量验证。为验证雄性不育是由目的基因的表达所引起的,取PS:Rfp288104-288不育和可育拟南芥的花蕾进行基因表达量检测。不育株中Rfp288104-288的表达量显著高于可育株(图7),结果表明,Rfp288104-288在植株体内的表达可以引起雄性不育。
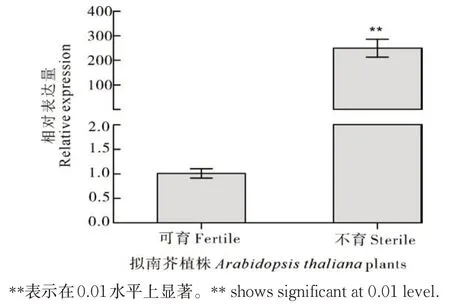
图7 可育和不育拟南芥中Rfp288104-288的相对表达量分析Fig.7 Relative expression analysis of Rfp288104-288 in fertile and sterile Arabidopsis thaliana plants
3 讨 论
3.1 ORF138的蛋白毒性与雄性不育的关系
越来越多的不育基因被证明编码一种可以抑制大肠杆菌生长的毒蛋白,如玉米T-CMS 的URF13[22]、向日葵Pet1CMS 的 ORF522[23]、水稻BtCMS 的 ORF79、HLCMS 的 ORFH79、WA CMS 的WA352[24]、Tetep-CMS 的 ORF312[25]、油 菜polCMS 的 ORF224[26]、hauCMS 的 ORF288[27]、NsaCMS的ORF346[28]等。而线粒体是由与真核生物共生的原核生物进化而来[24]。因此,研究者猜测不育基因编码的毒蛋白是以类似毒害大肠杆菌的方式对花药中的线粒体产生影响,进而引起植物雄性不育,即细胞质雄性不育分子机制的毒蛋白假说。但Luo等[9]和 Heng 等[18]的研究表明,WA352 和 ORF288去掉蛋白毒性部分后,余下的无毒部分仍可以引起转基因植株雄性不育,与毒蛋白假说相悖。本研究通过全长和截短ORF138蛋白的原核表达,确定了其毒性区域是位于包含跨膜螺旋的N 端。由于蛋白的跨膜螺旋通常是由疏水氨基酸组成[29],因此,本研究与 Duroc 等[13]通过氨基酸的亲疏水性对 ORF138 进行截短研究出的非毒性区域大致相同。与WA352和ORF288 不同,去掉ORF138 的N 端毒性部分后,余下的部分不能引起植物雄性不育,这与带有Rft恢复基因可育植株中orf138转录本5'端缺失相符[29]。本研究更直接地证明了N 端毒性部分是ORF138 导致雄性不育所必需的。ORF138 的N 端具有跨膜螺旋,以寡聚体形式存在,形成大复合物,在线粒体内膜上起着一个孔的作用[14]。有研究表明,玉米TCMS 的URF13 的寡聚体可以在线粒体膜上形成亲水孔,使内膜的透性受到影响,进而使膜两侧不能形成稳定的质子梯度,ATP合成速率降低,最终导致雄性不育[31]。亲水孔的形成依赖跨膜螺旋的存在,ORF138 的跨膜螺旋可能是导致不育的重要原因。本研究结果表明N 端包含跨膜结构的毒性部分是ORF138引起雄性不育所必需的,因为这一区域具有毒性和跨膜结构特点,并不能简单地认为ORF138支持毒蛋白假说。另外,在大肠杆菌中观察到的蛋白毒性是否就是由跨膜螺旋造成尚没有明确的阐述。因此,ORF138是否支持毒蛋白假说以及跨膜螺旋结构与蛋白毒性之间的关系仍有待进一步的研究。
3.2 orf288的核心功能区域
我们前期的工作证明orf288是油菜hauCMS 胞质的不育相关基因,且去掉N 端毒性部分的ORF215仍可以使转基因植株发生雄性不育[10],但ORF215仍是较长的一段序列,是否由其整个序列引起雄性不育值得进一步研究。本研究通过不同长度截短载体的遗传转化试验,初步证明orf288引起植物雄性不育的核心功能区域是orf288164-288,且164-194 aa 可能是引起不育的一个关键作用区域。Luo 等[9]的截短实验表明水稻WA352 中与COX11 互作的2 个部分均可单独引起转基因植株雄性不育。Tang 等[32]的研究表明WA352的序列中包含 sc1、sc2 和 sc3 三个部分,其中sc1 负责与COX11 互作,互作部分的氨基酸突变会影响互作的程度,sc2 和sc3 对这种互作起到一个开关的作用,从线粒体基因进化的角度说明了sc1 序列的保留与功能保守的关系。Omukai等[33]利 用 mitoTALENs 技 术 对 水 稻 RT102-type CMS 的不育基因orf352进行编辑,发现 ORF352 的179-210 aa 可能对雄性不育起关键作用。而Kasahara 等[34]则探讨了蛋白序列中更倾向于与其他蛋白发生互作的片段特性。这些研究都证明不育基因核心功能区段的存在。由于胞质不育相关基因大多是由基因组重组形成的嵌合基因,而一些不育基因的某些嵌合部分来源是相同的,导致它们之间存在一定的 同 源 性 。hauCMS 的orf288和tourCMS 的orf263[35]以及polCMS 的orf224、shan 2ACMS 的orf224[36]高度同源。因此,植物中 CMS 的败育方式和不育分子机制间的差异可能是由其不育基因的核心功能区域所具有的功能差异导致。不育基因核心功能区段的确定可为利用CRISPR/Cas9 和TALEN等技术进行基因编辑、创建亲和可育材料提供指导,有利于更高效地利用杂种优势。未来随着数据库日渐完善,对核心功能区段进行保守结构域预测分析,将可以为研究其引起雄性不育的分子机制提供思路。

