太子参块根形成的比较转录组分析
匡云波, 王宗华, Abah Felix,叶祖云, 鲍坚东
(1.宁德师范学院生命科学学院福建省特色药用植物工程技术研究中心,福建 宁德 352100;2.福建农林大学生命科学学院植物与微生物相互作用福建省高校重点实验室,福建 福州 350002;3.闽江学院地理与海洋学院海洋研究院,福建 福州 350108;4.福建农林大学植物保护学院,福建 福州 350002)
太子参(Pseudostellariaheterophylla)为石竹科多年生草本植物,以块根入药,具有益气健脾、生津润肺的功效[1],是中国闻名道地药材,是福建柘荣、贵州施秉等地脱贫致富的重要经济作物.现代医学研究表明,太子参的药用成分主要是多糖类、皂苷类、氨基酸类、环肽类、挥发油类等,广泛用于止咳[2]、改善心肺功能[3,4]、治疗糖尿病[5,6]、抗疲劳[7]、抗氧化[8,9]等.太子参栽培长期以块根进行无性繁殖,病毒病尤为严重,田间感染率达100%,严重影响到太子参的产量和品质.然而对于太子参病毒病至今尚无有效的防治措施.目前较有效的途径是利用组织培养技术建立脱毒种苗生产体系,但以脱毒苗作为种苗存在移栽成活率低、不耐储存和长距离运输等缺点.利用试管中诱导的脱毒微块根作为繁殖体可以解决这方面的难题.太子参试管微块根的形成过程、外部形态和内部结构与栽培块根基本一致,且离体太子参微块根的生长发育和营养物质的积累与块根相同[10].太子参组培苗虽较易形成微块根,但形成微块根的系数较低,平均每株仅形成1.54个微块根,仅少部分可形成2~3个[11],此特性严重阻碍了脱毒微块根的进一步推广应用.因此,探明太子参块根形成的分子生物学调控途径,促进不定根向块根转化,有望解决这一难题.
太子参块根的繁殖特性与药用植物地黄、粮食作物甘薯、木薯等类似,均起源于不定根,而马铃薯块茎、洋葱球茎、荷花根状茎均起源于地下茎.这类植物贮藏器官的形成大致可分为3个阶段:诱导阶段(刺激不定根向块根转变)、启动阶段(不定根停止伸长生长,开始径向生长)和形成阶段(块根开始膨大至发育成熟)[13].但块根的诱导和启动紧密相连,很难通过试验方法区别.因此,通常将两者合并进行讨论[14].不同块根、块茎作物的贮藏器官由相似的环境因子和内源因子诱导形成,如激素变化、光周期、高糖等[15,16].然而,不同的贮藏器官可能需要不同水平的特异因子,如光照强度、光照时间、激素种类及其浓度等.太子参试管微块根在结构和生理学上均与栽培块根相似,维管形成层从不定根的原生木质部分化而来,随后形成层不断分裂致使不定根开始快速膨大[10,17].因此,不定根中形成层细胞的出现是块根开始形成的信号,是块根形成的关键时期[13,15],决定了不定根能否最终发育成块根.植物贮藏器官的形成是一个复杂的生物学过程,涉及到碳水化合物体内分配、信号转导、能量生产和利用、细胞进程、细胞防御及胁迫反应等多种相互交叉的生理代谢过程,受到环境因子、生化因子和全基因组层面复杂的基因网络调控[12,13].对块根形成过程中基因表达差异的研究是揭示块根启动及生长调控机制的重要途径.目前,关于甘薯块根的形成调控机制已取得了一定的研究进展[12,15,18],对木薯[19]和药用植物地黄[13,20]等多种块根植物的研究表明,激素和光照是块根(块茎)形成的主要调控因子[12-14,16,21].此外,马铃薯作为研究变态器官发育的模式植物,在块茎形成调控研究上已经取得了较大的进展,也为块根的形成调控研究提供了依据[22,23].
至今为止,有关太子参块根形成调控方面的研究报道较少[11,24].因此,本试验在解剖学观察的基础上,将块根发育分为不定根时期(初生生长阶段的不定根)、块根形成初期(基部开始膨大,次生生长初期,维管形成层刚形成,但不明显)、块根迅速膨大期(维管形成层很明显)和块根成熟期(维管形成层细胞停止分裂,微块根体积不再增大);采用高通量测序技术对不同发育时期的太子参的根进行转录组测序,建立块根形成相关的转录组数据库,并利用比较转录组学和生物信息学分析方法,挖掘与块根形成相关的关键基因,以初步了解激素调节太子参块根形成的分子机制,可望突破太子参脱毒微块根的高效繁殖生产瓶颈,也为田间太子参的高产优质栽培提供依据.
1 材料与方法
1.1 材料
供试材料为田间生长健壮的太子参“柘参1号”植株,2018年取自福建西岸生物科技有限公司位于柘荣县英山乡的太子参良种繁育基地.基于解剖学观察,分别收集不定根形成期(adventitious root, ARs)、块根形成初期(initiated tuberous roots, ITRs)、块根迅速膨大期(medium tuberous roots, MTRs)和块根成熟期(later tuberous roots, LTRs)的根,每个时期的样品收集3个生物学重复用于后续研究.液氮速冻后储藏于-80 ℃冰箱,用于总RNA的提取.
1.2 RNA的提取及检测
按照说明书,采用Trizol试剂(Invitrogen)分别提取不同发育时期的太子参块根总RNA.采用1%琼脂糖凝胶电泳检测RNA质量,使用Agilent 2100 Bioanalyzer (Agilent RNA 6000 Nano Kit)检测总RNA的浓度、RIN值、28S/18S和片段长度.样本纯度使用紫外分光光度计Nano DropTM进行检测.
1.3 RNA转录组测序
提取样品总RNA后,用带有Oligo(dT)的磁珠富集真核生物mRNA,使其片断化,以打断后的mRNA为模板合成一链cDNA,配制二链合成反应体系合成二链cDNA,使用试剂盒纯化回收、粘性末端修复、cDNA的3′末端加上碱基“A”并连接接头,然后进行片段长度选择,最后进行PCR扩增;构建好的文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System质检,检测合格后进行测序.每个样品测3个生物学重复.转录组测序数据登录国家基因组科学数据中心(CNCB-NGDC),登录号为CRA005321(https://bigd.big.ac.cn/gsa/browse/CRA005321).
1.4 基因序列的组装
利用fastaQC(https://www.bioinformatics.babraham.ac.uk/projects/fastqc/)将得到的原始测序数据(raw reads)进行质控,除去接头、污染、低质量及含有未知碱基(N)的序列数据,获得的质控数据(clean reads)通过Trinity(https://github.com/trinityrnaseq/trinityrnaseq)软件进行de novo组装,最后利用Tgicl软件将所有得到的转录本进行聚类去冗余,得到Unigenes.
1.5 基因功能注释
Unigene的功能采用eggNOGmapperV2(http://eggnog-mapper.embl.de/)基于同源基因簇数据库eggNOG(http://eggnog5.embl.de)进行注释,具体包括GO(gene ontology)和KEGG(kyoto encyclopedia of genes and genomes).
1.6 基因表达水平
使用Bowtie2(http://bowtie-bio.sourceforge.net/index.shtml)软件将质控数据比对到Unigene,然后使用RSEM(https://github.com/deweylab/RSEM)软件进行基因表达量的分析.采用R包DEseq2(http://bioconductor.org/packages/release/bioc/html/DESeq2.html)进行差异表达基因的分析.设定两组平均表达值的差异倍数(fold change)≥2且假阳性率(false discovery rate, FDR)≤0.05为差异表达基因.
1.7 差异表达基因的GO及KEGG富集分析
利用TBtools(https://github.com/CJ-Chen/TBtools)软件,对差异表达基因进行GO富集分析(FDR≤0.01),包括分子功能、细胞成分、生物过程.利用KOBAS3.0(http://kobas.cbi.pku.edu.cn/)软件对差异表达基因进行KEGG途径显著性富集分析(FDR≤0.01),从而确定差异表达基因参与的代谢途径和信号转导途径.
2 结果与分析
2.1 太子参块根不同发育时期块根的转录组测序
使用Illumina HiSeq4000平台对12个样品进行了测序,单个样品测序量为6~7 Gb,共获得了79.92 Gb 数据.每个样品数据单独de novo组装,获得Unigenes 5.3×104~6.5×104条,去冗余后共得到131 785个Unigenes.Unigenes平均长度约1 kb,N50约为1.5 kb,GC含量约40%(表1).
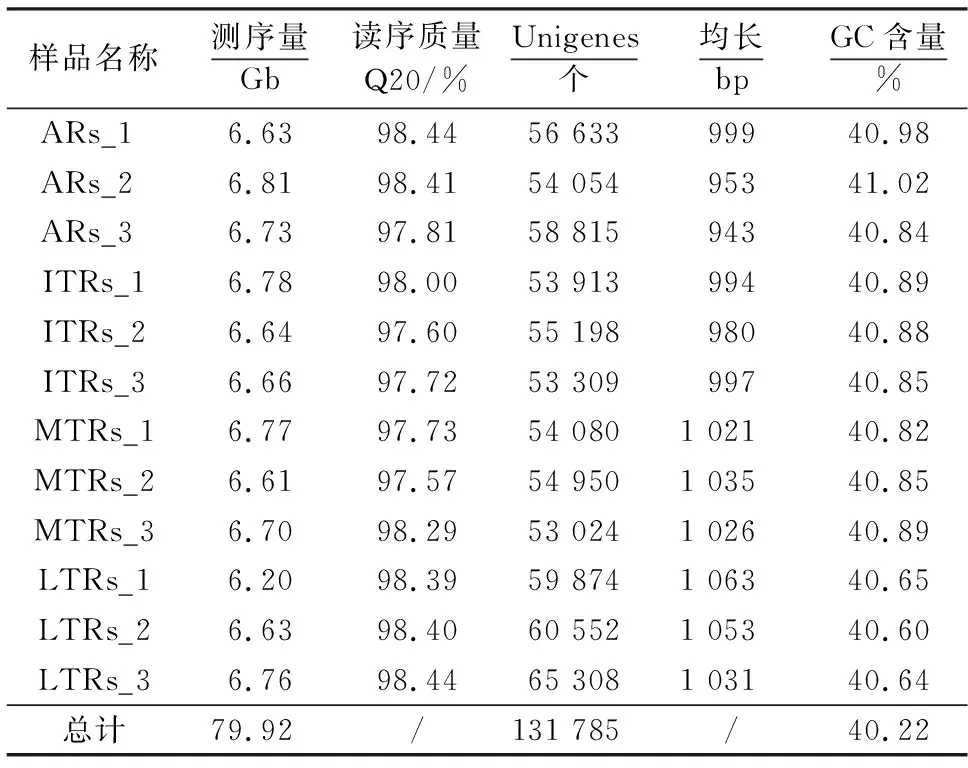
表1 太子参转录组测序数据概况1)Table 1 Summary of RNA-seq data of P.heterophylla
2.2 差异表达基因的筛选
对太子参块根形成过程差异表达基因的研究可揭示块根形成过程中潜在的关键调控因子,本研究以ARs为对照,从3个比较组ARs_VS_ITRs、ARs_VS__MTRs、ARs_VS_LTRs中分别获得5 132、5 506、22 709个差异表达基因.为进一步挖掘块根形成过程中的关键调控因子,在ARs_VS_ITRs中筛选特异上调或下调差异表达基因(图1).总共有1 215个基因在ARs_VS_ITRs比较组中特异性差异表达,其中858个基因特异性差异上调表达,357个基因特异性差异下调表达,这些基因可能在块根形成过程中起着关键的调控作用.

下划线标记为上调差异表达基因数量(个);无下划线标记为下调差异表达基因数量(个).图1 太子参块根不同发育时期上调与下调的差异表达基因Fig.1 Venn diagram of differentially up-regulated and down-regulated genes at different developmental stages
2.3 差异表达基因的功能富集分析
2.3.1 差异表达基因的GO分类及富集分析 比较组ARs_VS_ITRs中差异表达基因的GO富集分析结果表明(图2):在生物学过程中,最显著的是细胞排毒(P=1.21×10-6),其次是化学物质响应(P=5.06×10-5)和NADP代谢过程(P=3.56×10-4);在细胞组分中,富集最显著的是胞外区(P=4.35×10-11),其次是外部封装结构(P=7.10×10-6)和基质(P=8.11×10-4);在分子功能方面,富集最显著的是氧化还原酶活性(P=0.00),其次是跨膜转运蛋白活性(P=2.87×10-3)和裂解酶活性(P=4.82×10-3).可能与太子参块根形成密切相关的有化学物质响应、外部封装结构、刺激检测、发育成熟.

图2 比较组ARs_VS_ITRs中差异表达基因的GO富集分析Fig.2 GO enrichment analysis of differentially expressed genes in ARs_VS_ITRs
2.3.2 差异表达基因的KEGG途径富集分析 为了进一步分析比较组ARs_VS_ITRs差异表达基因参与的生物途径,采用KEGG数据库进行其富集分析.5 132个差异表达基因涉及129个代谢通路,富集度最高的前3个通路依次是油菜素类固醇生物合成、光合作用—天线蛋白玉米素(zeatin, ZT)生物合成.其中涉及到激素的途径包括油菜素类固醇生物合成、ZT生物合成、植物激素信号转导途径,说明这些通路可能是太子参块根形成过程中的重要代谢(图3).
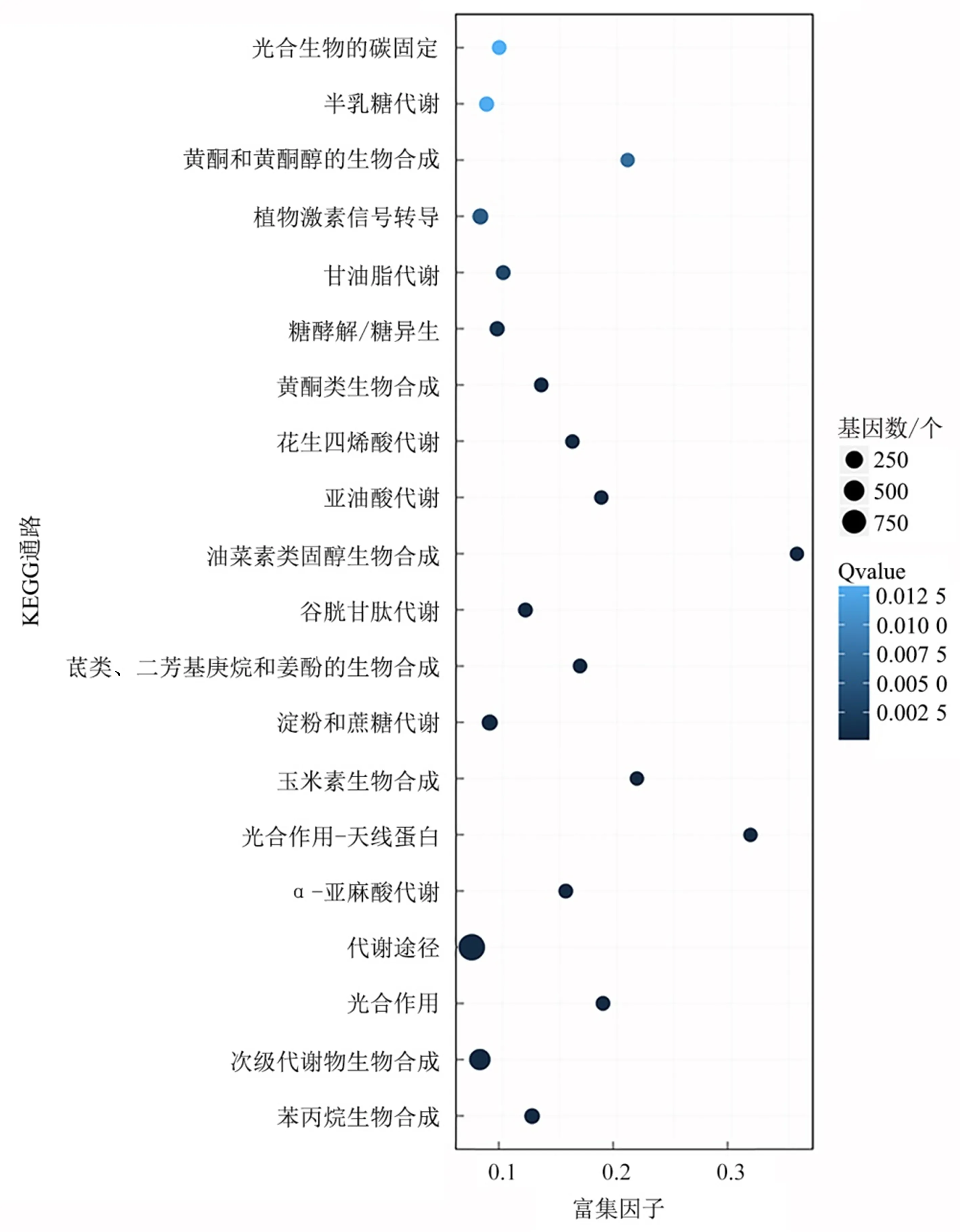
图3 比较组ARs_VS_ITRs中差异表达基因的KEGG富集分析Fig.3 Pathway enrichment analysis of differentially expressed genes in ARs_VS_ITRs
2.4 激素信号转导及合成途径相关基因分析
根据对比较组ARs_VS_ITRs差异表达基因的KEGG途径富集分析结果,结合对此比较组中特异性上调或下调表达基因的筛选,发现仅ZT生物合成、植物激素信号转导途径相关基因在太子参块根形成初期特异性差异表达.其中与ZT生物合成途径相关的基因1个,即玉米素O-葡萄糖基转移酶基因(cis-zeatin o-glucosyltransferase,cisZOG),特异性上调表达;与植物激素信号转导途径相关的基因26个,涉及到生长素、细胞分裂素(cytokinin, CTK)、赤霉素(gibberellin, GA)、乙烯(ethylene, ET)和茉莉酸(jasmonic acid, JA)等信号通路,其中特异性上调表达的基因9个,包括生长素响应因子(auxin response factor 1,ARF1;ARF2)、双成分反应调节因子ARR-A家族(two-component response regulator ARR-A1,ARR-A1;ARR-A2)、DELLA蛋白基因、GA不敏感矮秆基因(gibberellin insensitive dwarf1,GID1)、组成型三重蛋白基因(constitutive triple response 1,CTR1)及茉莉酮酸酯ZIM结构域蛋白(jasmonate ZIM domain-containing protein,JAZ1;JAZ2).下调表达的基因17个,包含了ARF3、ARF4、ARF5和生长素极性运输载体LAX1(like auxin resistant 1,LAX1)等(表2).这些基因可能对太子参块根形成起着重要的诱导作用.
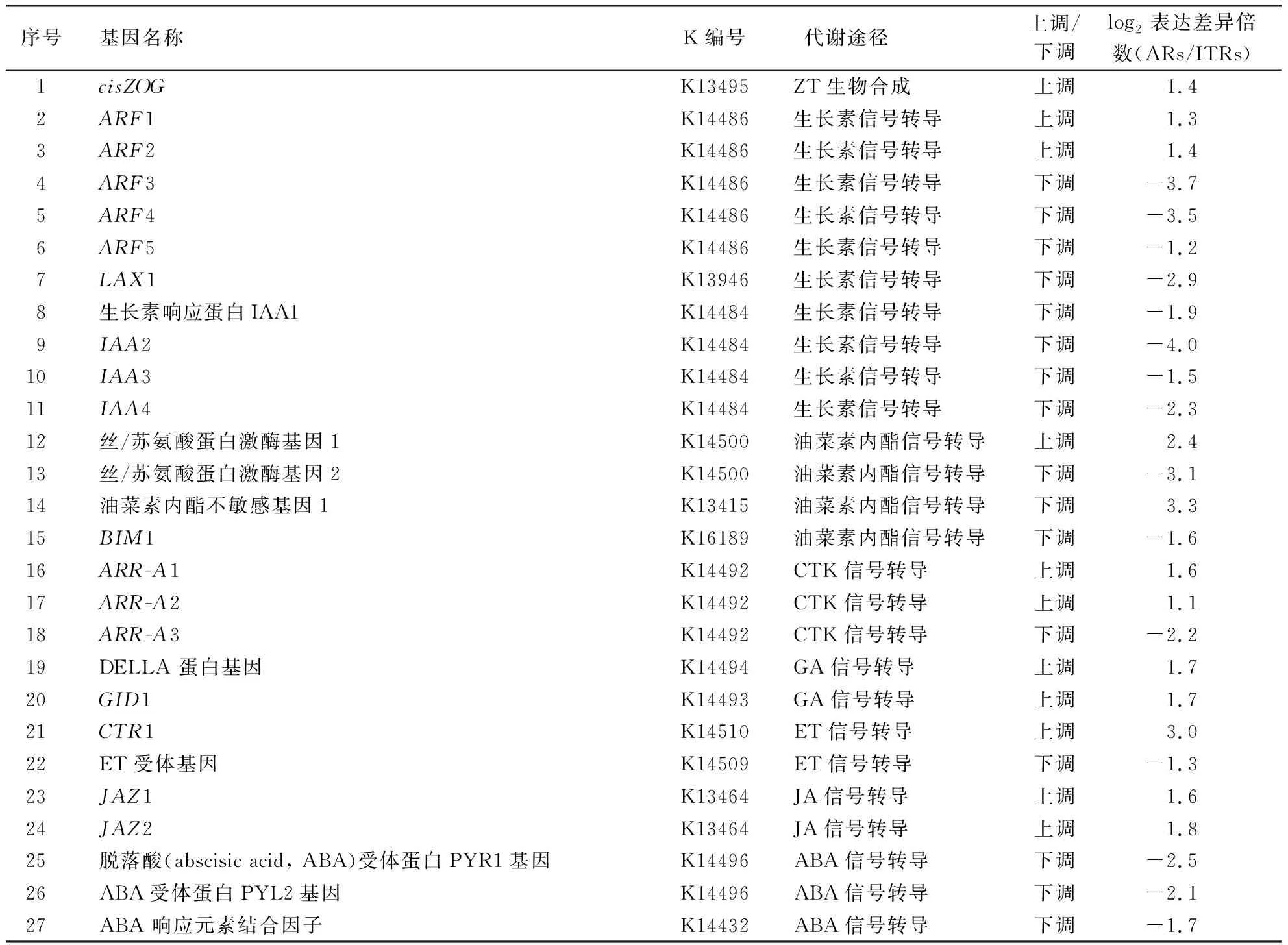
表2 块根形成过程中激素信号转导及合成途径相关基因Table 2 Key genes differentially expressed in hormone signal transduction and synthesis pathways during tuberous root formation
3 讨论
太子参药材收获部位是块根,其形成速度、大小、数量、成分等与药材的质量和产量密切相关.然而长期以来,病毒病导致太子参种质退化、产量和品质下降,严重影响了太子参的种植效益,因而病毒病的防治成为生产上迫切需要解决的问题.采用优质脱毒微块根成为太子参产业可持续发展的关键.明确太子参块根形成的分子调控机制,有利于实现其脱毒微块根的规模化、工厂化和产业化,同时对提高栽培太子参的产量和品质具有重要意义.本试验通过对不同发育时期太子参块根进行转录组测序和生物信息学分析,筛选出与太子参块根形成相关的候选基因,但在后续研究中仍需对这些候选基因进行克隆及qPCR验证,并进一步深入探索其分子调控机制.
在太子参块根形成初期,ZT合成代谢和植物激素信号转导通路差异基因显著富集,推断激素在太子参块根诱导形成过程中起着重要的调控作用.植物块根、块茎等储藏器官的形成和发育是多种内源激素协同调控的结果[25-28].在马铃薯中,吲哚乙酸(indole-3-acetic acid, IAA)、CTK、ABA和JA对块茎的形成有促进作用,而GA则抑制块茎的形成[27],ABA被认为是GA的拮抗剂[29].在甘薯中,生长素在块根形成早期含量高,但IAA的含量随着次生加厚生长而逐渐降低[30].反玉米素核苷(trans-zeatinriboside, t-ZR)作为CTK前体,其含量在块根形成初期快速增加,比须根高6~7倍[31].另外,外源CTK的应用被证明可促进块根形成[32].因此,CTK可能在其块根形成初期起关键作用.
与太子参块根形成启动相关的27个差异表达基因中有10个IAA响应相关基因,包括5个ARF基因(ARF1、ARF2、ARF3、ARF4、ARF5)、1个生长素基因(LAX1)、4个生长素响应蛋白基因(IAA1、IAA2、IAA3、IAA4).其中,ARF1和ARF2基因特异性上调表达,暗示IAA参与调控太子参块根形成.在地黄中,miR167a、miR160参与调控不定根向块根的转化.而miR167a靶向2个生长素ARF基因,miR160靶向3个ARF基因.在马铃薯中,ARF基因是块茎形成和休眠解除的关键调控因子[33].IAA信号途径相关基因的表达在植物储藏器官形成中起重要作用,与块根形成初期的初生增粗生长有关[13,34-36].IAA可以使形成层细胞维持分生组织状态,促进细胞分裂,使木质部增加[37].
在太子参块根形成初期,ZT合成代谢相关基因cisZOG特异性上调表达,暗示ZT可能参与调控太子参块根形成.ZT是一种天然的CTK.CTK可能与块根形成初期初生增粗过程中旺盛的细胞分裂相关.CTK为原形成层发育过程中细胞增殖和细胞特化所必需[38,39],并且为维管形成层发育所必需,主要功能是调节细胞增殖[40].CTK的活性集中在木薯块根次生木质部和韧皮部之间形成层区域,具有调节形成层活性的作用[41],与甘薯块根中维管形成层的活化相关[42].此外,在太子参块根形成初期,ARR-A3下调表达.有研究表明[43],ARR-A家族基因为CTK响应的负调控因子[43].ARR-A3的下调表达有可能促进太子参的块根形成.

