圆齿野鸦椿Biflorin和Isobiflorin的抗氧化性及其对H2O2氧化损伤肝细胞的保护作用
王金熠, 唐彩婷, 郭梦云, 苏超茹, 梁婷婷, 黄 维,2
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建高校自然生物资源保护利用工程技术研发中心,福建 福州 350007)
氧化应激是指外来刺激打破机体氧化还原平衡,引发大量自由基产生,从而引起基因表达异常和蛋白分泌失调等,被认为是导致衰老和疾病的重要因素[1].肝脏通过氧化还原反应对体内物质进行生物转化,氧化应激极易引起肝脏损伤[2-4].临床研究发现,抗氧化剂能导致机体氧化还原失衡,因此常用于肝病的辅助治疗.圆齿野鸦椿(EuscaphiskonishiiHayata)是福建省民间的传统药用植物,其果实具清热降毒、抗炎镇痛的功效,其提取物对肝组织具较好的抗损伤、抗癌等作用[5-7].本课题组前期在圆齿野鸦椿果皮成分活性的研究中发现色原酮化合物Biflorin和Isobiflorin[8].研究表明Biflorin和Isobiflorin具有较强的抗炎活性[9],但抗氧化活性尚未见报道.本研究利用体外自由基消除试验和对被氧化剂H2O2破坏的肝细胞模型,评价Biflorin和Isobiflorin的抗氧化效果,及其对H2O2氧化后损害的肝细胞的防护效果,并探究其可能的影响机理,为圆齿野鸦椿药用资源的开发与利用提供依据.
1 材料与方法
1.1 药品与试剂
Biflorin和Isobiflorin由课题组制备[10].圆齿野鸦椿成熟果实于2019年10月采自福建省邵武市天成岩.晒干的果皮粉碎后依次用食用酒精提取,用乙酸乙酯萃取,再分别用硅胶及凝胶柱层析分离纯化.经ESI-MS和NMR检测,并与文献[11-12]比对,结果一致,确认为Biflorin和Isobiflorin,质量分数分别为98.5%和98.7%.
青霉素—链霉素双抗、DMEM高糖培养基、过硫酸钾(K2S2O8)、水杨酸、胎牛血清(FBS)、抗坏血酸(Vitamin C, Vc)、细胞活性氧试验反应试剂盒、核蛋白提取实验反应试剂盒、胰酶溶液、pH7.4 PBS溶液、三羟基甲基氨基甲烷(Tris)等购于索莱宝股份公司;2,2′- 联氨-双-[3-乙基苯并噻唑啉-6-磺酸]-二氨盐(ABTS)、1,1 -二苯基-2-三硝基苯肼(DPPH)和四甲基偶氮唑盐(MTT)购自默克Sigma-Aldrich公司;TransZol Up Plus RNA试剂盒、TransScriptⅡone-step gDNA Removal and cDNA Synthesis超混液和TransStart Green qPCR超混液购自全式金公司; Nrf2、HO-1和NQO-1购于Abcam公司,内参β-actin、Cytochrome c oxidase subunit 4(COX-4)和二抗购于Santa Cruz公司;盐酸、DMSO及其余试剂均为分析纯.
1.2 仪器
qRT-PCR测定仪(LightCycler 96)由瑞士Roche公司提供;全波段功能酶标仪(Varioskan)由美国Thermo Scientific公司提供;pH计(PB-20)由德国Mettler Toledo公司提供;NANODROP 2000由美国Thermo Scientific公司提供;荧光化学发光成像系统(BOX F3)由美国SYNGENE公司提供;倒置显微镜(1X51)由日本Olympus公司提供.
1.3 细胞培养
L02人肝细胞株(购于中科院上海细胞库),培植于添加了10% FBS的高糖DMEM培养基(含100 U·mL-1青霉素和100 U·mL-1链霉素),在37 ℃、饱和湿度和5%二氧化碳的细胞培养箱(Formula 371,美国Thermo Scientific公司)中正常生长.
1.4 DPPH自由基消除试验
参考文献[13],取96孔板,每孔加100 μL 0.2 mmol·L-1DPPH及100 μL的不同浓度的样品液,迅速混匀,避光反应30 min,在517 nm处测定光密度D;在相同处理下,以维生素C溶液为阳性对照,以75%乙醇为空白对照.DPPH自由基消除率/%=(1-D1/D0)×100,式中,D1为样品孔或阳性对照孔测得光密度,D0为空白对照孔测得光密度.
1.5 ·OH自由基消除试验
参考文献[14],取96孔板,每孔加10 μL 8.8 mmol·L-1H2O2、10 μL 9 mmol·L-1水杨酸溶液、10 μL 9 mmol·L-1FeSO4和120 μL不同浓度的样品液,迅速混匀,37 ℃水浴15 min,在510 nm处测定光密度D;在相同处理下,以维生素C溶液为阳性对照,以75%乙醇为空白对照.·OH自由基消除率/%=(1-D1/D0)×100.式中,D1为样品孔或阳性对照孔测得光密度,D0为空白对照孔测得光密度.
1.6 ABTS+自由基消除试验
参照文献[15],取96孔板,每孔加160 μL ABTS+水溶液和40 μL不同浓度的样品液,迅速混匀,静置10 min,在734 nm处测定光密度D;在相同处理下,以维生素C溶液为阳性对照,以75%乙醇为空白对照.ABTS+自由基消除活力/%=(1-D1/D0)×100.式中,D1为样品孔或阳性对照孔测的光密度,D0为空白对照孔测得的光密度.
1.7 细胞存活率检测
取处于指数生长期L02细胞,调整浓度为5×104个·mL-1.取96孔板,每孔加入180 μL细胞,置培养箱中培养.24 h后,每孔加20 μL药液样品,置培养箱中培养24 h.24 h后,每孔加20 μL 5 g·L-1的MTT溶液,置培养箱中培养.4 h后,弃每孔细胞液,加入150 μL DMSO,在570 nm处测定光密度D;在相同处理下,设置调零孔(无添加细胞)和对照孔(无添加药品).细胞存活率/%=[(D1-D0)/(D2-D0)]×100.式中,D0为调零孔测得光密度,D1为药品注射孔测的光密度,D2为对照孔测得的光密度.
1.8 细胞清除活性氧簇(reactive oxygen species, ROS)的能力测定
取处于指数生长期L02细胞,调整浓度为5×104个·mL-1.取96孔板,每孔加入180 μL细胞,置培养箱中培养.24 h后,取不同浓度的药液样品处理细胞.2 h后,加入一定浓度下能显著引起细胞损伤的H2O2.22 h后,每孔加入150 μL DCFH-DA荧光探针;40 min后,用PBS清洗2遍以清除未结合的探针;最后,利用荧光酶标仪测定细胞裂解后活性氧产生的荧光作用强度F(激发波长488 nm,发射波长525 nm).ROS消除率/%=[1-(F试验-F空白)/(F模型-F空白)]×100.
1.9 蛋白表达的测定
向L02细胞加入不同浓度的药液样品,24 h后用PBS洗涤后控干.加入浆蛋白抽提试剂并置冰上裂解10 min.在4 ℃、12 000×g下离心10 min,所得上层清液为胞浆蛋白;分离下层沉淀,用抽提核内蛋白的试剂涡旋,在4 ℃、12 000×g下离心10 min,所获得的上层清液为核内蛋白.以BCA蛋白定量试剂盒(索莱宝公司产品)测定蛋白浓度.取目的蛋白进行SDS-PAGE凝胶电泳分离并转至PVDF膜,以5%脱脂奶粉封闭1 h,以相应的一抗和二抗反应液进行孵育,最后进行ECL显影和图像拍照.
1.10 mRNA表达的测定
采用qRT-PCR法:向L02细胞加入不同浓度的药液样品,24 h后用PBS洗涤后控干;加入Transzol溶液提取总RNA,并测定其浓度;将所提的RNA逆转录为cDNA,进行qRT-PCR检测.β-actin、HO-1、NQO-1和Nrf2的引物由上海生工生物工程公司合成,引物序列如表1所示.

表1 引物列表Table 1 List of primers used in PCR amplification
1.11 统计学处理
试验结果以SPSS 22.0软件系统进行分析,数据以平均值±标准偏差表示,组间的对比则用Dunnett检验,以P小于0.05为具统计学意义.
2 结果与分析
2.1 Biflorin和Isobiflorin的体外抗氧化性
首先,分别对Biflorin和Isobiflorin的自由基清除能力进行DPPH、·OH和ABTS+评估.结果表明,当浓度为0.05 mg·mL-1时,Biflorin和Isobiflorin对DPPH自由基的清除率分别为43.67%±3.24%和47.96%±2.73%,其消除IC50分别为(0.057±0.006)和(0.053±0.005) mg·mL-1,与Vc清除DPPH自由基的能力相当(图1A);浓度为0.1 mg·mL-1时,Biflorin和Isobiflorin对·OH自由基的消除率分别为53.96%±3.13%和53.56%±3.99%,其消除IC50分别为(0.084±0.008)和(0.076±0.006)mg·mL-1(图1B);浓度为0.05 mg·mL-1时,Biflorin和Isobiflorin对ABST+自由基的消除率分别为47.72%±3.02%和48.97%±3.91%,其消除IC50分别为(0.055±0.006)和(0.052±0.005) mg·mL-1,略低于Vc对ABTS+自由基的消除率(图1C).从上述体外自由基消除试验结果可知,Biflorin和Isobiflorin具有较强的自由基消除能力.
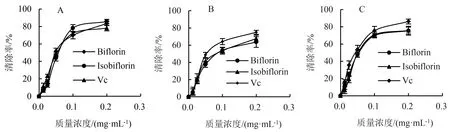
A.DPPH自由基清除率;B.·OH自由基清除率;C.ABST+自由基消除率.图1 Biflorin和Isobiflorin的体外自由基消除能力 Fig.1 Free radicals scavenging capacity of biflorin and isobiflorin in vitro
2.2 Biflorin和Isobiflorin对H2O2处理肝细胞的影响
L02细胞在不同浓度的过氧化氢溶液中处理4 h后,当过氧化氢浓度超过200 mmol·L-1时,L02细胞的存活受到显著抑制(P<0.05)(图2A).为了保证模型的稳定性,后续选择400 mmol·L-1的H2O2溶液构建氧化损伤L02细胞模型;再以不同浓度的Biflorin和Isobiflorin溶液作用于L02细胞,发现当Biflorin和Isobiflorin浓度为50、100和200 nmol·L-1时对肝细胞无明显增殖抑制(P>0.05)(图2B).因此,选择50~200 nmol·L-1样品浓度作用于H2O2诱导的L02肝细胞.
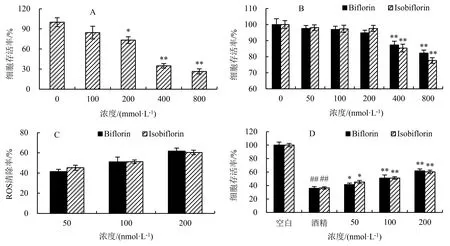
A.不同浓度H2O2对L02细胞存活率的影响;B.不同浓度Biflorin和Isobiflori对L02细胞存活率的影响;C.Biflorin和Isobiflorin对H2O2处理L02细胞ROS消除率的影响;D.Biflorin和Isobiflorin对H2O2处理L02细胞存活率的影响.与空白组相对比,##P<0.01;与模型组相对比,*P<0.05,**P<0.01.图2 Biflorin和Isobiflorin对H2O2处理肝细胞的影响Fig.2 Effect of biflorin and isobiflorin on H2O2-damaged hepatocyte
用Biflorin和Isobiflorin分别处理H2O2诱导的LO2肝细胞,结果显示,随着Biflorin和Isobiflorin浓度的增大,H2O2处理后L02细胞内ROS消除率逐渐增大,同时给药组细胞的存活率相较于模型组呈逐渐上升的趋势(P<0.05)(图2D).由此推测Biflorin和Isobiflorin可降低H2O2对肝细胞的氧化损伤程度,从而提高肝细胞的生存率.
2.3 Biflorin和Isobiflorin对Nrf2信号通路主要因子表达水平的影响
以不同浓度Biflorin和Isobiflorin药液样品分别预处理L02细胞20 h,以H2O2处理细胞4 h,然后提取总蛋白进行Western blot检测.结果显示,相较于空白组,模型组胞浆Nrf2蛋白含量大幅度降低,而核内Nrf2蛋白大幅度提升,模型组的HO-1和NQO-1的蛋白表达明显下调;随着Biflorin和Isobiflorin的浓度的增大,胞浆Nrf2蛋白含量逐渐上升,而核内Nrf2含量下降,并且L02细胞中的HO-1和NQO-1的蛋白表达水平也逐渐上调(图3).
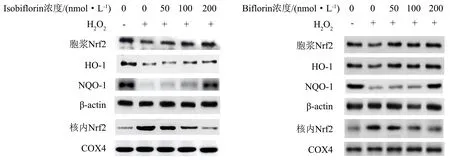
胞浆内的蛋白以β-actin为内参照抗体,核内的蛋白以COX-4为内参照抗体.图3 Biflorin和Isobiflorin对H2O2处理肝细胞的Nrf2、HO-1和NQO-1蛋白表达的影响Fig.3 Effect of biflorin and isobiflorin on the expressions of Nrf2, HO-1 and NQO-1 proteins in H2O2-damaged hepatocyte
同时,以Biflorin和Isobiflorin预给药20 h,再以H2O2继续处理L02细胞4 h后,对提取的L02细胞总 RNA 进行逆转录,并通过qRT-PCR测定基因表达量.结果表明,各组细胞中Nrf2 的mRNA表达水平均无明显的波动(P>0.05),但相比于空白组的细胞,模型组的HO-1和NQO-1的mRNA表达水平明显降低,而随着Biflorin和Isobiflorin浓度的增大,L02细胞中HO-1和NQO-1的mRNA表达水平逐渐提高(图4).
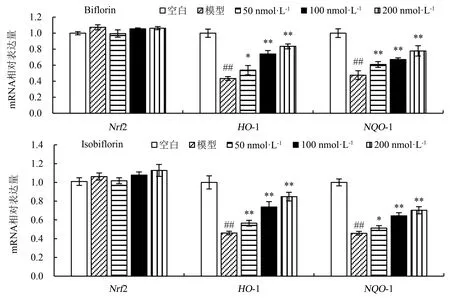
与空白组相对比时,##P<0.01;与模型组相对比时,*P<0.05,**P<0.01.图4 Biflorin和Isobiflorin对过氧化氢损伤L02细胞的Nrf2、HO-1和NQO-1 mRNA表达的影响Fig.4 Effect of biflorin and isobiflorin on mRNA expressions of Nrf2, HO-1 and NQO-1 in H2O2-damaged hepatocyte
由上述试验结果可推测,Biflorin和Isobiflorin可促进H2O2损伤的肝细胞内Nrf2基因进行核内转位,从而调节抗氧化基因HO-1和NQO-1的mRNA和蛋白表达.
4 讨论
色原酮化合物属于多酚类化合物,相关报道提示其较强的抗氧化能力.唐小涵等[16]从望江南中分离出两种色原酮,并通过DPPH法检验出其具有一定抗氧化能力.本研究建立DPPH、ABTS和·OH自由基清除能力评价体系,结果表明Biflorin和Isobiflorin对DPPH、·OH和ABTS+自由基的半数消除率相似,与阳性参照药物维生素C对DPPH和ABTS+自由基的消除能力相当,显示了这两种化合物良好的体外抗氧化活性,与上述结论一致.H2O2可造成机体自由基产生和清除的失衡,使得ROS在体内大量堆积,进而导致蛋白质、DNA、脂质等被ROS氧化损伤,因此ROS含量可反映细胞的氧化受损程度[17].本研究通过H2O2诱导建立细胞氧化损伤模型,发现随着Biflorin和Isobiflorin浓度的升高,L02细胞内的ROS消除率增大,且其存活率逐渐提高.
在一般的生理条件中,Nrf2与Keap抗原重组蛋白牢固结合并固定于细胞质溶胶中,主要作用于蛋白酶体的降解;在存在ROS等外界有害刺激的情况下,Nrf2从Keap1上释放,发生转位进入细胞核内,与抗氧化反应过程元件ARE结合而激活下游HO-1、NQO-1等抗氧化物基因的表达,从而使细胞内的氧化还原体系趋于平衡[18]. HO-1是一类关键的抗氧化酶,它通过促进血红素分解而产生的代谢产物胆绿素,对ROS有着显著的消除作用[19],而NQO1能够促进醌的排泄,从而抑制ROS的产生[20].孙涛等[21]发现在随着细胞内活性氧的减少与Nrf2、NQO1和HO-1基因和蛋白的表达上调.本研究利用RTq-PCR和Western blot测定Nrf2等抗氧化信号通道中关键基因的mRNA和蛋白的表达水平,发现Biflorin和Isobiflorin可通过促进Nrf2蛋白的核内转位,激活下游抗氧化基因NQO1和HO-1基因和蛋白的表达,从而抑制L02细胞氧化损伤并提高细胞的存活率.

