强污泥流失对anammox工艺脱氮性能及菌群的影响
赵一淳,刘亚雷,李亦舒,方媛媛,王博涵,李佳瑞,吴 懂,畅犇泽,阳广凤*
强污泥流失对anammox工艺脱氮性能及菌群的影响
赵一淳1,2,3,刘亚雷2,3,李亦舒2,3,方媛媛2,3,王博涵2,李佳瑞2,吴 懂2,畅犇泽2,阳广凤2,3*
(1.浙江海洋大学国家海洋设施养殖工程技术研究中心,浙江 舟山 316022;2.浙江海洋大学环境科学与工程系,浙江 舟山 316022;3.浙江省石油化工环境污染控制重点实验室,浙江 舟山 316022)
为探究强污泥流失对厌氧氨氧化(anammox)反应器系统脱氮性能、颗粒污泥特性及功能菌群的影响,试验以模拟废水为处理对象构建了上流式厌氧污泥床(UASB)反应器.试验结果表明,损失近一半反应器有效体积的污泥未明显破坏anammox工艺脱氮性能.反应器在4d后总氮(TN)的去除率(RE)达到89.18%污泥EPS含量较高且其PN/PS值(0.12)较低有利于anammox颗粒污泥的形成和集聚.Anammox颗粒污泥粒径>2mm的污泥占到系统总污泥的44.9%,粒径大于0.5mm的污泥占总污泥的84.3%,能够有效持留污泥.厌氧氨氧化菌的优势门为变形菌门(28.03%)、浮霉菌门(15.57%)和绿弯菌门(8.63%),优势属为anammox菌属(9.63%)和(3.54%),参与anammox反应的功能基因包括S(1.27%)、(1.28%)、(1.29%)、(7.04%)和(0.81%),但反硝化菌及其功能基因的存在使得化学计量比Rs(ΔNO2--N/ΔNH4+-N)和Rp(ΔNO3--N/ΔNH4+-N)低于理论值.
厌氧氨氧化;污泥流失;污泥特性;菌群;功能基因
废水脱氮重在将NH4+、NO2-和NO3-等转化为N2[1-2].物理和化学脱氮法成本高且有可能会造成二次污染[3].生物脱氮主要通过微生物作用而达到脱氮目的,运行成本低且二次污染少.传统的生物脱氮包括硝化和反硝化两个过程[4],但是由于硝化作用好氧,反硝化作用需要有机物[5],运行成本较高.厌氧氨氧化工艺(anammox)是一种更为高效低耗的新型脱氮技术,被广泛用于高氨氮、低C/N比废水处理[6-7].
厌氧氨氧化菌(AnAOB)是anammox工艺的主要功能菌群,能够在缺氧或者厌氧的条件下以NO2-作为电子受体直接将NH4+转化为N2[7-10].与传统生物脱氮工艺相比,anammox工艺具有不需要添加外源有机碳源、不需要曝气、占地面积少、运行成本低和剩余污泥量少等优点[6,9,11].Anammox工艺的启动及运行本质是反应器内AnAOB的激活、富集和增长,但由于AnAOB生长迟缓、倍增时间长、细胞产率低,对环境条件极为敏感[8,10-12],要实现anammox工艺稳定运行、提高脱氮性能具有一定的难度[13].
Anammox工艺的脱氮性能与污泥特性,包括生物量、污泥的粒径、沉降性能、胞外聚合物(EPS)、AnAOB活性、功能基因等有关[9-12].高浓度anammox污泥可快速启动anammox工艺并保持系统高效脱氮性能,而系统污泥流失不但会降低系统污泥浓度.而且会导致部分污泥上浮,进一步流失污泥,降低生物量,从而降低系统脱氮性能[14].显然,污泥流失对anammox工艺脱氮性能及污泥颗粒特性的影响研究十分重要.本研究构建并运行实验室规模的上流式厌氧污泥反应器(UASB),探究强污泥流失条件下对anammox系统脱氮性能的影响,以及在此基础上解析anammox颗粒污泥特性,探究颗粒污泥特性和功能菌群构成,阐明anammox工艺系统高效脱氮机理.
1 材料与方法
1.1 模拟废水
试验进水为模拟废水,含有基质、无机盐和营养元素等物质.具体进水成分包括基质:(NH4)2SO4和NaNO2各98mg/L;无机盐:KH2PO410mg/L、KHCO31000mg/L、MgSO4∙7H2O 200mg/L和CaCl2∙2H2O 100mg/L;营养元素Ⅰ:EDTA二钠6.25mg/L和FeSO4∙7H2O 11.43mg/L;营养元素Ⅱ:EDTA二钠6.25mg/L、ZnSO4∙7H2O 0.54mg/L、CoCl2∙6H2O 0.30mg/L、MnCl2∙4H2O 1.24mg/L、CuSO4∙5H2O 0.31mg/L、H3BO30.02mg/L、NaMoO4∙2H2O 0.28mg/L和NiCl2∙2H2O 0.26mg/L.
1.2 反应器及其运行
试验构建了实验室规模的UASB,总容积和有效容积分别为4.0和3.4L.反应器置于避光恒温室内,室内温度为(33±2)℃.模拟废水由蠕动泵泵入反应器.
反应器共分为3个运行阶段.阶段Ⅰ(1~96d),反应器水力停留时间(HRT)为3.12h,平均氮容积负荷(NLR)为1.55kg N/(m3∙d).阶段Ⅱ(97~149d),HRT降至1.92h,平均氮容积负荷(NLR)提高至2.55kg N/(m3∙d).阶段III(150~172d)初期,反应器取出anammox污泥1.6L,模拟系统污泥流失.取出的颗粒污泥近乎占反应器有效体积的1/2,属于较高的污泥流失,本研究将其界定为强污泥流失.取泥之后,HRT提升至4.08h,NLR降至1.21kg N/(m3∙d).在150和152d时,HRT分别降低至3.36和2.16h,平均NLR提升至2.25kg N/(m3∙d).
1.3 水质指标测定方法
定期取反应器进出水进行水质分析.NH4+-N、NO2--N和NO3--N分别采用苯酚-次氯酸盐比色法、N-(1-萘基)-乙二胺光度法和紫外分光光度法测定[15].混合液悬浮固体(SS)、混合液挥发性悬浮固体(VSS)采用重量法测定[15].
1.4 EPS测定及3D荧光光谱分析
1.4.1 EPS组分测定方法 试验结束取反应器污泥分析溶解型EPS(S-EPS)、松散型EPS(LB-EPS)和紧密型EPS(TB-EPS)[16]. EPS提取方法参照文献[16],EPS主要成分蛋白质(PN)和多糖(PS)分别采用Lowry法[17]和改进苯酚-硫酸法[18]测定.
1.4.2 3D荧光光谱图分析方法 本试验采用荧光光度计检测不同EPS的三维荧光光谱(3D-EEM).发射波长EM范围为200~550nm,扫描增量为1nm;激发波长EX范围为200~450nm,扫描增量为5nm.EM和EX的狭缝宽度均为10nm,扫描速度为1200nm/ min.
1.5 比厌氧氨氧化活性(SAA)分析
试验结束取混合均匀的anammox污泥用于测定污泥比厌氧氨氧化活性(SAA).污泥用纯净水清洗2~3次后取约20mL加入100mL的血清瓶中,加入部分提前预热35℃的蒸馏水,再添加NH4+-N和NO2--N储备溶液定容至100mL,使血清瓶NH4+-N和NO2--N浓度均为98mg/L.立即对血清瓶充高纯氮气3min以排除血清瓶中的溶解氧(DO),塞紧瓶塞放入摇床.摇床温度设置为35℃,转速为180r/min.试验开始时取第一个水样作为0h样品.之后1~2h定时取水样用于测量NH4+-N、NO2--N和NO3--N的浓度.通过浓度-时间曲线及血清瓶中VSS水平计算SAA值.
1.6 颗粒污泥粒级分析
采用筛分法测量粒径,采用标准筛筛分分析不同粒级的颗粒污泥组成.设置5个粒级范围分别为0.075~0.25,0.25~0.5,0.5~1,1~2和>2mm.分析每个粒级范围污泥的SS和VSS得出不同粒级anammox颗粒污泥分布特征.
1.7 菌群结构与功能基因分析
试验结束时取反应器污泥用于宏基因分析.测序由生工生物工程(上海)股份有限公司进行.采用NEB Next®Ultra™ DNA Library Prep Kit for Illumina® 试剂盒提取样品DNA.经Illumina Hiseq™得到的原始图像数据文件由CASAVA碱基识别(Base Calling)分析转化为原始测序序列(Sequenced Reads).分别采用FastQC和Trimmomatic对原始数据进行质量评估和过滤处理.使用IDBA_UD拼接组装Clean reads,获得长序列contig,并根据reads间的overlap关系获得contigs,综合评定多个Kmer的组装结果,选择最佳组装结果.之后采用Prodigal对拼接的contigs进行ORF预测,选择长度不小于100bp的基因并翻译成蛋白序列.采用CD-HIT去冗余获得非冗余基因集.采用Bowtie2将样本Clean reads比对到非冗余基因集序列上,利用SAMtools获得比对成功的reads,再结合基因长度计算基因的丰度.将基因集与NR、KEGG、eggNOG、ARDB、CAZy和SEED进行比对,获得物种和功能注释信息以及功能丰度和物种丰度.
2 结果与讨论
2.1 脱氮性能
2.1.1 运行性能分析 本试验历时172d,试验期间反应器运行性能如图1所示.阶段Ⅰ,反应器NH4+-N、NO2--N和NO3--N的平均出水浓度分别为4.24,0.4和14.40mg/L,NH4+-N、NO2--N和TN的平均去除率分别高达95.60%、99.20%和90.52%.在anammox工艺中,可通过缩短HRT提高NLR.阶段II,反应NLR由1.55kg N/(m3∙d) 提高至2.55kg N/(m3∙d).在整个阶段Ⅱ,NH4+-N、NO2--N和NO3--N的平均出水浓度略有升高分别为6.88,0.77和14.14mg/L,NH4+-N、NO2--N和TN的平均去除率分别为93.20%、99.24%和89.33%.此阶段的平均去除速率(NRR)由1.40kg N/(m3∙d)提升至2.27kg N/ (m3∙d).
阶段III,反应器取泥1.6L后HRT提升至4.08h,NLR降至1.21kg N/(m3∙d).在150d时测得出水NH4+-N、NO2--N和NO3--N浓度分别为5.15,0.47和11.63mg/L.第153d,HRT进一步降低缩短至2.16h,与取泥前的HRT接近,平均NLR提升至2.25kg N/(m3∙d).在取泥4d后,出水NH4+-N、NO2--N和NO3--N浓度分别为7.87,0.24和15.04mg/L,TN去除率达89.18%.经运行20d后,反应器测得在153~172d内平均出水NH4+-N、NO2--N和NO3--N浓度分别为8.35,0.43和14.16mg/L,对应NH4+-N和NO2--N的平均去除率均在90%以上,平均TN去除率达88.69%,对应NRR为2.00kg N/(m3∙d).
Anammox工艺污泥流失在反应器中会经常遇到,一般而言,当进水的上升流速大于颗粒污泥的沉降速度便会造成污泥流失.本试验污泥流失的量接近有效容积的1/2,但经过4d的恢复,反应器脱氮性能便接近污泥流失前,说明强污泥流失并未对脱氮性能造成较大的影响.可能是污泥流失后,下层被挤压的污泥开始上浮,污泥与水接触的表面积增大,加之AnAOB位于颗粒污泥外部[14],系统脱氮潜力得到了充分开发.
2.1.2 化学计量比分析 在anammox工艺中, NO2--N与NH4+-N的消耗量之比(s:ΔNO2--N/ ΔNH4+-N)及NO3--N生成量与NH4+-N的消耗量之比(p:ΔNO3--N/ΔNH4+-N)可以有效表征系统anammox脱氮性能[19].据报道,anammox反应中s和p最佳理论值分别为1.32和0.26[6].本试验中,阶段Ⅰ和Ⅱ的s和p值分别为0.99~1.17和0.10~ 0.17,均值分别为1.10和0.13.阶段Ⅲs值略有下降,为0.92~1.08,均值为1.03.p变化不大,范围和均值分别为0.11~0.18和0.13.显然,取泥前后的s和p值均低于理论值.现有研究表明,anammox系统中s和p的值受进水组分、环境条件、反应器构造和AnAOB等因素影响,导致与理论值产生一定的差异.Wang等[20]研究得出在提高氮负荷的条件下,p高于2.2.唐崇俭等[21]研究得出s和p的实际值分别为0.5~1.1和0.04~0.41.本试验p值低于理论值,但均在报道的范围之内,可能存在一部分NO3--N发生了内源反硝化反应造成(2.4功能菌群和功能基因分析证实了这一点).

2.2 Anammox颗粒污泥粒径和SAA分析

表1 不同颗粒粒径anammox污泥生物量水平
试验结束时,试验测得5和30min的污泥沉降比(SV)SV5和SV30分别为40%和37%.SV值越低,沉降性能越好.污泥沉降的越快,代表污泥颗粒密实、紧凑,污泥处理效果越好.本试验的SV值表明污泥沉降性能较好.不同颗粒粒径anammox污泥生物量水平如表1所示.试验结果表明,粒径小于0.5mm污泥颗粒的VSS/SS为9.6%,大于0.5mm污泥颗粒的VSS/SS为77.2%.粒径大于0.5mm的污泥占总污泥的84.3%,大于2mm的颗粒占比44.9%.据Wang等[22]研究,anammox污泥最佳粒径处于2.00~4.75mm,表明系统污泥颗粒化情况非常好,且大颗粒污泥中含有较高的挥发性有机质.本研究中,以NH4+-N、NO2--N和TN表征的比厌氧氨氧化活性(SAA)分别为0.06kg NH4+-N/(kgVSS∙d)、0.11kg NO2—N/(kgVSS∙d)和0.24kg TN/(kgVSS∙d).
2.3 胞外聚合物(EPS)的含量及荧光光谱
2.3.1 EPS含量 试验提取到的S-EPS、LB-EPS和TB-EPS的DNA含量分别为0.0269、0.0122和0.3252mg/L.EPS中DNA含量是衡量EPS提取过程中细胞破损程度的重要指标[22],如果提取物中DNA含量异常高则表明提取时有较多的微生物细胞发生破裂,提取效果不佳.本文得到的提取物中DNA含量均比较低,说明试验EPS的提取有效.
EPS主要由PN和PS构成[16],污泥中不同EPS的PN、PS和总EPS含量如表2所示.试验结果表明,TB-EPS的含量最高,占总EPS的64.89%,S-EPS和LB-EPS各占21.07%和14.04%.TB-EPS在污泥颗粒化中是重要组成部分,对污泥的凝聚和沉降性能起着关键作用[16,23].
PN/PS是表征污泥凝聚性和沉降性的关键因子.PN与PS分别表现为疏水性和亲水性,且分别存在于细胞的内部与外部,极大地影响着细菌表面电荷、疏水性及聚集体空间结构[24].试验中S-EPS、LB-EPS、TB-EPS和总EPS的PN/PS分别为0、0、0.27和0.16,表明PN值均低于PS.Wang等[25]发现PS存在大量氢键,且具有高粘度、高机械强度和高度支化的结构,促进了anammox污泥的高聚集.唐崇俭等[26]的研究表明PN/PS越小颗粒越稳定.本试验中污泥颗粒化程度高,有可能跟较高的PS含量有关.本试验中,S-EPS和LB-EPS未检测到PN含量,可能是因为颗粒污泥较为密实造成的结果.
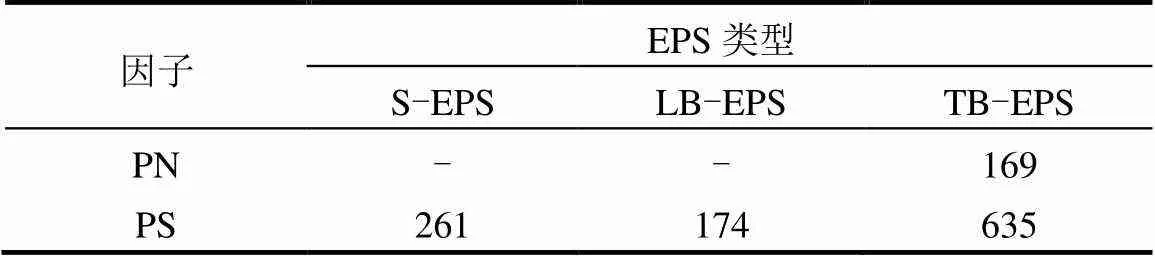
表2 不同EPS的PN和PS含量(mg/L)
注:-表示未检出.
然而,顾澄伟[16]观察到厌氧氨氧化系统污泥颗粒化过程中PN/PS值在不断增大,在高负荷运行条件下可达4.87;陈方敏等[27]观察到PN/PS为1~5,值越大污泥颗粒越趋于稳定;由于PN独特的疏水性及表面带负电荷,可作用于大量离子相互凝聚.PN/PS值的大小与厌氧氨氧化污泥颗粒化及颗粒稳定性的关系仍需进一步研究.
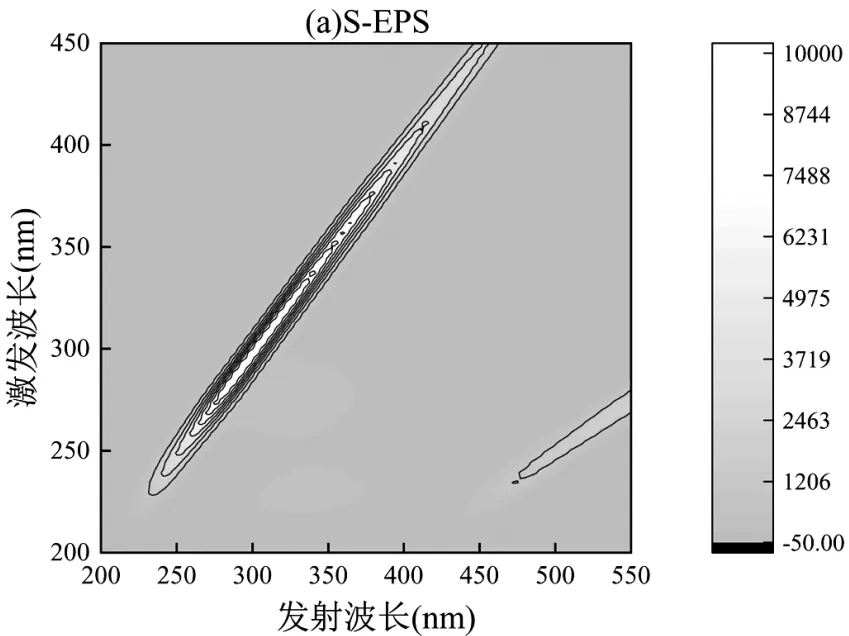
2.3.2 3D-EMM分析 颗粒污泥S-EPS、LB-EPS和TB-EPS(10倍稀释样)的3D-EMM如图2所示. S-EPS和LB-EPS没有扫描出明显的特征峰,而TB- EPS共检测到2个峰A和B.峰A(x/m=275~ 300/ 320~360)为类色氨酸蛋白物质,峰B(x/m=225~ 250-300~325)为类酪氨酸蛋白物质.显然,不同类型的EPS含有蛋白类型存在差异.由于峰A荧光强度高于峰B,所以TB-EPS中类色氨酸蛋白物质较高,这与Liu等[28]报道的结果一致.类蛋白物质的存在可提高颗粒污泥的凝聚性和稳定性.
2.4 菌群结构分析
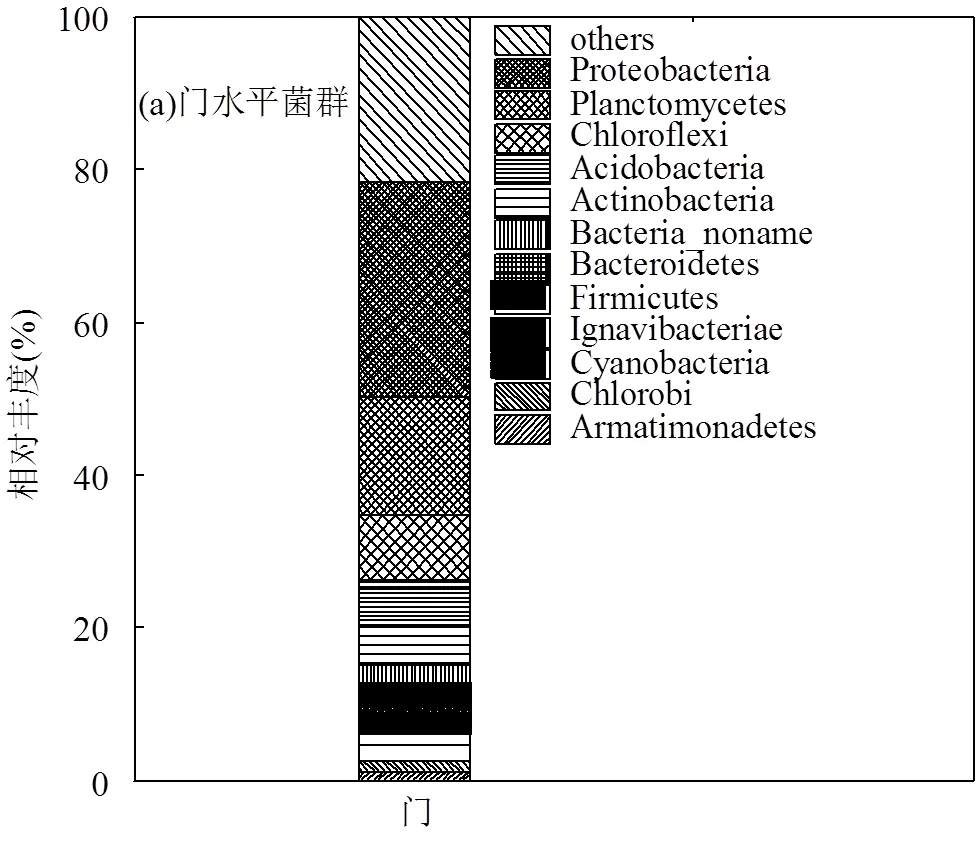
2.4.1 菌群在门水平的种类及丰度分析 试验共检测到12个相对丰度(RA)大于1%的门,包括装甲菌门(Armatimonadetes)、绿菌门(Chlorobi)、蓝细菌门(Cyanobacteria)、Ignavibacteriae菌门、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、Bacteria_ noname菌门、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)和变形菌门(Proteobacteria)(图3a).显然,RA排列前三的门分别为变形菌门、浮霉菌门和绿弯菌门,RA分别为28.03%、15.57%和8.63%,Liu等[29]也在anammox系统中观察到了这3种优势菌门.在annmmox反应系统中,浮霉菌门和变形菌门的很多细菌与脱氮作用相关.AnAOB属于浮霉菌门,是anammox反应的主要承担者.本研究中变形菌门的RA高于浮霉菌门.研究表明,变形菌门某些细菌也会促进反硝化反应[30],这可能是本试验Rp值偏低的原因之一.绿弯菌门也是ananmmox反应中常见的菌门,虽然没有直接脱氮的作用,但不可缺少.Ismail等[31]研究得出,当anammox菌处于高浓度有机环境时,绿弯菌门的丰度会大幅增加,以利用和降解已腐烂的anammox菌体,降低有机物对anammox系统的抑制作用.本试验还检测anammox系统中常见的影响脱氮的门,如厚壁菌门.厚壁菌门某些细菌会参与反硝化作用,且对一些不利的环境因子具有一定的耐受作用[3,30].Anammox系统中的装甲菌门和酸杆菌门会使氨被过度消耗[32-33],这可能是本试验中Rs值低于理论值的原因之一.
2.4.2 菌群在属水平的种类及丰度分析 颗粒污泥菌群在属水平的组成及相对丰度如图3(b)所示.RA大于0.5%的属共有22个,其中、和_的相对丰度为前3位.据报道,共有7个属[34],分别为、、、、、和.本试验检测到的优势AnAOB属为和, RA分别为9.63%和3.54%.显然,污泥流失之后,菌属仍是系统颗粒污泥的优势菌属.其中,的相对丰度是的2.7倍,这可能是由于氮负荷大小造成的,据Li[35]报道,在低氮负荷的丰度高于,且随着氮负荷的增加,的丰度会逐渐增加.
2.5 功能基因组分析
颗粒污泥具有较高的物种及基因多样性.试验共检测到648580个基因,Shnnon指数和Simpson指数分别为11.70和2.4×10-5.本试验共检测到18个与氮素代谢有关的功能基因(图4).在anammox反应中[36],起关键作用的代谢酶有亚硝酸盐还原酶(S)、联氨合成酶()、联氨氧化酶()、羟胺氧化还原酶()及联氨脱氢酶()[37].AnAOB通过S将NO2--N还原为NO,其在的作用下结合NH4+-N生成N2H4,最后通过功能基因//将生成的N2H4转化为N2[36,38].本试验中,anammox功能基因包括S、、、和,相对丰度分别为1.27%、1.28%、1.29%、7.04%和0.81%.
基因是AnAOB独有的一种功能基因,只能被用来氧化N2H4生成N2[13].基因产生的渠道有好氧氨氧化菌(AOB)、反硝化菌(DB)和AnAOB[39],但不同菌种的基因所表达的功能不同.AOB和DB中的基因既可以将NH2OH氧化为NO2-,又可以将NO2--N还原为NH2OH[1],来自AnAOB的基因只能将NH2OH氧化为NO.对N2H4的亲和力弱于,更倾向于亲和NH2OH,但会结合NH2OH却没有任何作用[39],故NH2OH的含量会抑制的活性.周英杰等[40]研究发现NH2OH含量超过2.4μmol/L便会对活性造成抑制.NH4+-N能够在和的作用下生成NH2OH[38-39].本试验的RA为0.0076%,由于厌氧条件,的作用生成的NH2OH可能较低.本试验中的RA为7.04%.在的作用下,部分NO2--N转化为NH2OH.本试验检测出变形菌门的RA为28.03%.反硝化菌属于变形菌门[13,41],故部分的有可能来自于DB.
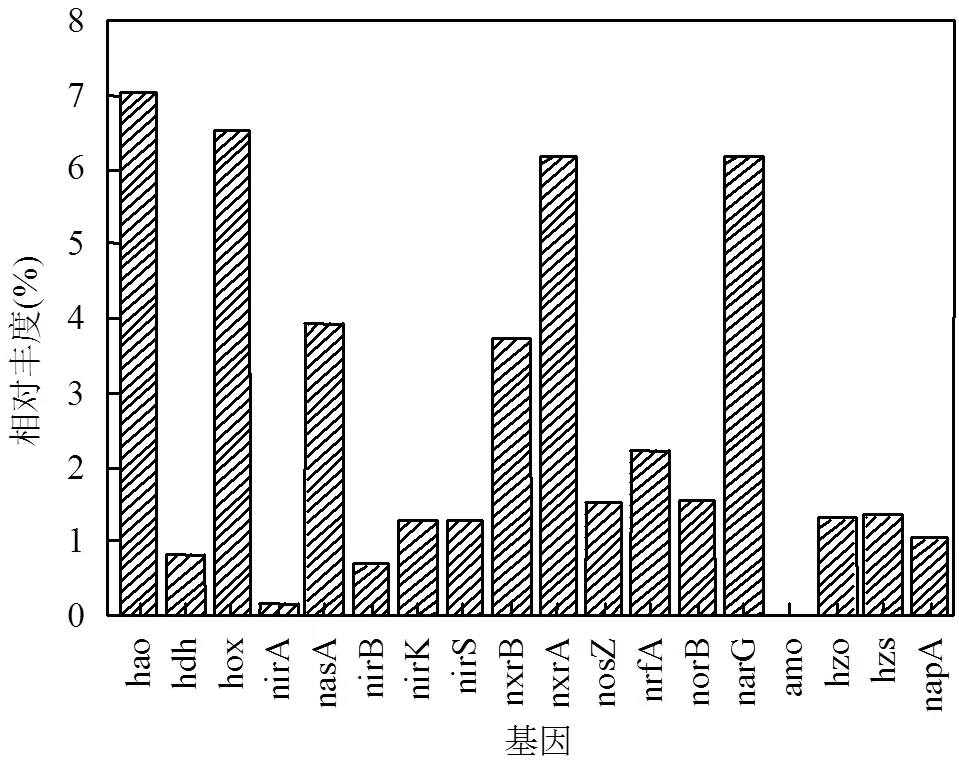
图4 功能基因丰度
在本试验中,和的RA较低,分别为1.28%和1.29%.即便如此,试验期间反应器有着稳定的脱氮性能,这说明和的活性较高.在试验运行条件下,其能够满足系统稳定脱氮,Wang等[42]的研究揭示了在合适的运行环境下少量的基因丰度就可以表现出较高的厌氧氨氧化活性.只有在温度过高或过低或偏酸偏碱等逆境中,AnAOB才需要转录更多的基因来表达更多的酶来抵制不利环境因子的影响.
本试验也检测到了RA为6.20%的多功能酶硝酸盐-亚硝酸盐氧还酶基因(G)和硝酸还原酶前体基因(A),其相对丰度分别为6.20%和1.04%. Anammox反应产生的硝酸盐在G和A的作用下会进行反硝化反应[38],这也是本试验Rp低于理论值的原因.试验还检测出RA为2.23%和0.69%的形成氨的异化亚硝酸盐还原酶基因(A)和B,A和B可促进NO2--N向NH4+-N转换[1].以及1.56%的一氧化氮还原酶基因(B)和1.51%的一氧化二氮还原酶基因(Z)等,B可将NO还原为N2O,Z进一步将N2O还原为N2[36].试验结果表明,整个anammox系统跟脱氮相关的途径不止一个,系统脱氮过程可能由不同基因表达合成的酶共同完成.
3 结论
3.1 Anammox工艺能够保持长期稳定运行, NH4+-N、NO2--N和TN的平均去除率分别高达95.60%、99.20%和90.52%.在稳定运行的anammox系统中,污泥流失并未对anammox系统的脱氮性能造成较大影响,TN平均去除率仍可达88.69%,并在4d后恢复到89.18%.
3.2 较高的EPS含量及较低的PN/PS值(0.12)有利于anammox颗粒污泥的形成和集聚.Anammox颗粒污泥粒径大于0.5mm的污泥占总污泥的84.3%,能够有效持留污泥.
3.3 Anammox工艺优势菌门为变形菌门(28.03%)、浮霉菌门(15.57%)和绿弯菌门(8.63%). AnAOB优势属为(9.63%)和(3.54%),主要脱氮功能基因为S(1.27%)、(1.28%)、(1.29%)、(7.04%)和(0.81%).此外,反硝化菌及其功能基因的存在使得anammox反应化学计量比Rs和Rp低于理论值.
[1] You Q G, Wang J H, Qi G X, et al. Anammox and partial denitrification coupling: a review [J]. RSC Advances, 2020,10: 12554-12572.
[2] Liu Y X, Liu W, Li Y Y, et al. Layered inoculation of anaerobic digestion and anammox granular sludges for fast start-up of an anammox reactor [J]. Bioresource Technology, 2021,339(11):125573.
[3] Li Y, Fan T, Xu D, et al. Advances in biological nitrogen removal of landfill leachate [J]. Sustainability, 2021,13(11):6236.
[4] Ren Y, Ngo H H, Guo W S, et al. New perspectives on microbial communities and biological nitrogen removal processes in wastewater treatment systems [J]. Bioresource Technology, 2019,297(8):122491.
[5] Wei Y, Jin Y, Zhang W J. Domestic Sewage Treatment Using a one-stage ANAMMOX process [J]. International Journal of Environmental Research and Public Health, 2020,17(9):3284.
[6] Strous M, Heijnen J J, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. Applied Microbiology and Biotechnology, 1998,50(5):589-596.
[7] 陈重军,王瑶琪,姜 滢,等.有机物对连续流Anammox脱氮及微生物群落影响 [J]. 中国环境科学, 2019,39(12):5049-5055.
Cheng C J, Wang Y Q, Jiang Y, et al. Effects of organic matter on nitrogen removal and microbial community in anammox reactor [J]. China Environmental Science, 2019,39(12):5049-5055.
[8] Wang Y, Ji X M, Jin R C. How anammox responds to the emerging contaminants: Status and mechanisms [J]. Journal of Environmental Management, 2021,293:112906.
[9] Kocamemi B A, Dityapak D, Semerci N, et al. Anammox start-up strategies: the use of local mixed activated sludge seed versus anammox seed [J]. Water Science & Technology, 2018,78(9):1901– 1915.
[10] Zheng B Y, Zhang L, Guo J H, et al. Suspended sludge and biofilm shaped different anammox communities in two pilot-scale one-stage anammox reactors [J]. Bioresource Technology, 2016,211:273-279.
[11] Niederdorfer R, Hausherr D, Palomo A, et al. Temperature modulates stress response in mainstream anammox reactors.[J]. Communications Biology, 2021,4(1):23.
[12] Adams M, Xie J X, Kabore A W J, et al. Research advances in anammox granular sludge:a review [J]. Critical Reviews in Environmental Science and Technology, 2020,(4):1-44.
[13] Lin Q J, Kang D, Zhang M, et al. The performance of anammox reactor during start-up: enzymes tell the story [J]. Process Safety and Environmental Protection, 2019,121:247-253.
[14] Zhu G B, Wang S Y, Ma B, et al. Anammox granular sludge in low-ammonium sewage treatment: Not bigger size driving better performance [J]. Water Research, 2018,142:147-158.
[15] 国家环境保护总局.水和废水监测分析方法[M]. 4版.北京:中国环境科学出版社, 2002:227-285.
The State Environmental Protection Administration. Water and wastewater monitoring and analysis method [M]. 4th Edition. Beijing: China Environmental Science Press, 2002:227-285.
[16] 顾澄伟.厌氧氨氧化颗粒污泥培养及其颗粒特性研究[D]. 苏州:苏州科技大学, 2019.
Gu C W. The Cultivation and features of anammox granular sludge [D]. Suzhou: Suzhou University of Science and Technology, 2019.
[17] Adav S S, Lee D J. Extraction of extracellular polymeric substances from aerobic granule with compact interior structure [J]. Journal of Hazardous Materials, 2008,154(1-3):1120-1126.
[18] Luo J H, Hao T W, Wei L, et al. Impact of influent COD /N ratio on disintegration of aerobic granular sludge [J]. Water Research, 2014, 62:127-135.
[19] 朱晓桐,于冰洁,林久淑,等.ANAMMOX-UASB反应器启动特性[J]. 环境科学与技术, 2020,43(12):143-150.
Zhu X T, Yu B J, Lin J S, et al. Startup characteristics of ANAMMOX-UASB reactor [J]. Environmental Science & Technology [J]. Environmental Science & Technology, 2020,43(12): 143-150.
[20] Wang D P, He Y, Zhang X X. A comprehensive insight into the functional bacteria and genes and their roles in simultaneous denitrification and anammox system at varying substrate loadings [J]. Applied Microbiology and Biotechnology, 2019,103(3):1523-1533.
[21] 唐崇俭,郑 平,陈建伟,等.中试厌氧氨氧化反应器的启动与调控[J]. 生物工程学报, 2009,25(3):406-412.
Tang C J, Zheng P, Chen J W, et al. Start-up and process control of a pilot-scale Anammox bioreactor at ambient temperature [J]. Chinese Journal of Biotechnology, 2009,25(3):406-412.
[22] Lotti T, Carretti E, Berti D, et al. Extraction, recovery and characterization of structural extracellular polymeric substances from anammox granular sludge [J]. Journal of Environmental Management, 2019,236(15):649-656.
[23] Wang W G, Yan Y, Zhao Y H, et al. Characterization of stratified EPS and their role in the initial adhesion of anammox consortia [J]. Water Research, 2020,169:115223.
[24] McSwain B S, Irvine R L, Hausner M, et al. Composition and distribution of extracellular polymeric substances in aerobic flocs and granular sludge [J]. Applied and Environmental Microbiology, 2005, 71(2):1051-1057.
[25] Wang S, Huang X X, Liu L J, et al. Understanding the mechanism in aggregation ability between aerobic and anammox granular sludge from the perspective of exopolysaccharides [J]. Journal of Water Process Engineering, 2020,38:101629.
[26] 唐崇俭,郑 平,汪彩华,等.高负荷厌氧氨氧化EGSB反应器的运行及其颗粒污泥的ECP特性[J]. 化工学报, 2010,61(3):732-739.
Tang C J, Zheng P, Wang C H, et al. Granulation and characteristics of extracellular polymers of anammox sludge in high-load EGSB reactor [J]. CIESC Journal, 2010,61(3):732-739.
[27] 陈方敏,顾澄伟,胡羽婷,等.厌氧氨氧化污泥恢复过程中的颗粒特性[J]. 环境科学, 2018,39(12):319-325.
Chen F M, Gu C W, Hu Y T, et al. Granular characteristics of anaerobic ammonia oxidation sludge during the recovery process [J]. Environmental Science, 2018,39(12):319-325.
[28] Liu S, Lin C, Diao X X, et al. Interactions between tetracycline and extracellular polymeric substances in anammox granular sludge [J]. Bioresource Technology, 2019,293:122069.
[29] Liu L J, Ji M, Wang F, et al. Microbial community shift and functional genes in response to nitrogen loading variations in an anammox biofilm reactor [J]. International Biodeterioration & Biodegradation, 2020,153:105023.
[30] Yu M, Liao R H, Zhang X X, et al. Metagenomic insights into Cr (VI) effect on microbial communities and functional genes of an expanded granular sludge bed reactor treating high-nitrate wastewater [J]. Water Research, 2015,76:43-52.
[31] Ismail S, Elreedy A, Elsamadony M, et al. Response of anammox bacteria to short-term exposure of 1,4-dioxane: Bacterial activity and community dynamics [J]. Separation and Purification Technology, 2021,266:118539.
[32] Zhang Z, Liu S. Insight into the overconsumption of ammonium by ANAMMOX consortia under anaerobic conditions [J]. Journal of Applied Microbiology, 2014,117(6):1830-1838.
[33] 黄郑郑,曹 刚,李紫惠,等.XH02菌强化反应器脱氮过程中菌群结构的高通量分析[J]. 中国环境科学, 2017,37(5):1922-1929.
Huang Z Z, Cao G, Li Z H, et al. High-throughput sequencing analysis of community structure in reactor enhanced by heterotrophic nitrification-aerobic denitrification bacteria XH02 [J]. China Environmental Science, 2017,37(5):1922-1929.
[34] Alyne D P, Angela C, Claudia E, et al. Microbial communities in anammox reactors: a review [J]. Environmental Technology Reviews, 2017,6(1):74-93.
[35] Li Q Y, Chen J H, Liu G H, et al. Effects of biotin on promoting anammox bacterial activity [J]. Scientific Reports, 2021,11(1):2038.
[36] Zhao Y P, Jiang B, Tang X, et al. Metagenomic insights into functional traits variation and coupling effects on the anammox community during reactor start-up [J]. Science of the Total Environment, 2019, 687:50-60.
[37] 王海月,彭 玲,毛念佳,等.三价铁对有机物存在下厌氧氨氧化脱氮的影响[J]. 中国环境科学, 2021,41(4):1672-1680.
Wang H Y, Peng L, MaoN J, et al. Effect of Fe3+on nitrogen removal of Anammox in the presence of organic matter [J]. China Environmental Science, 2021,41(4):1672-1680.
[38] Peeters S H, Niftrik L V. Trending topics and open questions in anaerobic ammonium oxidation [J]. Current Opinion in Chemical Biology, 2019,49:45-52.
[39] 赵弋戈,郑 平.厌氧氨氧化体的组成、结构与功能[J]. 微生物学报, 2016,56(1):8-18.
Zhao Y G, Zheng P. Composition, structure and function of anammox [J]. Acta Microbiologica Sinica, 2016,56(1):8-18.
[40] 周英杰,王淑梅,张兆基,等.厌氧氨氧化菌的代谢途径及其关键酶的研究进展[J]. 生态学杂志, 2012,31(3):738-744.
Zhou Y J, Wang S M, Zhang Z J, et al. Metabolic pathways of anammox bacteria and related key enzymes: a review [J]. Chinese Journal of Ecology, 2012,31(3):738-744.
[41] 常尧枫,郭萌蕾,谢军祥,等.厌氧氨氧化脱氮除碳功能菌群结构及代谢途径[J]. 中国环境科学, 2022,42(3):1138-1145.
Chang Y F, Guo M L, Xie J X, et al. The structure and metabolic pathway of functional bacteria for nitrogen and carbon removal in Anammox [J]. China Environmental Science, 2022,42(3):1138-1145.
[42] Wang Z B, Ni S Q, Zhang J, et al. Gene expression and biomarker discovery of anammox bacteria in different reactors [J]. Biochemical Engineering Journal, 2016,115:108-114.
Effects of high sludge loss on the nitrogen removal performance and microbial community of anammox process.
ZHAO Yi-chun1,2,3, LIU Ya-lei2,3, LI Yi-shu2,3, FANG Yuan-yuan2,3, WANG Bo-han2, LI Jia-rui2, WU Dong2, CHANG Ben-ze2, YANG Guang-feng2,3*
(1.National Engineering Research Center of Marine Facility Aquaculture, Zhejiang Ocean University, Zhoushan 316022, China;2.Department of Environmental Science and Engineering, Zhejiang Ocean University, Zhoushan 316022, China;3.Zhejiang Key Laboratory of Petrochemical Environmental Pollution Control, Zhoushan 316022, China)., 2022,42(5):2161~2168
In order to study the effects of strong sludge loss on the operation performance, characteristics of granular sludge and nitrogen removal bacteria and functional genes in anaerobic ammonia oxidation (anammox) reactor, a upflow anaerobic sludge blanket (UASB) system was constructed and operated to treat synthetic wastewater. Experimental results showed that the nitrogen removal performance of anammox process was not obviously impaired by high sludge loss, and the total nitrogen (TN) removal efficiency (RE) reached 89.18% after 4days’ recovery. A higher EPS content and a lower PN/PS value of 0.12were beneficial to the formation and agglomeration of anammox granular sludge. The anammox granular sludge with sludge size of > 2mm accounted for 44.9% of the total sludge in this system, and corresponding value was 84.3% for the sludge with size of > 0.5mm, which was advantage to the sludge retention in the reactor. The dominant anammox phyla were Proteobacteria (28.03%), Planctomycetes (15.57%) and Chloroflexi (8.63%), and the domimant genera were anammox bacteria(9.63%) and(3.54%). The functional genes involved in anammox reaction includedS(1.27%),(1.28%),(1.29%),(7.04%) and(0.81%), but the presence of denitrification bacteria and related functional genes decreased the stoichiometric ratios Rs (ΔNO2--N/ΔNH4+-N) and Rp (ΔNO3--N/ΔNH4+-N) of anammox reaction.
anaerobic ammonia oxidation;sludge loss;sludge characteristics;bacterial community;functional genes
X703
A
1000-6023(2022)05-2161-08
赵一淳(1997-),男,甘肃兰州人,浙江海洋大学在读硕士研究生,主要从事新型生物脱氮技术研究.
2021-10-25
国家自然科学基金资助项目(51808498);浙江省自然科学基金青年基金资助项目(LQ17E090002);国家级大学生创新训练项目(202010340008)
* 责任作者, 讲师, ygfscu@126.com;yanggf@zjou.edu.cn

