Fonsecaea monophora色素株促进巨噬细胞凋亡的研究
李敏英, 黄欢, 刘红芳, 曾维英, 席丽艳,2
1.南方医科大学皮肤病医院,广东 广州 510091;2.中山大学孙逸仙纪念医院,广东 广州 510120
着色芽生菌病(chromoblastomycosis, CBM)是一种诱因复杂的、多因素作用引起的疾病,不仅与致病菌本身的毒力因子(如硬壳小体、细胞壁黑素、胞外蛋白酶等)有关,还与宿主的免疫密切相关[1-2]。黑素作为一种重要的真菌毒力因子,在多种病原真菌的致病性中发挥着重要作用,比如白念珠菌、隐球菌和曲霉等[3-4]。黑素不仅使病原真菌具有较强的抵御外界压力的能力(比如离子辐射、氧化条件、pH 值改变、温度变化),还与真菌耐药有关,在与宿主的免疫应答中也发挥着重要作用[5],但具体机制尚不明确。
在我国南方,F.monophora是主要的病原菌[6],黑素是其重要的毒力因子。F.monophora着色霉主要合成DHN-黑素,分布在细胞壁的外层。研究表明,真菌黑素不仅能抑制巨噬细胞凋亡,也能促进其凋亡。在烟曲霉中,色素株(DHN-黑素)通过激活PI3K/Akt通路,上调Mcl-1抗凋亡基因的表达,抑制FoxO1、IκB促凋亡基因的磷酸化,抑制巨噬细胞凋亡[7]。而在马尔尼菲蓝状菌当中,黑素(L-DOPA黑素)促进巨噬细胞的裂解,促进其凋亡,并且抑制巨噬细胞的吞噬[8]。但目前尚未见F.monophora着色霉黑素是否对巨噬细胞凋亡有影响的相关报道。细胞凋亡受多个基因表达调控影响,其中BCL-2、Bax及聚二磷酸腺苷核糖聚合酶PARP-1基因的表达与凋亡密切相关。本研究通过观察F.monophora色素株对巨噬细胞凋亡相关基因BCL-2、Bax及PARP-1表达的影响,从而探讨F.monophora色素株对巨噬细胞凋亡的影响。
1 材料与方法
1.1 细胞和菌株
小鼠单核巨噬细胞系RAW264.7细胞购自中国典型培养物保存中心China Center TypeCulture Collection (CCTCC)。F.monophora色素株(CBS122845,SUMS0505)分离自一位 81 岁CBM 患者的皮损[9],是一种分生孢子突变株,经形态学和内转录间隔区(internal transcribed spacer,ITS)序列测序分析鉴定为F.monophora,具有黑素,无菌丝结构;F.monophora白化株(CBS125149,SUMS0510)是由色素株多次传代后得到的天然白化菌株,不含黑素,也无菌丝结构。
1.2 主要试剂
马铃薯葡萄糖琼脂培养基(PDA)(BD,美国);DMEM 培养基(Gibco,美国);青霉素/链霉素混合液(双抗)(Gibco,美国);胎牛血清(Fetal Bovine Serum,FBS)(Gibco,美国);PBS缓冲液(广州鼎国生物技术有限公司);RIPA裂解液(广州鼎国生物技术有限公司);24孔细胞培养板(广州永津生物科技有限公司);BCA 蛋白定量试剂盒(Thermo Scientific,美国);抗PARP-1 抗体(Abcam,英国);凋亡检测试剂盒(上海碧云天生物技术有限公司);Trizol RNA提取试剂(Invitrogen,美国);Thermo Scientific DreamTaq Green PCR Master Mix (2×)(Thermo Scientific,美国);RevertAid Master Mix(Thermo Scientific,美国)。
1.3 方法
1.3.1 细胞复苏、传代及培养 在无菌超净台内,无菌操作复苏 RAW264.7细胞株,用提前配制好的含10%胎牛血清和1%双抗的DMEM培养基在5% CO2、37 ℃培养箱中培养2~3 d。经传代状态稳定后,用血细胞计数板计算细胞密度,接种1×105个细胞至24孔板。
1.3.2 制备F.monophora孢子悬液 将F.monophora色素株和白化株接种到马铃薯葡萄糖琼脂培养基上,26 ℃培养2周后,用接种针刮取菌体到PBS缓冲液中,制备菌悬液,血球计数板调整菌悬液的分生孢子浓度为 1×107CFU/mL,4 ℃冰箱保存备用。
1.3.3 细胞和F.monophora共培养和观察 实验分为3组:PBS对照组、色素株组和白化株组。待接种到细胞培养板的细胞完全贴壁后,按细胞∶孢子为1 ∶5、1 ∶10、1 ∶20的比例,每孔加入提前配制好的菌悬液 100 μL,在含 5% CO2、37 ℃培养箱中继续培养24 h,在倒置显微镜下观察细胞和F.monophora的变化并拍照记录。
1.3.4 蛋白提取和Western blot 吸除24孔板中的培养液,加入100 μL的RIPA裂解液,裂解细胞后,取10 μL样品进行BCA的检测,按照BCA蛋白定量说明书操作,加入loading buffer后,每个样品取20 μg蛋白上样至配制好的1% SDS-PAGE胶中,然后进行电泳,先用80 v,30 min,使各样本处于同一水平,待marker开始分离后,将电压调至120 v,1 h。然后进行常规转膜,200 mA,1 h,再封闭和孵育一抗(PARP-1和GADPH),一抗4 ℃孵育过夜,室温孵育二抗1 h后显影。
1.3.5 总RNA 提取、逆转录及定量PCR 采用常规trizol提取法进行总RNA提取。逆转录及定量 PCR 反应操作均依据试剂的说明书进行。反应条件为:95 ℃预变性 1 min;95 ℃变性 30 s,60 ℃扩增30 s 并采集荧光信号,72 ℃延伸1 min,40个循环,72 ℃最后延伸5 min。引物由北京睿博兴科生物技术有限公司合成(表1)。
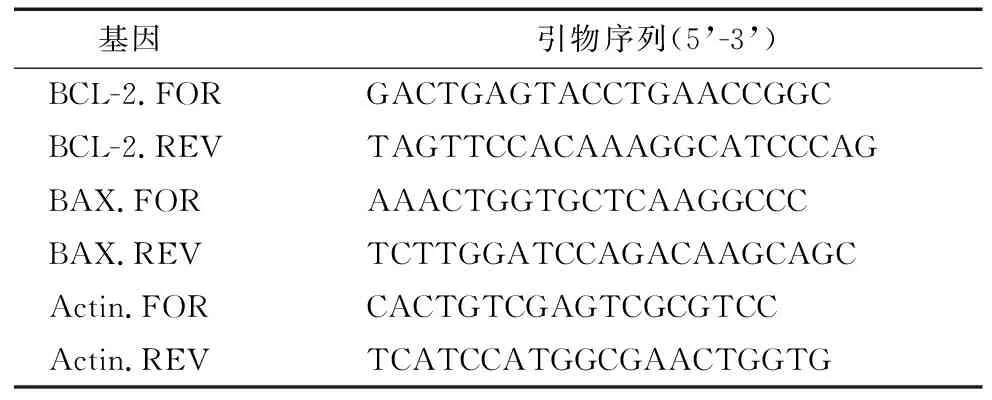
表1 实时荧光定量PCR引物序列Table 1 Real-time PCR primer sequences
1.3.6 细胞免疫荧光 按照凋亡检测试剂盒说明书操作,吸除24孔板中的培养液,用PBS洗涤细胞1次;加入250 μL的检测工作液,孵育5 min后,在荧光显微镜下观察荧光染色效果,并且拍照记录,注意整个过程均需注意避光操作。
1.4 统计学处理
数据采用SPSS 22.0进行统计分析,组间实时定量PCR结果比较使用t检验,对巨噬细胞的影响采用单因素方差分析进行统计,P<0.05为差异有统计学意义。
2 结果
2.1 F.monophora不同菌株对巨噬细胞形态的影响
色素株和白化株与巨噬细胞共培养24 h后,可发现孢子附着在巨噬细胞上;色素株和白化株的孢子由于粘连在一起,成团状,体积较大,均不能被有效吞噬;孢子量加入越多,色素株组存活的贴壁巨噬细胞越少,而白化株组巨噬细胞无明显变化(图1)。

图1 F.monophora不同菌株与巨噬细胞共培养图(400×)Figure 1 Co-culture of different strains of F.monophora and macrophages (400×).
2.2 F.monophora色素株对巨噬细胞PARP-1、BCL-2、BAX表达的影响
在不同的细胞与孢子的比例下,F.monophora不同菌株与巨噬细胞共培养24 h后,如图2所示,随着色素株的孢子浓度增多,PARP-1被剪切得更多,浓度1 ∶20与1 ∶5的相比,1 ∶20的PARP-1被完全剪切,无完整条带,而1 ∶5组与PBS组对比,虽然具有分子量更小的被剪切的条带,但明显还有尚未被剪切的PARP-1条带,说明色素株的孢子浓度越大,PARP-1越容易被剪切,凋亡的细胞越多。而白化株与PBS处理组一样,不同孢子浓度下,PARP-1均无明显被剪切。巨噬细胞与F.monophora不同菌株在细胞与孢子比例为1 ∶10时共培养24 h,实时定量PCR检测BCL-2、BAX的表达,结果发现,与白化株相比,色素株能明显降低BCL-2/BAX的比值(t=3.20,P=0.033),而白化株与PBS处理组相比无明显差异(t=0.66,P=0.540),说明色素株能明显引起巨噬细胞的凋亡,与Western blot检测结果一致。

图2 F.monophora不同菌株对巨噬细胞PARP-1、BCL-2、BAX基因表达的影响Figure 2 The effects of different strains of F.monophora on the gene expression of PARP-1, BCL-2 and BAX in macrophages.
2.3 F.monophora色素株对巨噬细胞凋亡的影响
各菌与巨噬细胞共培养24 h后,免疫荧光检测Annexin V FITC的阳性细胞,每组统计300个细胞,计算阳性率,阳性即为凋亡细胞。如图3所示,随着时间的延长,色素株组凋亡细胞明显增多,4 h组与8 h组相比,F=82.01。4 h色素株组与8 h组相比,MOI为1 ∶5时,P=0.001;MOI为1 ∶10时,P=0.003;MOI为1 ∶20时,P<0.01。不同剂量组比较,4 h组,F=62.58,色素株MOI 1 ∶5组与MOI 1 ∶10组相比,P=0.006;MOI 1 ∶10与MOI 1 ∶20组相比,P=0.003。在8 h组,F=254.6,色素株MOI 1 ∶5组与MOI 1 ∶10组相比,P=0.004,MOI 1 ∶10组与MOI 1 ∶20组相比,P<0.01,可见其呈剂量依赖。而白化株无论剂量多少均与PBS处理组一样,组间无统计学差异(4 h组,F=2.93;8 h组,F=0.89,均P>0.05)。

图3 F.monophora不同菌株对巨噬细胞凋亡的影响Figure 3 Effects of different strains of F.monophora on apoptosis of macrophages.
3 讨论
CBM大多是病原体经伤口感染进入皮下定植,并转化成寄生态的硬壳小体形成,引起肉芽肿和化脓性感染。本研究使用的是一株F.monophora突变株 CBS122845,菌落形态为煤渣样,产生大量的黑素,显微观察为酵母状的砖格样细胞,没有菌丝形态[9]。该菌株经过多次传代,获得了白化突变株 CBS125149,细胞壁无黑素。小鼠感染模型已证实,色素株较白化株引起的感染性肉芽肿更严重,并且持续时间更长[10]。表明黑素为F.monophora抵抗宿主免疫细胞的重要毒力因子。目前,F.monophora与宿主之间的发病机制和早期与宿主的相互作用机制知之甚少。已有研究证实F.monophora促进促炎细胞因子的表达并抑制抗炎细胞因子的表达,促进 THP-1向经典活化型(M1型)巨噬细胞极化[11]。F.monophora感染巨噬细胞的转录谱分析研究表明黑素影响巨噬细胞基因的表达,差异表达基因的生物学功能与免疫反应密切相关,黑素可能通过调节巨噬细胞的MAPK信号通路影响相互作用[12]。但其如何影响宿主的免疫细胞,如何影响先天免疫调节的机制尚不明确。
众所周知,细胞程序性死亡(apoptosis)是一种参与先天免疫调节的机制[13]。细胞凋亡发生过程受多基因的调控,由多种促凋亡和抗凋亡的蛋白相互作用,两者比例失衡,导致细胞凋亡的发生。BCL-2在急性淋巴细胞白血病中被发现[14],后来被证实可以保护细胞免于程序性细胞死亡[15],是一种重要的抗凋亡蛋白。BCL-2相关的X蛋白(BAX)被鉴定为BCL-2的同源结合伴侣,作用与BCL-2相反,是促进细胞凋亡的蛋白[16]。两者比值是凋亡走向的标志,比值升高抑制凋亡,比值降低促进凋亡。本实验结果表明,在不被吞噬的情况下,F.monophora色素株下调巨噬细胞BCL-2与BAX的比值,最终增加巨噬细胞的凋亡比例。PARP-1是定位在细胞核内,与应激条件下 DNA修复密切相关的一种酶。 PARP-1对于细胞的稳定和存活非常重要,PARP-1失去酶活力会加速细胞的不稳定。Caspase介导的细胞凋亡通过裂解细胞功能和存活所需的几种关键蛋白来实现[17]。PARP-1是几种已知的半胱天冬酶底物之一。半胱天冬酶对PARP-1的裂解被认为是细胞凋亡的标志[18]。本实验结果表明,F.monophora色素株在刺激巨噬细胞时,随着剂量的增加,能明显剪切PARP-1,使巨噬细胞的凋亡比例增多。
综上所述,F.monophora色素株可在胞外通过下调BCL-2/BAX的比值,剪切PARP-1,进而促进巨噬细胞的凋亡发生。推测F.monophora色素株可能通过促进巨噬细胞凋亡,来抵抗巨噬细胞的免疫杀伤作用,创造有利于免疫逃逸的条件,从而导致疾病的发生发展。

