不冻液冻结对鳙鱼头冻藏品质的影响研究
骆文燕徐梦意徐 霞张振宇周绪霞何光喜姚洪正刘书来
(1.浙江工业大学 食品科学与工程学院,浙江 杭州 310014;2.浙江省深蓝渔业资源高效开发利用重点实验室,浙江 杭州 310014;3.国家远洋水产品加工技术研发分中心(杭州),浙江 杭州 310014;4.杭州千岛湖发展集团有限公司,浙江 杭州 310014)
不冻液冻结又称浸渍冻结,是利用载冷剂与食品直接或间接接触,实现食品快速降温的一种高效的冷冻方式[1]。目前,不冻液冻结中所用的载冷剂主要包括盐类(氯化钠、氯化钙)、醇类(乙醇、乙二醇、丙二醇、丙三醇等)和糖类(蔗糖、玉米糖浆、葡萄糖、果糖等)。根据载冷剂的种类,可分为二元、三元和四元载冷剂,已被广泛应用于水果、蔬菜、肉类和水产品的冻结保鲜。与其他冷冻方式相比,不冻液冻结具有较多优点:第一,不冻液冻结的冻结速率快,常温下大部分液体的导热系数为0.116~0.628 W/(m·K)[2]。Yamada[3]将猪肉进行不冻液冻结和鼓风冻结,发现从室温到完全冻结,用鼓风式冻结所需时间为24 h,浸渍于-30~-50 ℃乙醇溶液中需要的时间仅为1.5~2 h。第二,不冻液冻结能耗低,可降低生产成本。Shaikh等[4]认为直接不冻液冻结的成本是机械制冷成本的1/4。不冻液冻结方式应用的载冷剂导热系数大,-21.5 ℃的乙醇、氯化钠与水构成的载冷剂中,其传热效率为700 W/m2K,不需要借助传统空气冻结中的冷空气降温,成本更低。第三,冻结产品品质较高。与将冻结原料置于低温金属冻结板之间进行热交换的间接接触式平板冻结技术[5]相比,不冻液快速冻结具有更高的传热系数,冻结产品冰晶较小,对细胞组织损伤较小。邓敏等[6]将传统空气鼓风冻结与不冻液冻结进行比较,研究草鱼块冻藏过程中品质的变化,结果表明:直接浸渍冻结的冻结速率较快,冻藏过程中蛋白变性、汁液流失率均低于鼓风冻结。
千岛湖盛产的千岛湖鱼头体积较大,味道鲜美,多不饱和脂肪酸EPA、DHA及必需氨基酸含量高,虽然能满足消费者的营养及保健需求,但是,宰杀后的新鲜鱼头会在微生物和酶的作用下发生复杂的生化反应而导致品质快速下降。低温保鲜技术能有效抑制微生物的生长,降低各种生化反应的速率,被广泛用于食品的长期保藏。笔者以千岛湖鳙鱼头为研究对象,采用不冻液冻结和平板冻结两种方式将鳙鱼头冻结至中心温度为-18 ℃,研究了冻藏期间鳙鱼头品质变化,包括Ca2+-ATPase活性、总巯基、TBA、TVB-N以及挥发性风味物质、核苷酸类化合物等风味物质的变化,以期为千岛湖鳙鱼头保鲜和不冻液冻结技术的应用提供理论支撑和技术指导。
1 材料与方法
1.1 材料与试剂
材料:千岛湖鳙鱼头,由千岛湖千发任天农业科技有限公司提供,平均鱼头质量(2.0±0.2) kg。流动水洗去表面沾污物,用机器对半均等切开,用聚乙烯保鲜袋包裹后置于室温备用。
实验试剂:磷酸二氢钠、5-磺基水杨酸、腺苷三磷酸二钠(ATP-Na2)等为分析纯,上海麦克林生化科技有限公司;5’-鸟苷酸(GMP)、5’-肌苷酸(IMP)、腺苷三磷酸(ATP)、腺苷二磷酸(ADP)、腺苷一磷酸(AMP)、次黄嘌呤(Hx)、次黄嘌呤核苷(HxR)标准品,Sigma公司;甲醇(GR),Merck公司。
实验室自制不冻液成分:主要由95%乙醇、乙二醇、NaCl和水等组分按照适当比例配制而成,不冻液冻结点约-48.2 ℃,各组分均为食品级。
1.2 仪器与设备
K9840自动式凯氏定氮仪,济南市海能仪器股份公司;E2695型高效液相色谱仪,美国Waters公司;Biochrom 30+氨基酸自动分析仪,美国Aglient公司;7890A-5975C GC-MS联用仪,美国Aglient公司。
1.3 实验方法
1.3.1 千岛湖鳙鱼头样品制备
取一批大小质量相似且已对半切开的新鲜千岛湖鳙鱼头,将温度计探头固定至几何中心位置,套入保鲜袋中,分别通过不冻液和平板冻结方式进行冻结,冻结温度均为-40 ℃,冻至中心温度为-18 ℃后进行真空包装,然后置于-18 ℃中环境中冻藏9个月。期间定期取样,于4 ℃冰柜中解冻16 h后分析各指标。
1.3.2 Ca2+-ATPase活性测定
Ca2+-ATPase活性测定采用2~5 mg/mL肌原纤维蛋白。将2.5 mL 20 mmol/L Tris-HCl、1 mL 0.05 mol/L CaCl2、1 mL 4 mol/L氯化钾、1.5 mL 6.67 mmol/L ATP-Na2和4 mL肌原纤维蛋白酶液加入试管中,保持在28 ℃水浴30 min,加入肌原纤维蛋白酶液开始反应,反应体积为10 mL,最后,加入1 mL质量分数为15%的三氯乙酸,结束反应。反应终止后并用滤纸过滤,滤液体积恒定为100 mL。采用钼酸铵法[7]在640 nm下测量吸光值。
肌原纤维Ca2+-ATPase活性以每分钟每毫克肌原纤维蛋白所释放的无机磷的量表示,酶活性计算式为
Ca2+-ATPase=x/(t×c)
(1)
式中:x为1 mL反应液生成的磷酸量,mmol;t为反应所需要时间,min;c为酶蛋白质量,mg。
1.3.3 总巯基质量分数测定
总巯基质量分数测定采用Kobayashi[8]方法,并稍作修改。具体操作如下:取0.5 mL 4 mg/mL肌原纤维蛋白溶液,加入4.5 mL 0.2 mol/L Tris缓冲溶液中(pH 6.8)。取4.0 mL混合液,加入0.5 mL 0.2 mol/L Tris缓冲溶液(pH 8),于40 ℃下温育25 min,在412 nm下测量其吸光值。
1.3.4 TBA质量分数测定
称取剪碎鱼肉5 g,加入50 mL三氯乙酸混合液,50 ℃恒温振荡30 min,取出冷却至室温过滤。取上述滤液和标准系列溶液各5 mL,另取5 mL三氯乙酸混合液作为样片空白,分别加入5 mL硫代巴比妥酸水溶液置于90 ℃水浴反应30 min,再冷却至室温,然后在532 nm波长处测定吸光值。测定方法参照标准GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》。
1.3.5 TVB-N质量分数测定
称取10 g解冻后鱼肉加90 mL 0.6 mol/L高氯酸匀浆,4 ℃下抽提30 min后过滤。取滤液,测定方法参照标准GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》。
1.3.6 核苷酸类化合物测定
核苷酸类化合物测定采用Veciana-Nogues等[9]的方法,并稍作修改。具体操作如下:将冻结3个月的鱼头解冻后,准确称取5 g鱼肉样品于250 mL烧杯中,加入50 mL 1.2 mol/L 4 ℃萃取预冷的HClO4溶液匀浆2 min,4 ℃下静置30 min,在3 000g(4 ℃)下离心20 min,收集上清液。残渣加入30 mL 0.6 mol/L HClO4溶液,按上述方法离心,合并2次上清液,用10 mol/L KOH溶液中和至pH 6.5后过滤,滤液用蒸馏水定容至100 mL。经孔径为0.45 mm的水系滤膜过后进液相色谱分析。
液相色谱条件如下,色谱柱:Xbridge C18色谱柱(4.6 mm×250 mm,5 mm);流动相:0.1 mol/L磷酸盐缓冲液pH 7,流速0.75 mL/min,检测波长254 nm,柱温30 ℃,进样量10 mL。
K值计算式为
K=[(HxR+Hx)/(ATP+ADP+AMP+
IMP+HxR+Hx)]×100%
(2)
1.3.7 挥发性风味物质测定
采用固相微萃取-气相色谱-质谱联用分析(SPME-GC-MS)测定鳙鱼头的挥发性风味物质。SPME条件:取鱼头解冻后,搅碎后取碎鱼肉6 g于15 mL顶空样品瓶中。将65 mm DVB -PDMS萃取头插入样品瓶顶空部位,60 ℃平衡20 min,顶空萃取30 min后取出萃取头,迅速用气质联用仪进行分析鉴定。
GC-MS分析条件如下:色谱柱,DB-5MS弹性毛细管柱(60 m×0.32 mm×1 mm);起始温度40 ℃,以5 ℃/min的速度升至100 ℃;以2 ℃/min的速度升至180 ℃;以5 ℃/min的速度升至240 ℃,保留5 min;氦气流量为1.2 mL/min,进样口的温度为250 ℃。电子轰击离子源:传输线的温度为240 ℃,电子能为70 eV,离子源温度为220 ℃,质量扫描范围为35~450 Da。
1.4 数据处理
数据结果采用软件SPSS 12.0和Origin 8.6进行分析。结果以平均值±标准差形式表示。不相同样品间的比较方法采用最小显著差异法,取95%置信度(P<0.05)。
2 结果与分析
2.1 冻藏期间鳙鱼头Ca2+-ATPase活性变化
Ca2+-ATPase活性与肌球蛋白的球状头部区域密切相关。冻藏期间鳙鱼头Ca2+-ATPase活性变化如图1所示。由图1可知:冻藏期间鳙鱼头Ca2+-ATPase活性呈不同程度的降低趋势;两种冻结方式在前180 d均有显著性差异(P<0.05),随后两组的Ca2+-ATPase活性趋于平缓。在冻藏270 d时,不冻液冻结和平板冻结的千岛湖鱼头Ca2+-ATPase活性分别为0.145,0.116 μmol/(mg·min),无显著性差异(P>0.05)。这与高琪等[10]研究鳙鱼头在贮藏期间Ca2+-ATPase活性变化趋势一致。Ca2+-ATPase活性越低,蛋白变性就越严重[11],在整个冻藏期间,不冻液冻结组的千岛湖鱼头Ca2+-ATPase活性始终高于平板冻结组,说明不冻液冻结的鳙鱼头的新鲜度品质保持较好。
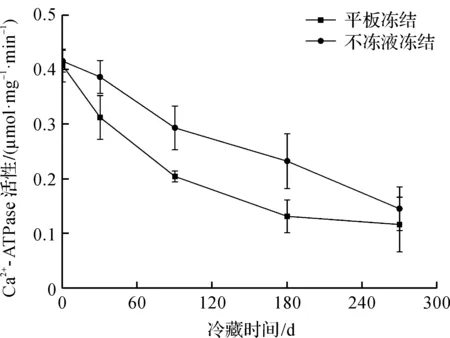
图1 冻藏期间鳙鱼头Ca2+-ATPase活性变化Fig.1 Changes of Ca2+-ATPase activity in bighead carp head during frozen storage
2.2 冻藏期间鳙鱼头总巯基质量分数变化
总巯基质量分数可以表征蛋白质的变性和聚合程度[12-13]。钱攀等[14]在研究不同冻结温度对鳙鱼品质的影响时发现:冻结速率越快,冻藏期间鱼肉中总巯基质量分数下降越缓慢,蛋白变性也越小。冻藏期间鳙鱼头总巯基质量分数变化如图2所示。由图2可知:随着冻藏时间的延长,不同冻结方式下鱼肉蛋白总巯基质量分数均呈下降趋势,两者之间有显著性差异(P<0.05),不冻液冻结鱼头的总巯基质量分数始终高于平板冻结。冻藏270 d后,不冻液冻结和平板冻结的鱼头总巯基质量分数分别下降了42.6%和73.7%,并且不冻液冻结鱼头总巯基质量分数始终高于平板冻结,说明不冻液冻结方式速率较快,其能抑制巯基的氧化过程、二硫键的互换作用以及蛋白质的交联作用,使蛋白质变性程度越低。
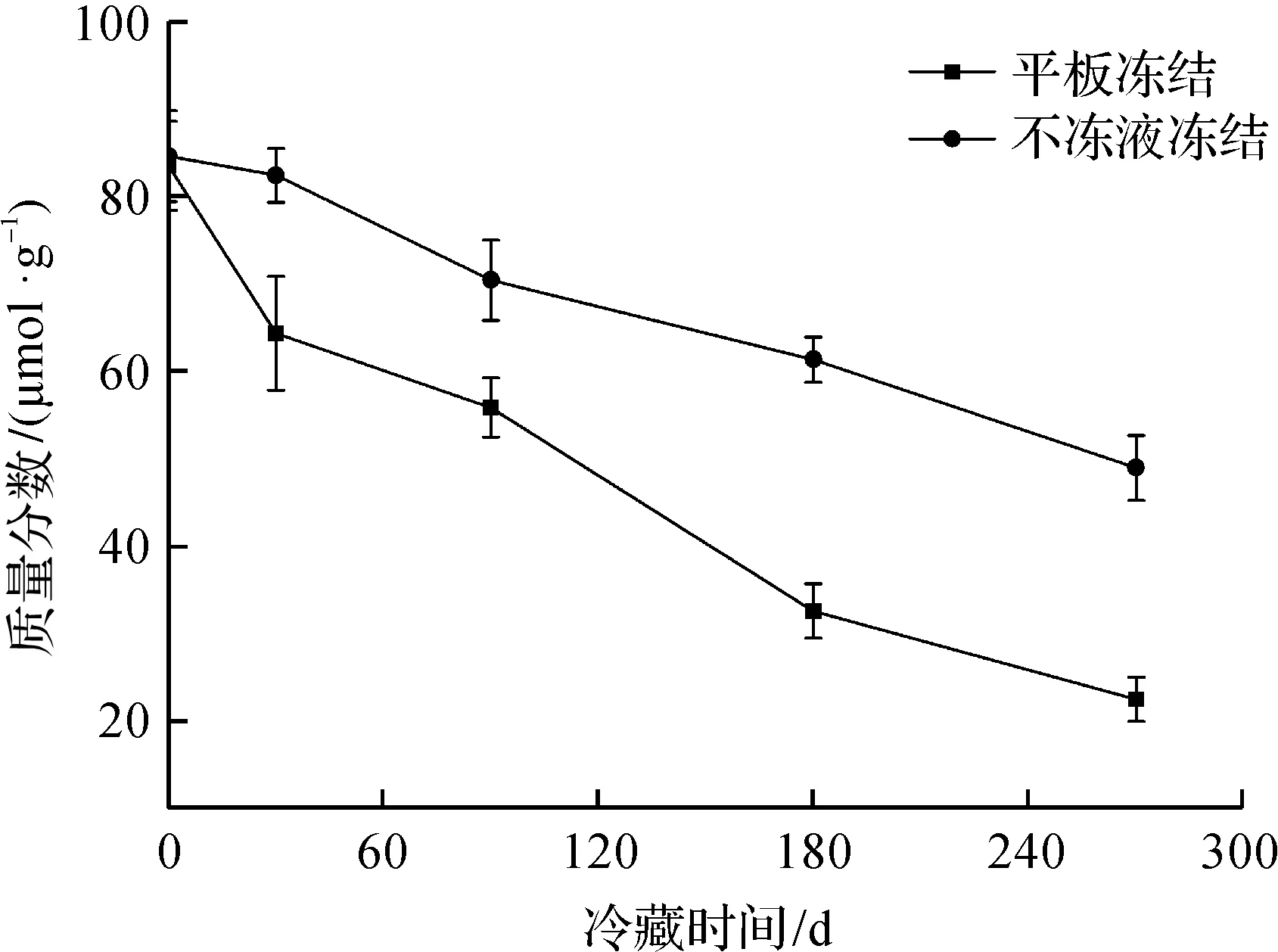
图2 冻藏期间鳙鱼头总巯基质量分数变化Fig.2 Changes of total sulfhydryl content in bighead carp head during frozen storage
2.3 冻藏期间鳙鱼头TBA质量分数变化
TBA质量分数能反映冻藏过程中千岛湖鱼头脂肪氧化程度。Hong等[15]研究了不同冷冻方式对鳙鱼品质的影响,表明冻结速率越快,其冻藏期间TBA质量分数上升越缓慢。冻藏期间鳙鱼头TBA质量分数变化如图3所示。由图3可知:冻藏期间不冻液冻结和平板冻结的鱼头TBA质量分数均呈上升趋势,且不冻液冻结鱼头TBA质量分数始终低于平板冻结。冻藏的前90 d,两组冻结鱼头的TBA质量分数差异不明显(P>0.05),但冻藏至270 d时,平板冻结和不冻液冻结鱼头的TBA质量分数由初始的MDA 0.312 mg/kg分别增加至0.645,0.529 mg/kg,即为新鲜鱼头的2.06倍和1.69倍。这可能是由于不同冻结速率形成的冰晶粒径对鱼肉组织细胞产生的机械损伤程度不一所致,鱼体肌肉蛋白质变性对肌间脂肪的游离与冻藏期间的干耗在一定程度上会影响氧的接触和氧化。由此可知:不冻液冻结形成的冰晶较小,对细胞损伤小,原有的产品品质保持也越好。
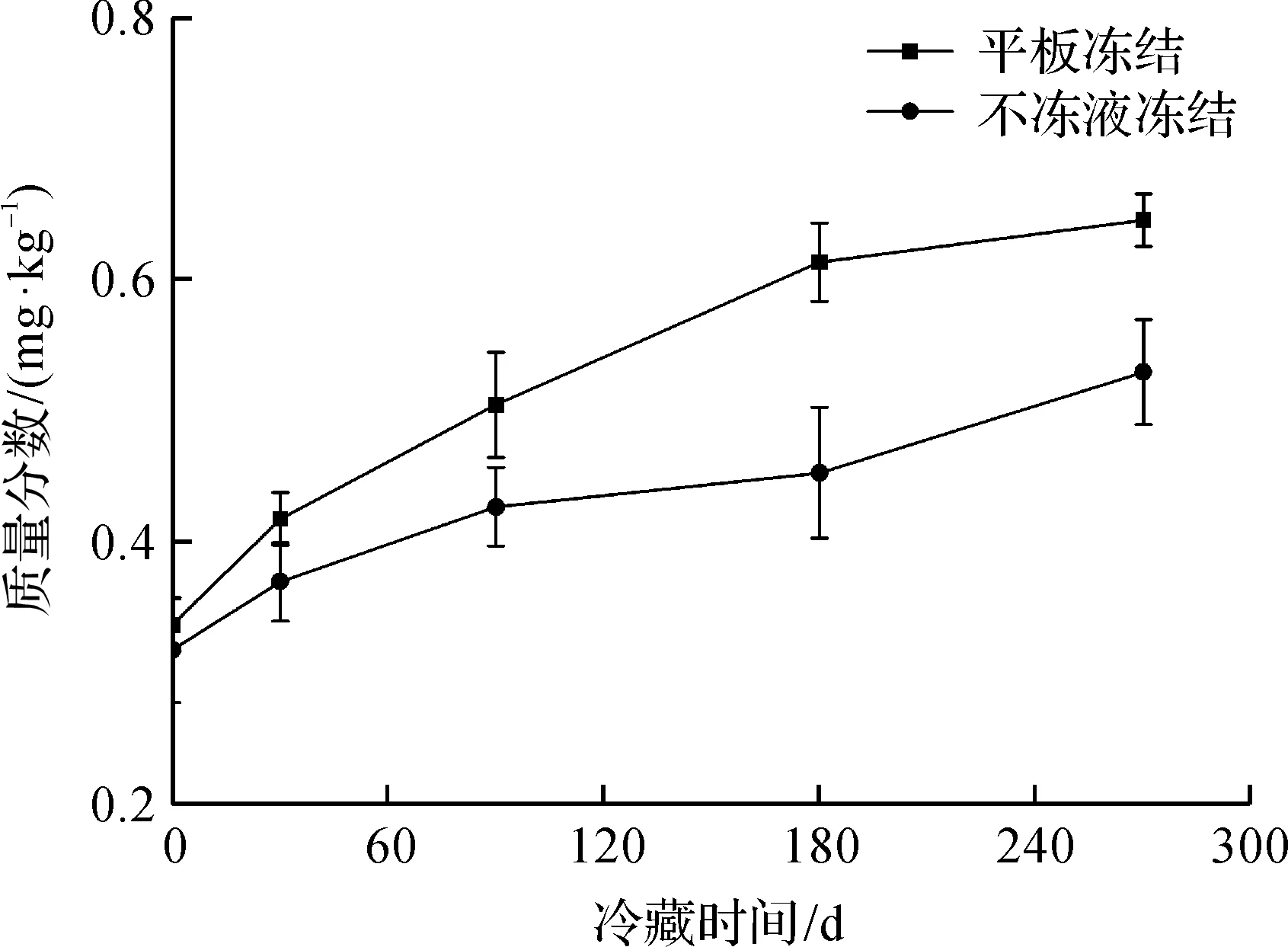
图3 冻藏期间鳙鱼头TBA质量分数变化Fig.3 Changes of TBA values in bighead carp head during frozen storage
2.4 冻藏期间鳙鱼头TVB-N质量分数变化
TVB-N是指动物性食品在其肌肉中内源酶或细菌作用下,蛋白质分解产生的氨、胺类等碱性含氮挥发性物质,是评价水产品鲜度的重要指标。冻藏期间鳙鱼头TVB-N质量分数变化如图4所示。由图4可知:平板冻结和不冻液冻结的鱼头贮藏期间的TVB-N质量分数均呈上升趋势,并且平板冻结鱼头的上升的速率明显高于不冻液冻结的上升的速率。冻藏初期,平板冻结和不冻液冻结鱼头的TVB-N质量分数分别为49.2 μg/g和42.8 μg/g;冻藏时间至270 d时,平板冻结下鱼肉TVB-N质量分数为211.4 μg/g,已超过淡水鱼的食品卫生标准GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》限量规定(200 μg/g)。而不冻液冻结的千岛湖鱼头TVB-N质量分数152.9 μg/g,依旧比淡水鱼的标准水平低。究其原因,一是不冻液冻结方式的冻结的速度快,降低了鱼肉中蛋白质的分解速度;二是不冻液冻结鱼肉细胞生成的冰晶较小,组织细胞被破坏的程度较小,其原有品质保持也越好。
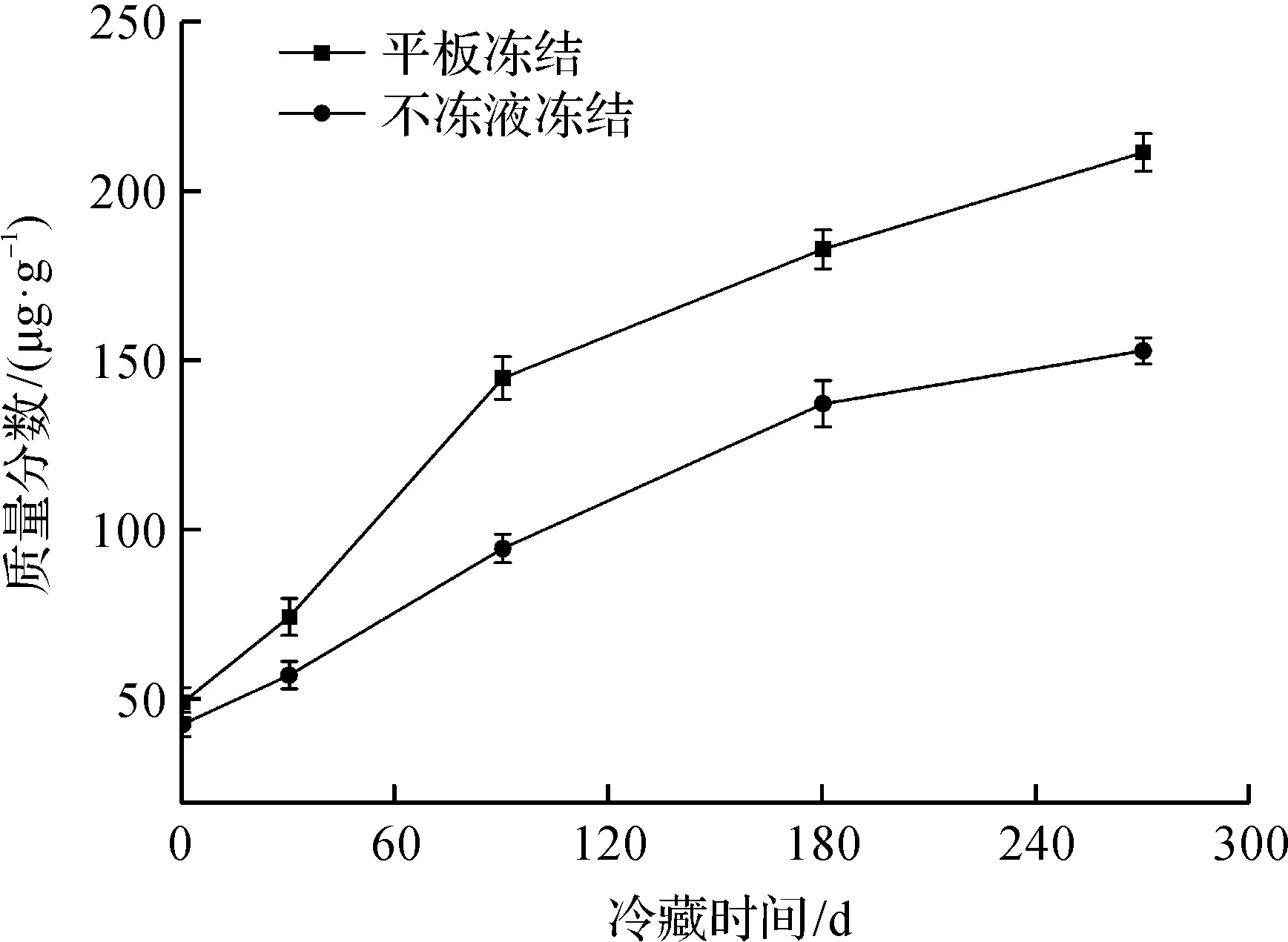
图4 冻藏期间鳙鱼头TVB-N质量分数变化Fig.4 Changes of TVB-N values in bighead carp head during frozen storage
2.5 鳙鱼头中核苷酸类物质质量浓度及K值变化
鱼类死后,肌肉中ATP降解途径中依次生成ADP,AMP,HxR,Hx[15]。呈味核苷酸GMP和IMP阈值分别为125,250 μg/mL,是鳙鱼头中主要的滋味物质,不同冻结方式对千岛湖鱼头核苷酸含量的影响如表1所示。由表1可知:在冻藏期间GMP和IMP含量下降,平板冻结下降速度高于不冻液冻结,鲜味较差。新鲜鱼头中ATP质量浓度为1 108.4 μg/mL,冻藏期间其含量迅速下降,说明ATP在鱼肉死亡后积累周期极短,这可能是因为冻结和冻藏过程中形成了大量冰晶体,破坏了细胞表面结构,使酶和无机盐浓度上升,从而使ATP降解反应速度加快[16]。新鲜鱼肉中Hx 104.9 μg/mL,冻藏过程中其含量显著上升;平板冻结和不冻液冻结的鱼头冻藏3个月后Hx质量浓度分别增加至802.6,504.5 μg/mL。K值反映了鱼类死亡后从肌肉僵直阶段至自溶阶段的鲜度变化[17],是评定鱼类鲜度的重要指标,K值越大表明水产品越不新鲜,品质降低[18]。笔者研究中新鲜样鱼头的K值为6.09%,平板冻结和不冻液冻结3个月后鱼头的K值分别为43.82%和22.7%,平板冻结的鱼头新鲜度较差,这和TVB-N等其他指标变化规律一致。
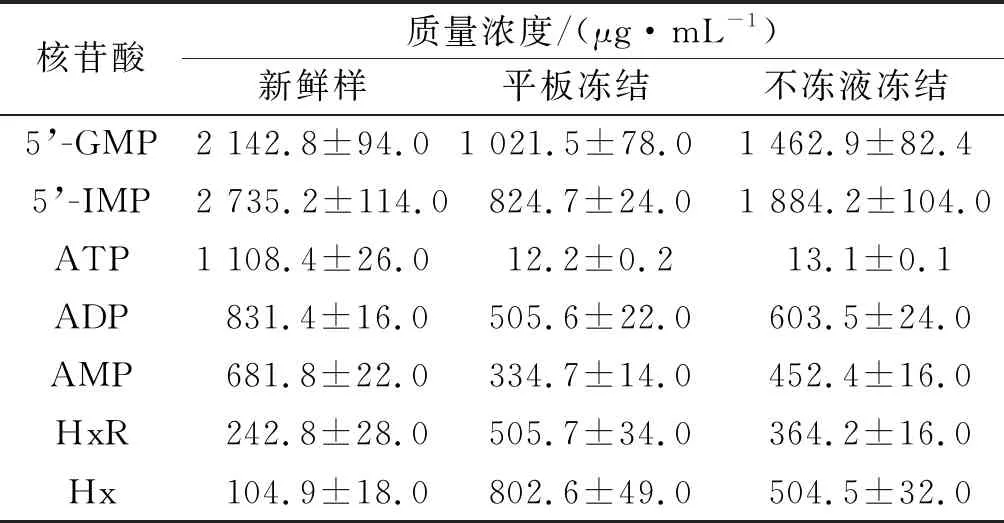
表1 不同冻结方式对千岛湖鱼头核苷酸质量浓度的影响
2.6 鳙鱼头的挥发性风味物质分析
鳙鱼头中挥发性风味物质,经SPME-GC-MS检测分析结果如表2所示。与新鲜鱼头相比,冻藏3个月后两种冻结方式处理的鱼头中挥发性风味物质种类和质量浓度均有不同程度的下降。平板冻结鳙鱼头的醛类中呈腥味物质的质量分数明显上升,酮类和烷烃类物质下降明显,产生不愉快的气味,品质较差。鳙鱼头中挥发性风味物质的质量分数如图5所示。
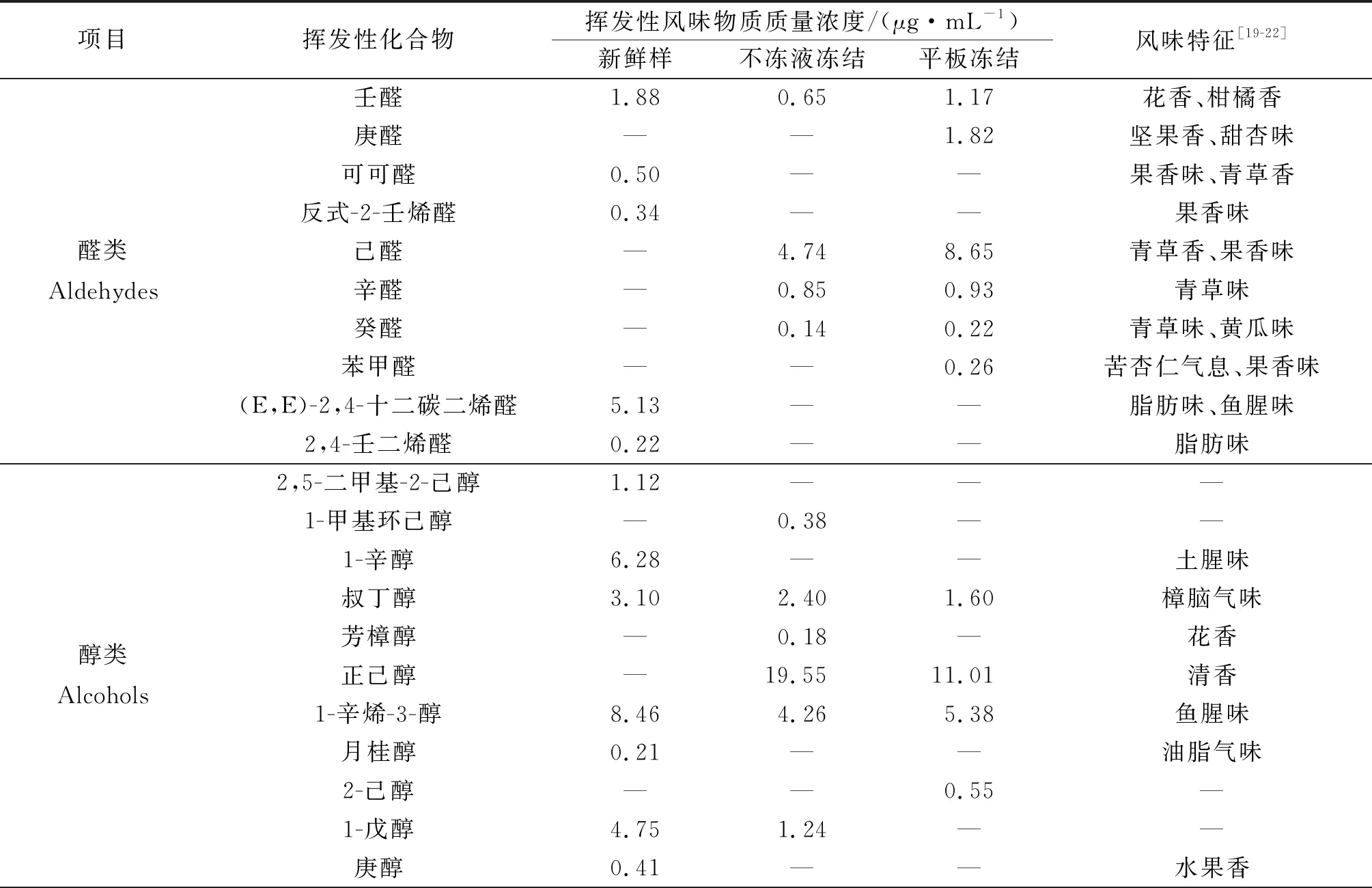
表2 鳙鱼头中挥发性风味物质组成及其相对质量浓度Table 2 The composition and relative content of volatile flavor components in bighead carp head
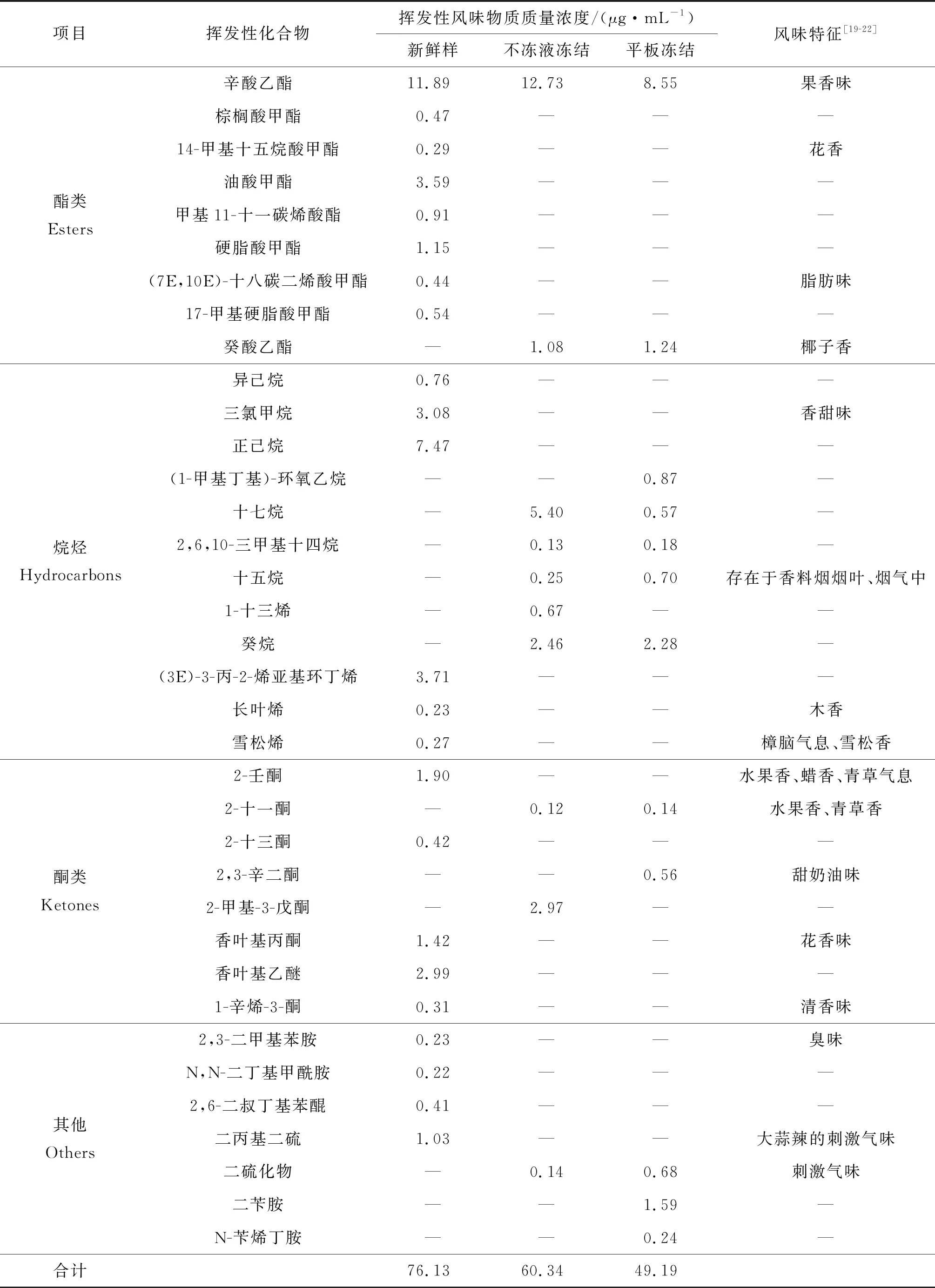
表2 (续)
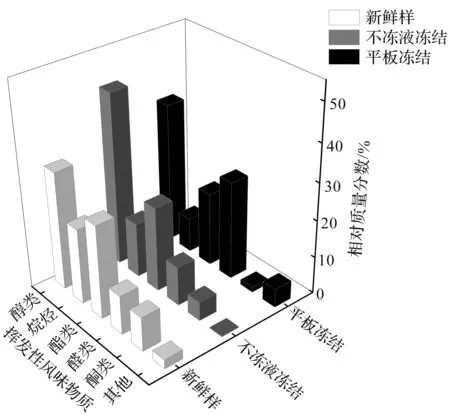
图5 千岛湖鱼头中挥发性风味物质质量分数Fig.5 Percentage of volatile flavor substances in bighead
醛类物质一般被认为是脂类的热降解产物,阈值较低,因此较低质量分数即对鱼肉风味有很大贡献。新鲜样鱼头中检测到的可可醛和2,4-壬二烯醛具有果香味,阈值低,而壬醛质量分数为1.1 μg/kg,是鱼肉产生不愉快土腥味来源之一。冻藏3个月后,产生刺激性气味的醛类物质增加,略高于己醛质量分数(4.5 μg/kg),具有鱼腥味、青草味等风味,可能由n-6不饱和脂肪酸的氧化产生,这是贮藏期间鱼肉形成腥味的主要前体物质[23]。
醇类物质由脂质氧化分解生成。1-辛烯-3-醇质量分数为1.5 mg/kg,常存在于淡水鱼和海水鱼的挥发性风味物质中。施文正[24]研究发现草鱼背部肉中1-辛烯-3-醇质量分数达到20%以上。1-辛醇被认为与新鲜淡水鱼植物青草味有关,庚醇具有酒香味。
酯类是酸和醇酯化且缩合而成,是赋予肉制品特征香味的重要物质[25]。在新鲜鳙鱼头中共检测出8种酯类物质,冻藏期间酯类挥发性物质种类和含量的大量减少可能是造成鳙鱼头风味品质下降的重要原因。
烷烃类是由脂肪酸的烷氧自由基均裂而得的[26],阈值较高,一般认为对风味形成的贡献不大。正己烷具有清新味,在新鲜鱼肉中检测最多。烯烃、炔烃类还可进一步氧化,生成酮、醛类化合物,是风味物的潜在前体。
酮类通常由多不饱和脂肪酸的热氧化或氨基酸的降解而成,对腥味有一定增强作用[27],但其阈值高,一般认为它们对气味特征贡献较小。新鲜鱼头中共检测出5种酮类物质,其中具有清香味的香叶基乙醚较多,冻结3个月后鱼头中酮类物质减少至2种。
3 结 论
笔者以千岛湖鳙鱼头为研究对象,分别采用不冻液冻结和平板冻结技术将鳙鱼头冻结至中心温度为-18 ℃,研究了鳙鱼头冻藏期间Ca2+-ATPase活性、总巯基质量分数、TBA质量分数、TVB-N质量分数、核苷酸类化合物和挥发性风味物质等指标的变化规律。实验结果表明:冻藏期间鳙鱼头Ca2+-ATPase活性和总巯基质量分数均呈逐渐降低趋势,TBA质量分数和TVB-N质量分数则逐渐上升,不冻液冻结后的千岛湖鳙鱼头冻藏期间各项指标均优于平板冻结。由千岛湖鳙鱼头中呈味核苷酸类化合物的HPLC测定结果可知:GMP和IMP是鱼头中最主要的呈味核苷酸,平板冻结的鳙鱼头冻藏3个月后K值高于不冻液冻结。冻藏期间鳙鱼头酯类和烷烃类物质显著下降,其中平板冻结鳙鱼头冻藏3个月后刺激性的醛类等物质增加,说明风味较差,品质下降较快。研究不冻液冻结技术对鱼肉蛋白结构、鲜度和风味的影响,有助于从理论和生产实践两个方面来推进不冻液冻结技术的推广与应用。

