辣蓼黄酮提取物的急性毒性和亚慢性毒性研究
张 文,覃志彪,成 静,于美玲,韦英益,黎 江,胡庭俊
(广西大学动物科学技术学院,南宁 530005)
辣蓼来源于蓼科蓼属植物辣蓼及水蓼的全草,广泛分布于广西、广东、四川等地[1-3]。研究发现,辣蓼富含有机酸、黄酮类和萜类等化学成分,具有抗炎、抗菌、抗病毒、抗氧化等功效[4-7]。相关研究还发现,黄酮类化合物能有效增强动物的免疫功能,将辣蓼黄酮作为饲料添加剂应用于畜牧水产方面对其疾病防控和健康生态养殖具有十分重要的意义[8]。大量临床应用表明,辣蓼具有抗癌和抗肿瘤、镇痛止血等多种生物活性[9-11],且随着国内外对其研究的逐步深入,发现辣蓼除了上述活性之外,还有许多值得进一步研究的功效。
为了将辣蓼黄酮提取物作为一种新型饲料添加剂,保证其安全性,本研究采取灌胃给药的方式进行小鼠急性毒性试验,对辣蓼黄酮提取物的毒性进行初步判断。通过其试验结果筛选出不同浓度的辣蓼黄酮提取物添加到饲料中,监测大鼠的临床体征、饮水量、采食量、体重、血常规指标、血液生化指标及病理组织学变化以考察辣蓼黄酮提取物是否具有明显或潜在的毒副作用,评价其安全性,旨在为辣蓼黄酮提取物临床使用剂量及更广泛的应用提供科学依据。
1 材料与方法
1.1 试验药物
辣蓼黄酮提取物由广西大学动物科学技术学院制备。辣蓼黄酮的含量为65.37 mg/g,其中芦丁含量为12.91 mg/g,槲皮苷含量为52.46 mg/g。
1.2 试验动物
8周龄SPF级昆明小鼠,雌雄各半,体重为 18~22 g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2016-0002;4周龄SPF级SD大鼠,雌雄各半,体重为(100±20) g,购自广西医科大学实验动物中心,实验动物生产许可证号:SCXK (桂)2019-0003。
1.3 主要仪器
生物组织石蜡包埋机(YB-6LF)和生物组织自动脱水机(ZT-12M)均购自孝感市亚光医用电子技术有限公司;分析天平(EL204)购自Metteler-TOledo公司;全自动生化分析仪(Hitachi-7180)和全自动血液分析仪(Sysmex-2100)均购自希森美康医用电子(上海)有限公司;电热恒温干燥箱(DHG-9071A)购自上海精宏实验设备有限公司;轮转式切片机(RM2245)购自徕卡显微系统贸易有限公司。
1.4 急性毒性试验
1.4.1 急性毒性试验预试验 依据《兽药急性毒性试验(LD50测定)指导原则》,将20只SPF级昆明系小鼠随机分为5组,每组4只,雌、雄各半。根据预试验给予辣蓼黄酮5 g/kg BW未见小鼠死亡,故设5个剂量组,按照5 g/kg BW的4、2、1、0.5和0.25倍设计给药剂量,则每组小鼠分别给予辣蓼黄铜提取物20、10、5、2.5和1.25 g/kg BW,隔夜空腹灌胃,24 h内分2次等容积灌胃给药,合并为单日一次剂量计算。试验期间,观察并记录小鼠死亡数、采食、饮水、健康状况等,给药后第8天,剖检观察其心脏、肝脏、脾脏、肺脏、肾脏、胸腺、卵巢、睾丸、胃和肠等是否存在异常。
1.4.2 最大给药量试验 根据急性毒性试验确定最大给药试验的剂量为30 g/kg BW,灌胃前禁食12 h,每日灌胃3次,每次每只小鼠0.2 g/1.0 mL。试验期间,观察并记录小鼠死亡数、采食、饮水、健康状况等,给药后第8天,剖检观察其心脏、肝脏、脾脏、肺脏、肾脏、胸腺、卵巢/睾丸、胃和肠等是否存在异常。
1.5 亚慢性毒性试验
1.5.1 试验分组及给药 80只SPF级SD大鼠,喂养观察 7 d并称重。利用Excel软件进行随机区组分组方法分为4组,每组 20 只,雌雄各半,雌雄分笼饲养,共8个笼。设高、中、低剂量辣蓼黄酮组(20、10和5 g/kg BW)和对照组(0 g/kg BW)。大鼠全价饲料用粉碎机粉碎,将辣蓼黄酮用药剂量按大鼠每日饲料摄入量为体重的 10% 折算后,分别按照高、中、低剂量组混入饲料,充分混匀后加适量双蒸水揉搓挤压成条状,55 ℃ 烘箱烘干;对照组饲料除不添加辣蓼黄酮外,与其他剂量组处理方式相同。连续给药 30 d 后停药,其后每组剩余大鼠喂普通全价饲料观察 7 d。
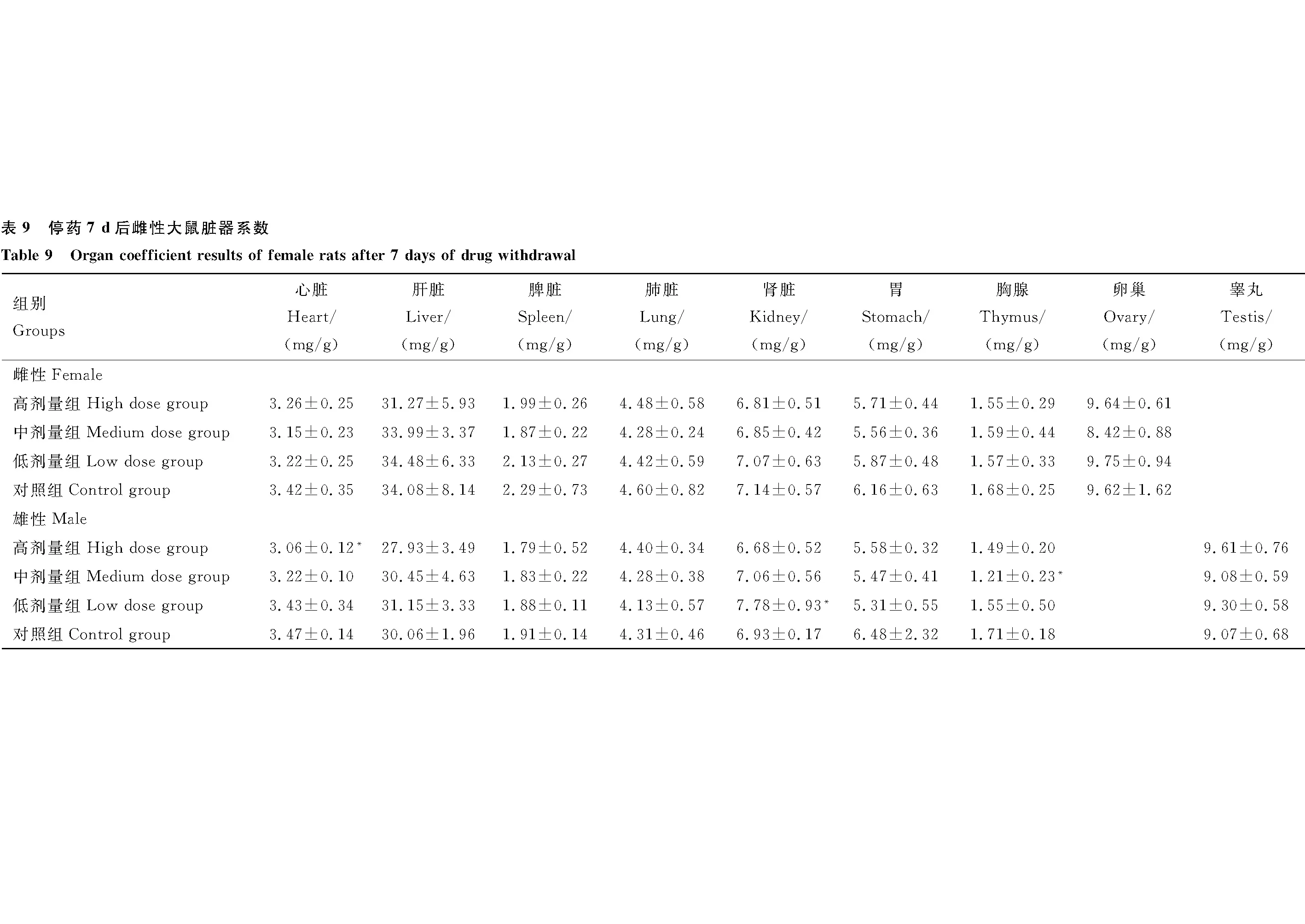
1.5.2 临床观察及检测 试验期间每天观察大鼠的一般行为表现、中毒及死亡情况,并记录大鼠的体重、摄食量和饮水量,每周称量一次体重,血常规检测项目包括白细胞(WBC)、淋巴细胞(LYMPH)、中间细胞(MID)、中性粒细胞(GRA)、红细胞(RBC)、血红蛋白(HGB)、血小板(PLT);生化指标检测包括白蛋白(ALB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(BUN)、肌酐(CREA)、球蛋白(GLB)、葡萄糖(GLU)、总胆红素(TBIL)、总胆固醇(TC)、甘油三酯(TG)、总蛋白(TP);采集心脏、肝脏、脾脏、肺脏、肾脏、胸腺、卵巢、睾丸、胃和肠等脏器称重,计算脏器系数,制作切片进行病理学检查。
脏器系数=脏器重量/体重
增重率(%)=(终末重-初始重)/初始重×100%
1.6 数据统计分析
采用 SPSS 22.0 统计学软件对数据进行One-Way ANOVA方差齐性分析,如方差分析结果P>0.05则进行单因素方差分析,如P<0.05则进行Kruskal-Wallis H检验。结果用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 急性毒性试验结果
2.1.1 急性毒性试验预试验结果 试验观察期间,未见中毒症状且小鼠全部存活,试验期间小鼠采食、排便、日常行为等未见异常。试验第 8天,剖检观察小鼠的心脏、肝脏、脾脏、肺脏、肾脏、胸腺、卵巢/睾丸、胃、肠等均没有发现异常情况,无法测出辣蓼黄酮提取物的半数致死量(LD50),说明药物安全性较高。
2.1.2 急性毒性试验最大给药量试验结果 试验期间,小鼠未出现中毒或死亡情况。小鼠采食、饮水、排便及日常活动无异常情况,被毛、可视黏膜未见异常,剖检后观察心脏、肝脏、脾脏、肺脏、肾脏、胸腺、卵巢/睾丸、胃和肠等主要脏器无肉眼可见病变。
2.2 亚慢性毒性试验结果
2.2.1 一般观察 试验期间,各组大鼠未见死亡情况。大鼠被毛顺滑有光泽,可视黏膜颜色正常,呼吸状态良好,饮水、摄食未见异常,排泄物形态正常,分泌物未见异常增加,未出现行为异常情况。
2.2.2 饮水量 给药第7、21天及停药后7 d各剂量组大鼠的每日饮水量差异不明显;给药第14天,与对照组雌性大鼠相比,中剂量组雌性大鼠饮水量极显著增加(P<0.01);给药第28天,与对照组雄性大鼠相比,低剂量组中雄性大鼠饮水量极显著增加(P<0.01)(表1)。
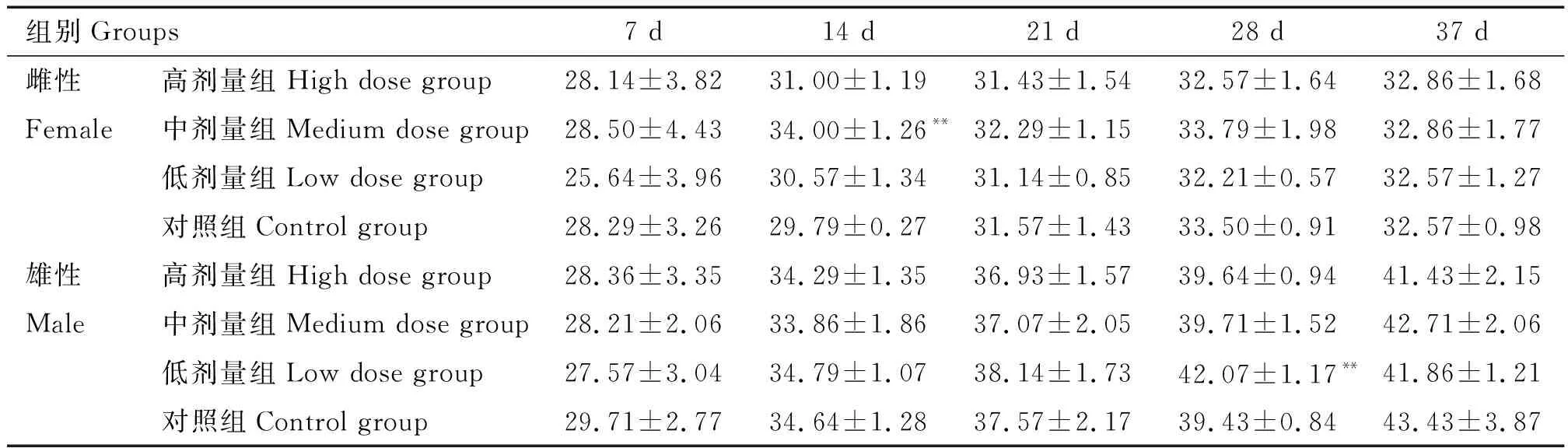
表1 大鼠每日每只平均饮水量统计结果Table 1 Statistical results of average daily drinking water consumption of each rat mL
2.2.3 采食量 给药第14天高、中剂量组雌性大鼠的采食量显著低于对照组(P<0.05);自给药21 d起各组大鼠的采食量差异不显著(P>0.05)(表2)。
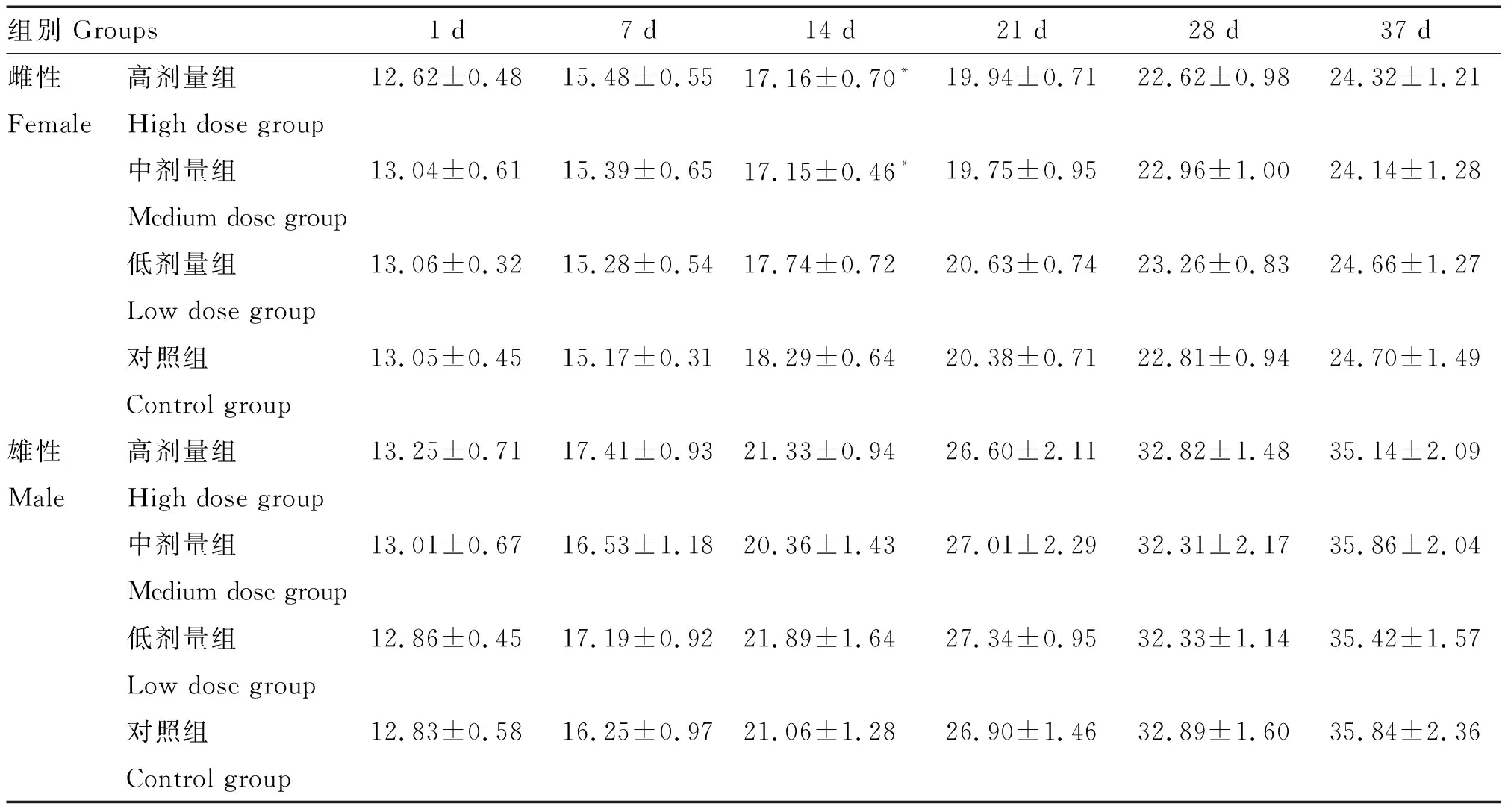
表2 大鼠每日每只平均采食量变化结果Table 2 The change of average daily intake of each rat g
2.2.4 体重变化 给药第7天,中剂量组雄性大鼠体重显著低于对照组(P<0.05);给药第14天高、中剂量组雌性大鼠体重显著低于对照组(P<0.05);自给药第21天起各组体重差异不显著(P>0.05);各给药组大鼠增重率与对照组相比差异均不显著(P>0.05)(表3)。
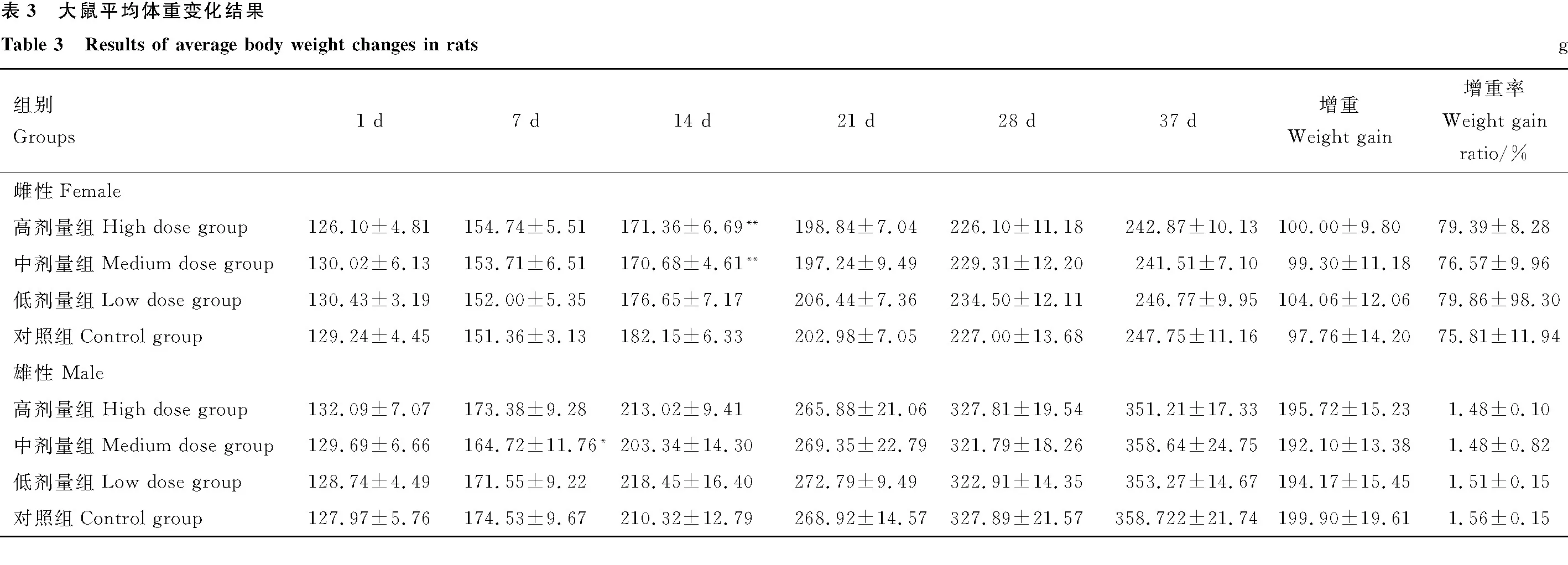
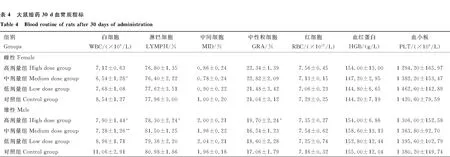
2.2.5 血常规指标 给药30 d后对部分大鼠进行血常规指标检测,与对照组雌性大鼠相比,中剂量组雌性大鼠白细胞指标显著下降(P<0.05)。与对照组雄性大鼠相比,高、中剂量组雄性大鼠白细胞指标显著或极显著下降(P<0.05;P<0.01);高剂量组雄性大鼠淋巴细胞指标显著下降(P<0.05);高剂量组雄性大鼠中性粒细胞指标显著上升(P<0.05)。其余各组之间各指标差异均不显著(P>0.05),停药7 d后,各组之间无显著差异(P>0.05)(表4、5)。
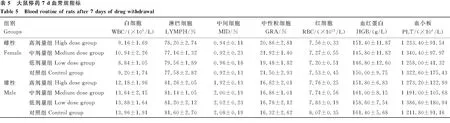
2.2.6 血液生化指标 给药30 d 后,与对照组雌性大鼠相比,高剂量雌性大鼠血液中TG水平显著上升(P<0.05);中剂量组雌性大鼠BUN水平显著下降(P<0.05),CREA水平显著上升(P<0.05);低剂量组雌性大鼠ALT、TG水平均显著上升(P<0.05)。与对照组雄性大鼠相比,高剂量组雄性大鼠BUN、CREA和TBIL水平均显著下降(P<0.05);中、低剂量组雄性大鼠BUN水平显著下降(P<0.05);其余各组之间各指标差异均不显著(P>0.05)(表6)。
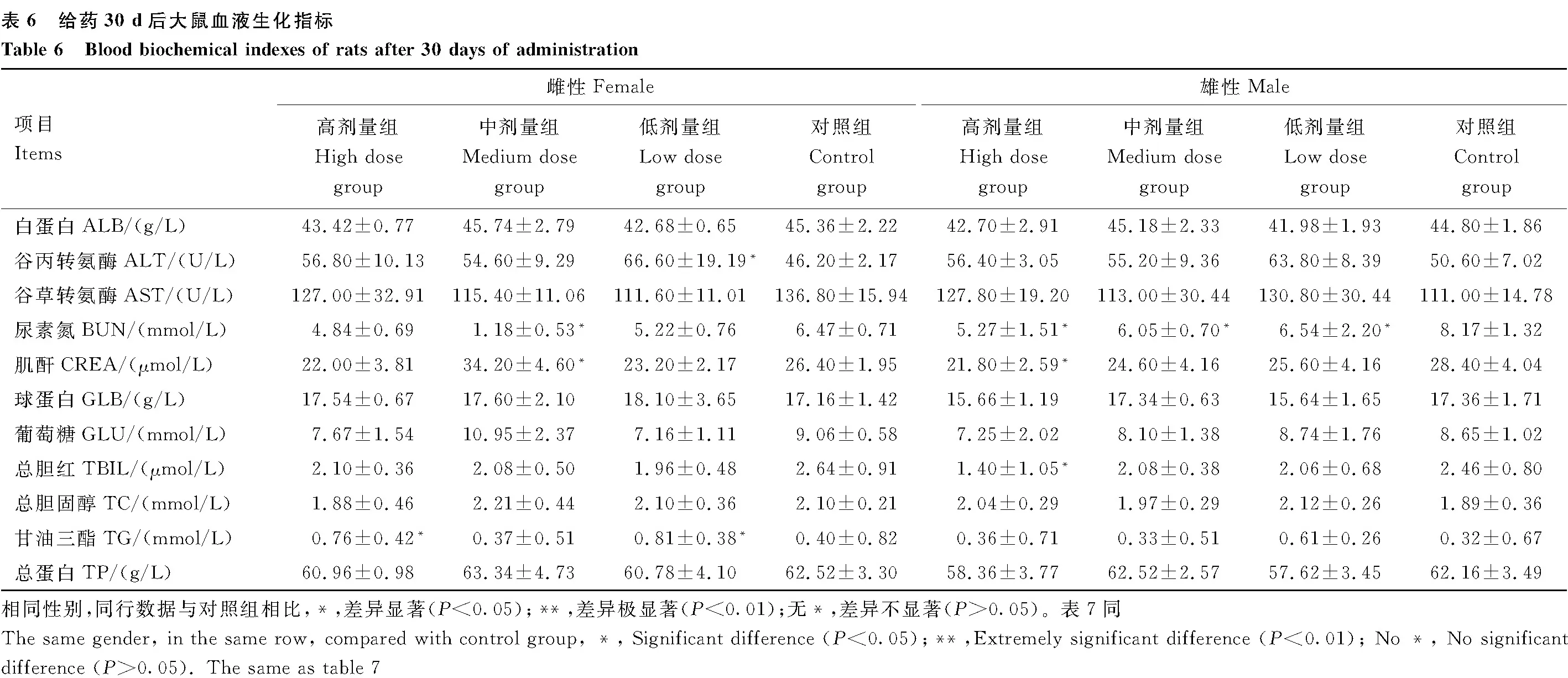
停药7 d后,与对照组雌性大鼠相比,高剂量组雌性大鼠AST、TG水平均显著降低(P<0.05),CREA、TP水平均显著升高(P<0.05);低剂量组雌性大鼠GLB水平显著升高(P<0.05),TG水平显著降低(P<0.05)。与对照组雄性大鼠相比,高剂量组雄性大鼠GLU、TBIL水平均显著降低(P<0.05),TP含量水平显著升高(P<0.05);中剂量组雄性大鼠GLU水平显著降低(P<0.05);低剂量组雄性大鼠ALT水平显著降低(P<0.05)。其余各组之间各指标差异均不显著(P>0.05)(表7)。
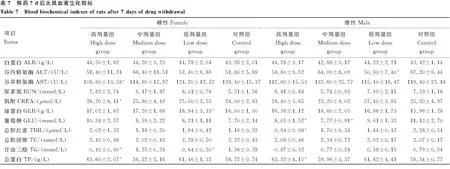
2.2.7 脏器系数 给药30 d后,与对照组雌性大鼠相比,高剂量组雌性大鼠胸腺指数显著下降(P<0.05),其余各组之间各指数差异均不显著(P>0.05)(表8)。
停药7 d后,与对照组雌性大鼠相比,雌性大鼠各组各脏器系数均无显著差异(P>0.05)。与对照组雄性大鼠相比,高剂量组雄性大鼠心脏指数显著降低(P<0.05),低剂量组雄性大鼠肾脏指数显著升高(P<0.05),中剂量组雄性大鼠胸腺指数显著降低(P<0.05),其余各组各脏器指数均无显著差异 (P>0.05)(表9)。
2.2.8 组织病理学检查 对各组大鼠进行大体剖检发现,辣蓼黄酮提取物高、中、低剂量组和对照组大鼠主要脏器均未见明显病变。对大鼠进行组织病理学检查,镜下观察发现,各药物组与对照组大鼠均未见心肌细胞出现变性,细胞之间无炎性细胞浸润,细胞核、质清晰;肝细胞核大且圆,核膜清楚;脾脏髓、质清晰,未见结缔组织增生;肺泡上皮细胞的细胞核、质清晰,肺泡腔清晰饱满;肾小球未见明显增大、萎缩或变性等;肠绒毛完整,排列整齐,绒毛外覆一层单层柱状细胞,杯状细胞呈空泡状,肠腺结构完整清晰;卵泡细胞间出现大小不同的腔隙,皮质层内可观察到处于不同发育阶段的卵泡,以原始卵泡居多;曲细精管结构清晰,睾丸间质未见出血坏死等,睾丸间质细胞、肌样细胞、精原细胞、支持细胞、各级精母细胞及精子结构清晰完整(图1、2)。
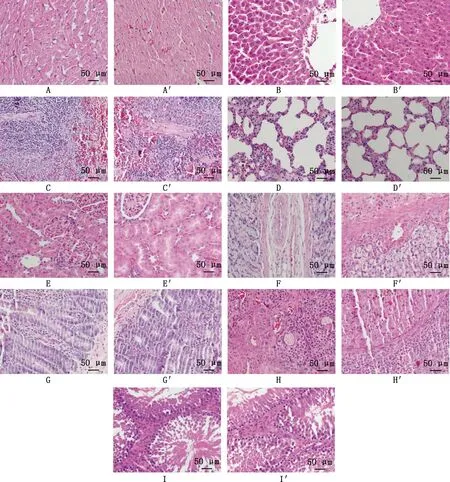
A~I,高剂量组心脏、肝脏、脾脏、肺脏、肾脏、胃、十二指肠、卵巢、睾丸;A′~I′,对照组心脏、肝脏、脾脏、肺脏、肾脏、胃、十二指肠、卵巢、睾丸。下同A-I,Heart,liver,spleen,lung,kidney,stomach,duodenum,ovary and testis of high dose group;A′-I′,Heart,liver,spleen,lung,kidney,stomach,duodenum,ovary and testis of control group.The same as below图1 给药30 d后大鼠各脏器组织病理学观察(HE,400×)Fig.1 Histopathological observation on the organs of rats 30 days after the administration (HE,400×)
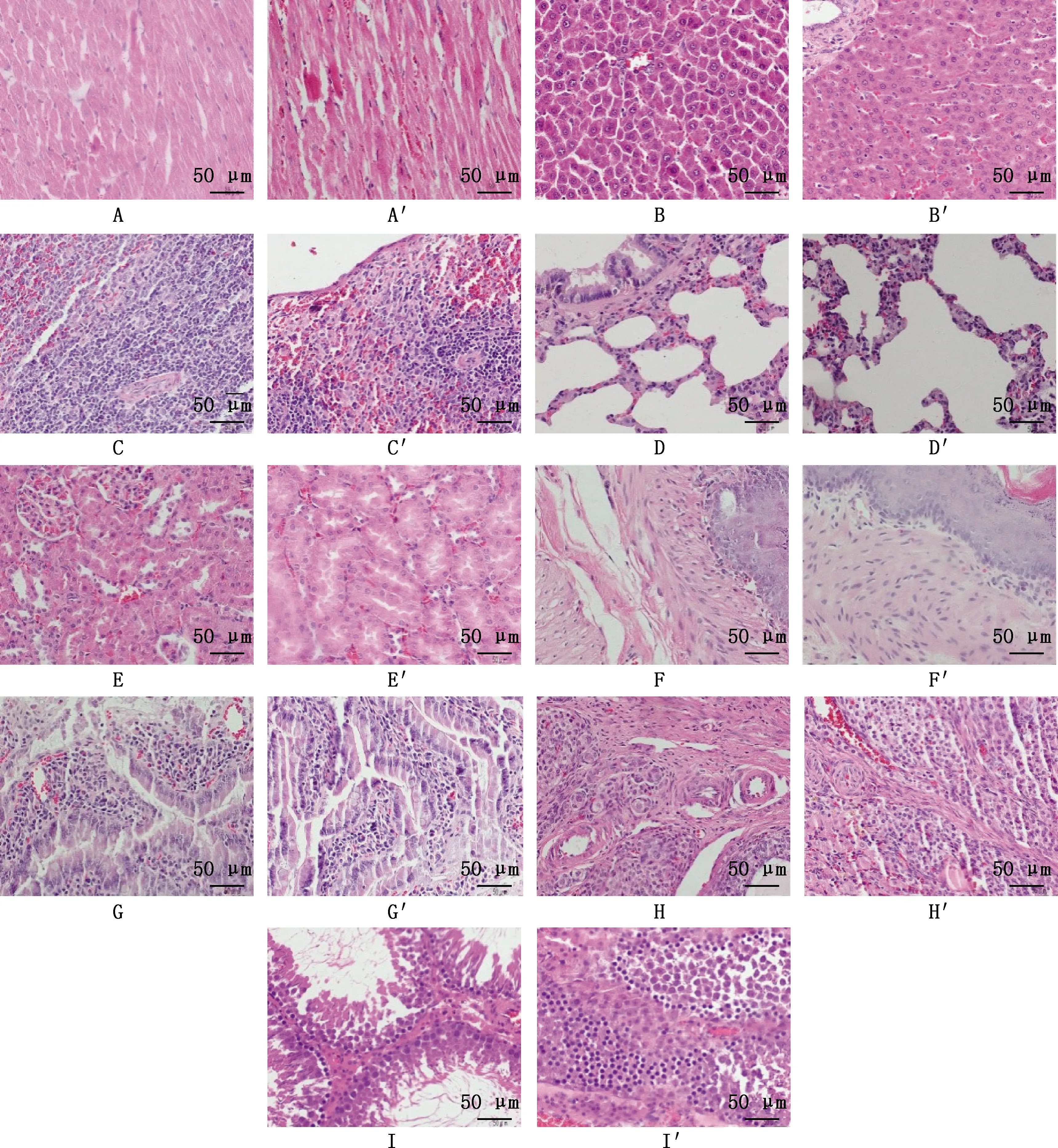
图2 停药 7 d后大鼠各脏器组织病理学观察(HE,400×)Fig.2 Histopathological observation on the organs of rats after 7 days of drug withdrawal (HE,400×)
综上所述,各药物组与对照组大鼠的主要器官病理切片未见特征性病变。
3 讨 论
辣蓼是中国传统中药之一,《本草纲目》、《别录》、《唐本草》、《岭南采药录》等多部中国古代医书中均有对辣蓼的功效应用的记载。辣蓼在中国常用于防治痢疾、腹泻、胃肠炎、子宫出血、跌打肿痛、风湿关节痛及寄生虫疾病等,外用治疗毒蛇咬伤、皮肤湿疹时,具有良好疗效[12]。传统中医药学中,辣蓼与青蒿、苍耳、赤小豆、苦杏仁等中药混合,加以面粉、麸皮混合发酵制成六神曲,具有健脾利胃、消食化中等功效[13-14]。辣蓼配合牛耳枫使用,是海南黎药的代表之一,水提浓缩制成的复方牛耳枫片对急性肠胃炎和消化不良患者的疗效显著[15]。周世明等[16]发现,采用新鲜辣蓼茎叶粉碎后加5倍质量的水放置12 h后滤过的原液3倍稀释后,可用于农作物种植中防治蚜虫、茶毛虫、稻飞虱地老虎等多种昆虫。肖祝华等[17]研究发现,辣蓼对大肠埃希菌性腹泻有良好的治疗作用,其作用机制可能与减少肠组织炎症因子释放、改善肠道黏膜屏障、干预 TGF-β/Smads 信号转导有关。Devesh等[18]研究发现,黄酮可造成Toll样受体 4(Toll-like receptor 4,TLR4)下调及AP-1和p-JNK蛋白水平的下降,且TLR4途径的阻断及Sirtuin1/Nrf2途径的增加,诱导抗氧化剂防御,减少了炎症和氧化应激。但鲜见有关其毒理学的研究,故为揭示辣蓼黄酮提取物在中毒过程中所出现的毒性反应,本研究对辣蓼黄酮提取物进行了安全性研究。
急性毒性试验是评价药物安全性的重要指标,其结果可为后续的亚急性、慢性毒性试验提供理论基础[19]。急性毒性试验预试验中,辣蓼黄酮提取物的给药剂量达到20 g/kg BW时,未出现小鼠中毒症状或死亡;最大给药量试验中,药物剂量达到30 g/kg BW,未出现小鼠中毒或死亡的情况。大鼠30 d喂养试验结果中,各剂量组大鼠在给药期间和停药期间被毛顺滑有光泽,可视黏膜颜色正常,发育良好。这与李洋等[20]研究发现主要有效成分为黄酮的叉分蓼在剂量范围内属于安全无毒的结果一致,也与赖伟勇[21]对辣蓼等的急性毒性研究结果一致。同期同性别大鼠各组之间饮水量略有差异,但差异并不明显,雌性大鼠的增重趋势低于雄性大鼠,这与大鼠的生长趋势相符合[22]。
血常规和血液生化指标中,停药7 d后,各项血常规指标与对照组相比差异不显著;ALT、AST是反应肝脏实质损害的指标,BUN和CREA是反映肾功能的指标[19]。本试验中连续给药30 d后,中剂量组雌性大鼠BUN和CREA、各给药组雄性大鼠BUN、高剂量组雄性大鼠CREA与对照组相比显著降低,说明该药物对大鼠肾脏有一定的影响,但其变化在正常范围内。
脏器系数可在一定程度上体现药物对机体的毒性,且能直观的观察到脏器的变化,可作为判断药物在体内毒性累积的指标之一[23]。在停药7 d后,低剂量雄性大鼠肾脏指数明显高于其他组,表明辣蓼黄酮提取物给药后会对大鼠肾脏有轻度损伤。各药物组雌性、雄性大鼠胸腺指数较对照组均有下降,胸腺是大鼠的免疫器官,其具有先发育后退化的特征[24]。根据本研究结果分析,辣蓼黄酮提取物长期应用会对大鼠胸腺造成轻微的影响。
病理组织学诊断是目前临床医学领域常用的一种诊断方式[25],对辣蓼黄酮提取物各剂量组与对照组的大鼠进行病理组织学切片观察后发现,各组的主要脏器结构形态正常,未见炎性浸润、增生、变性等异常情况,未出现特征性病理变化。综上所述,辣蓼黄酮提取物在5 g/kg BW以下连续应用30 d不会对大鼠造成毒性损害,为辣蓼黄酮的临床应用提供了科学论证,有助于促进辣蓼黄酮提取物的推广。
4 结 论
急性毒性试验测得辣蓼黄酮提取物口服给药的最大给药量为30 g/kg BW;亚慢性毒性试验结果表明,辣蓼黄酮提取物以5 g/kg BW或以下对大鼠口服给药后30 d,大鼠血液学指标和生化指标未见明显变化,表明辣蓼黄酮提取物在5 g/kg BW及以下剂量对大鼠无毒副作用,安全性好。

