羊口疮病毒PMA-PCR检测方法的建立
梁 倩,包涛涛,3,鲜思美,2,杨 倩,李鹏飞,顾庆林,郑维豪,杜 鹏,青成欣
(1.贵州大学动物科学学院,贵阳 550025;2.贵州省动物疫病研究所,贵阳 550025;3.贵州省黔东南州农业农村局,黔东南 556000)
羊口疮是由羊口疮病毒(Orf virus,OrfV)引起的多发于绵羊和山羊中的一种急性、嗜上皮性的人兽共患传染病,该病呈高度接触性传染,发病率高,在世界各地均有分布,给养殖业造成重大经济损失,同时严重威胁公共卫生安全。OrfV隶属于痘病毒科副痘病毒属,是基因组庞大的线性双链DNA病毒[1]。F1L蛋白由F1L基因编码,是OrfV的囊膜蛋白,在病毒吸附和侵入过程中可促进宿主细胞膜与病毒外膜的融合,增强OrfV的传播,因此研究者常将F1L基因作为检测OrfV的重要靶标[2]。目前针对OrfV的检测方法有间接免疫荧光试验(IFA)、病毒中和试验、酶联免疫吸附试验(ELISA)、PCR及其衍生技术等[3]。通常只有活病毒才具有毒力和致病能力,潜在威胁动物安全,但上述方法主要针对OrfV的抗原抗体反应特异性和引物特异性进行,并不能检测病毒的感染活性。另外,用于病毒分离、增殖的细胞培养技术,依赖于细胞病变效应(CPE)的观察,但常因试验条件、操作人员技术不规范,以及某些地区的弱毒性分离株,导致病毒分离时无CPE现象产生[4]。目前实验室诊断常用的实时荧光定量PCR技术是通过实时检测扩增DNA的荧光信号来定量病原[5],此类方法常因检测到环境或样品中游离的病毒基因组而导致假阳性,从而误判样本的感染性,误诊动物的健康状况。因此,针对具有感染活性OrfV的快速检测方法的建立及应用对有效预防羊口疮的发生发展及公共卫生安全具有重要意义。
叠氮溴化丙锭(propidium monoazide,PMA)是一种具有光敏性、高亲和力的新型核酸交联染料,在光作用下可产生一类氮烯类物质与DNA分子共价交联,从而抑制病毒核酸的PCR扩增[6]。PMA不能渗透膜结构完整的活病毒,而病毒失活后PMA可透过受损膜有效修饰曝露出的病毒DNA,并与之形成稳定共价氮碳键,进而阻断失活病毒DNA分子的PCR扩增,但活病毒的核酸扩增不受抑制,从而实现活病毒与失活病毒的区分[7]。近年来,PMA与常规PCR联合的检测方法较多应用于生物医学检测[8],基于PCR检测技术操作简单、快速、低成本且适于大批样品检测等优点,本研究利用PMA染料联合PCR技术,以F1L基因为靶标检测基因,建立活OrfV的PMA-PCR检测方法,以期为有效评估病毒致病性的相关工作提供技术参考。
1 材料与方法
1.1 材料
口蹄疫病毒(FMDV)、绵羊痘病毒(SPPV)、山羊痘病毒(GTPV)、羊口疮病毒大足株(OrfV-DZ,TCID50=10-5.68/0.1 mL)、羔羊睾丸细胞(LT)均由贵州大学预防兽医学实验室保存;病毒基因组提取试剂盒、50×TAE Buffer均购自QIAGEN公司;PMA染料购自Biotium公司;GoldView核酸染料购自Biodee公司;2×Easy Mix和DL2000 DNA Marker均购自TaKaRa公司;DMEM培养基购自HyClone公司;FBS和胰蛋白酶均购自Gibco公司;500 W卤素灯购自Philips公司。
1.2 方法
1.2.1 引物设计与合成 根据GenBank上已发表的OrfV全基因序列(登录号:HM133903.1),利用软件Primer Premier 6.0设计1对扩增F1L基因的特异性引物,F1L-F:5′-GCACTTC-TTCACGGACAT-3′;F1L-R:5′-GTCATGTAGG-TCTCCTTGAG-3′,预期扩增长度约为246 bp。引物由生工生物工程(上海)股份有限公司合成。
1.2.2 OrfV病毒悬液的热处理 取4支各装有500 μL OrfV-DZ病毒悬液(TCID50=10-5.68/0.1 mL)的离心管,分别置于50、60、70和80 ℃热水浴中处理10 min后,迅速置冰上冷却,吸取200 μL病毒悬液接种于6孔板中已培养至单层的LT细胞,吸附1 h后更换含2% FBS的DMEM营养液,于37 ℃、5% CO2培养箱中培养24~48 h,观察是否有CPE出现,比较确定OrfV的最佳热灭活温度。
1.2.3 PMA曝光时间优化 取6支各装有500 μL热灭活OrfV-DZ病毒悬液(TCID50=10-5.68/0.1 mL)的离心管,分别加入PMA溶液使其终浓度为20 μmol/L,样品振荡混匀后避光冰上孵育10 min,于距卤素灯20 cm远处分别将样品曝光0、5、10、15、20和25 min,离心管每隔2~3 min进行颠倒混匀。同时设置不加PMA的热灭活OrfV-DZ病毒悬液为阳性对照组,以ddH2O代替病毒为阴性对照组,经PCR检测选择最佳曝光时间。以病毒基因组提取试剂盒提取病毒DNA。PCR反应体系25 μL:DNA模板5 μL,上、下游引物各0.5 μL,2×Easy Mix 12.5 μL,ddH2O补至25 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸45 s,共35个循环;72 ℃延伸10 min。PCR产物进行1.2%琼脂糖凝胶电泳鉴定。
1.2.4 完全抑制热灭活OrfV PCR扩增的最小PMA浓度确定 取6支装有500 μL热灭活OrfV-DZ病毒悬液(TCID50=10-5.68/0.1 mL)的离心管,分别加PMA工作液使其终浓度为0、5、10、15、20、25 μmol/L,振荡混匀后于暗处孵育10 min;样品离心管于冰上参照上述优化确定的最佳曝光时间经卤素灯照射处理后进行PCR扩增。设置不加PMA溶液的热灭活OrfV-DZ病毒悬液为阳性对照组,ddH2O代替病毒样本为阴性对照组,确定完全抑制热灭活OrfV PCR扩增的最小PMA浓度。
1.2.5 不抑制活OrfV PCR扩增的最大PMA浓度确定 取7支各装有500 μL活OrfV-DZ病毒悬液(TCID50=10-5.68/0.1 mL)的离心管,分别加入PMA工作液使其终浓度为20、25、30、35、40、45、50 μmol/L,振荡混匀后暗处孵育10 min;于冰上经卤素灯光照后进行PCR操作。同时设置不加PMA的阳性对照组,ddH2O代替病毒样本的阴性对照组,确定不抑制活OrfV基因组PCR扩增的最大PMA浓度。
1.2.6 PMA-PCR特异性试验 分别提取FMDV、SPPV、GTPV基因组,经上述优化确定的PMA作用条件处理后作为模板,进行常规PCR扩增,同时设置以OrfV基因组为模板的阳性对照组及以ddH2O为模板的阴性对照组,检测分析所建立PMA-PCR方法的特异性。
1.2.7 不同比例活/热灭活OrfV混合样品的PMA-PCR检测 设计2组由不同比例热灭活、活OrfV组成的病毒悬液,混合比例见表1。第1组分别取0.25 mL固定滴度的热灭活OrfV-DZ病毒悬液(TCID50=10-5.68/0.1 mL)与不同滴度活OrfV病毒悬液等体积混合;第2组分别取0.25 mL固定滴度活OrfV-DZ病毒悬液(TCID50=10-5.68/0.1 mL)与不同滴度热灭活OrfV病毒悬液等体积混合均匀。按上述优化后的PMA工作浓度及最佳曝光时间处理样本后进行PCR扩增,同时设置不加PMA溶液的阳性对照组和ddH2O代替病毒样本的阴性对照组。

表1 活/热灭活OrfV的混合比例Table 1 Mixing ratio of active and heat-inactivated OrfV
2 结 果
2.1 OrfV热灭活温度确定
OrfV-DZ病毒悬液(TCID50=10-5.68/0.1 mL)于不同温度热水浴处理后接种LT细胞,于37 ℃、5% CO2培养箱中培养2~3 d后观察,由图1可知,50 ℃热水浴处理病毒后接种细胞,细胞变圆、皱缩,而60 ℃以上热水浴处理病毒后感染细胞,细胞呈长梭形,并未明显出现CPE。 因此,OrfV-DZ(TCID50=10-5.68/0.1 mL)经60 ℃以上温度水浴处理10 min即被灭活。

A~D,50、60、70、80 ℃图1 OrfV热灭活温度确定(100×)Fig.1 Determination of thermal inactivation temperature of OrfV (100×)
2.2 PMA最佳曝光时间确定
热灭活OrfV经PMA处理,分别曝光0、5、10、15、20、25 min后,提取病毒基因组进行PCR扩增,结果见图2。由图2可知,曝光时间越长,DNA条带亮度越弱,当曝光15 min时条带消失,表明DNA扩增完全被抑制,即PMA与热灭活OrfV的DNA共价交联且溶液中游离PMA被完全光解的最佳曝光时间为15 min。
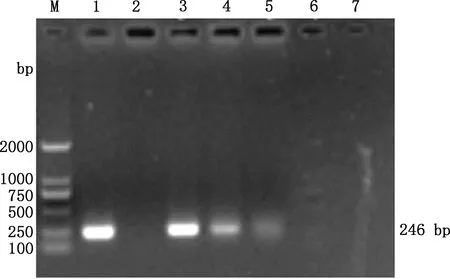
M,DL2000 DNA Marker;1,阳性对照;2,阴性对照;3~7,曝光时间分别为0、5、10、15、20 minM,DL2000 DNA Marker;1,Positive control;2,Negative control;3-7,Exposure time was 0,5,10,15 and 20 min,respectively图2 PMA最佳曝光时间Fig.2 Best exposure time of PMA
2.3 完全抑制失活OrfV PCR扩增的最小PMA浓度确定
由图3可知,随着PMA浓度的增加,PMA与热灭活OrfV的DNA结合越多,条带亮度逐渐变弱。当PMA浓度达到20 μmol/L时,条带亮度消失,表明热灭活OrfV的PCR扩增被完全抑制,即热灭活OrfV的PCR扩增被完全抑制的最小PMA工作浓度为20 μmol/L。

M,DL2000 DNA Marker;1,阳性对照;2,阴性对照;3~8,PMA浓度分别为0、5、10、15、20和25 μmol/LM,DL2000 DNA Marker;1,Positive control;2,Negative control;3-8,PMA concentrations were 0,5,10,15,20 and 25 μmol/L,respectively图3 完全抑制OrfV PCR扩增的最小PMA浓度Fig.3 Minimum PMA concentration for complete inhibition of OrfV PCR amplification
2.4 不抑制活OrfV PCR扩增的最大PMA浓度确定
由图4可知,当PMA浓度为15~35 μmol/mL时,扩增条带亮度无差异,说明PMA对活OrfV的PCR扩增无明显的抑制作用;当PMA浓度达到40 μmol/mL时,扩增条带亮度消失,表明PMA对活OrfV PCR扩增的抑制作用较强。 因此,选择不抑制活OrfV PCR扩增的最大PMA浓度为35 μmol/L。
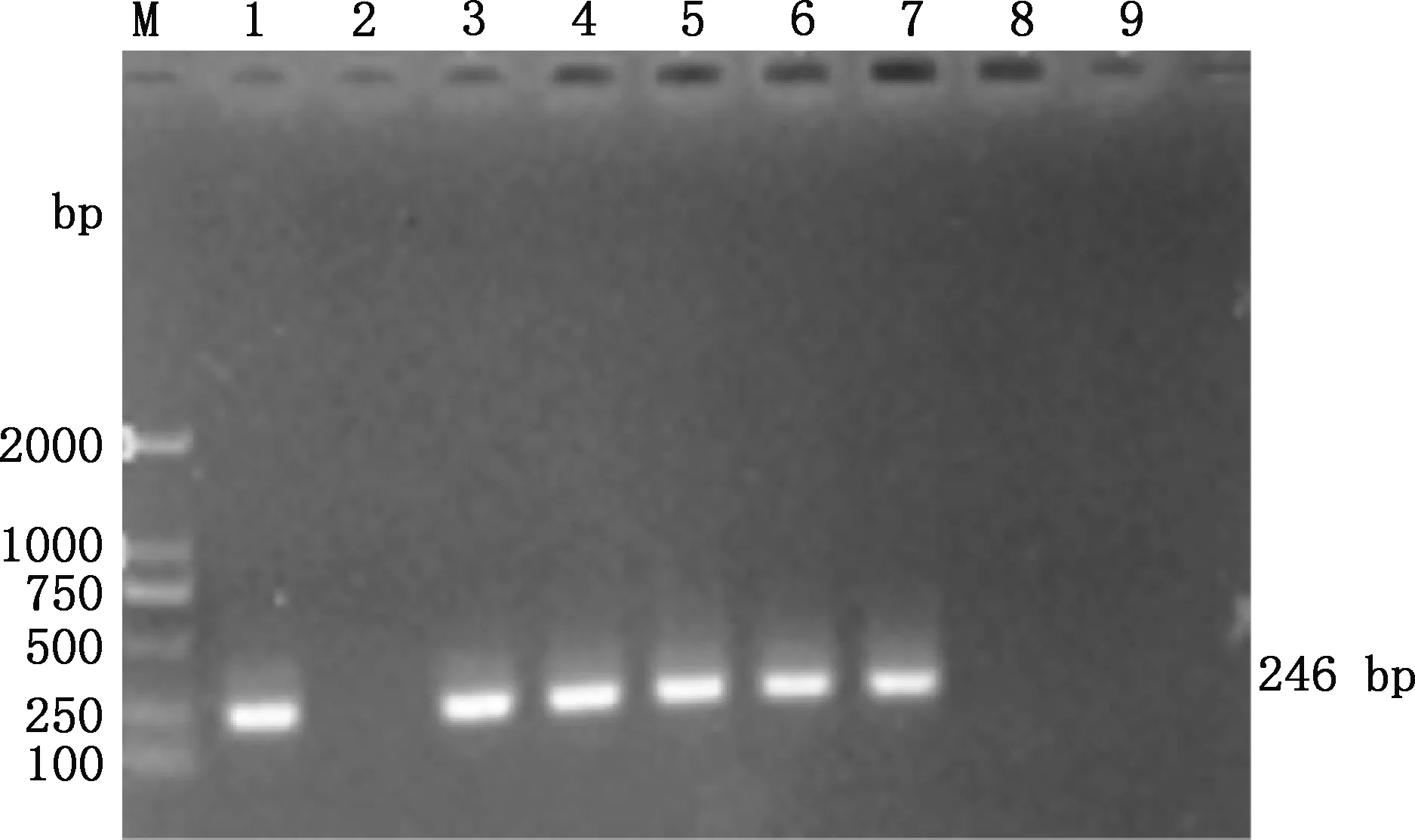
M,DL2000 DNA Marker;1,阳性对照;2,阴性对照;3~9,PMA浓度分别为15、20、25、30、35、40和45 μmol/LM,DL2000 DNA Marker;1,Positive control;2,Negative control;3-9,PMA concentrations were 15,20,25,30,35,40 and 45 μmol/L,respectively图4 不抑制OrfV PCR扩增的最大PMA浓度Fig.4 Maximum PMA concentration did not inhibit the PCR amplification of OrfV
2.5 特异性试验
由图5可知,仅OrfV有特异性扩增条带,其余病毒基因组及阴性对照组均无条带出现,表明所建立的PMA-PCR检测方法具有较强的特异性。
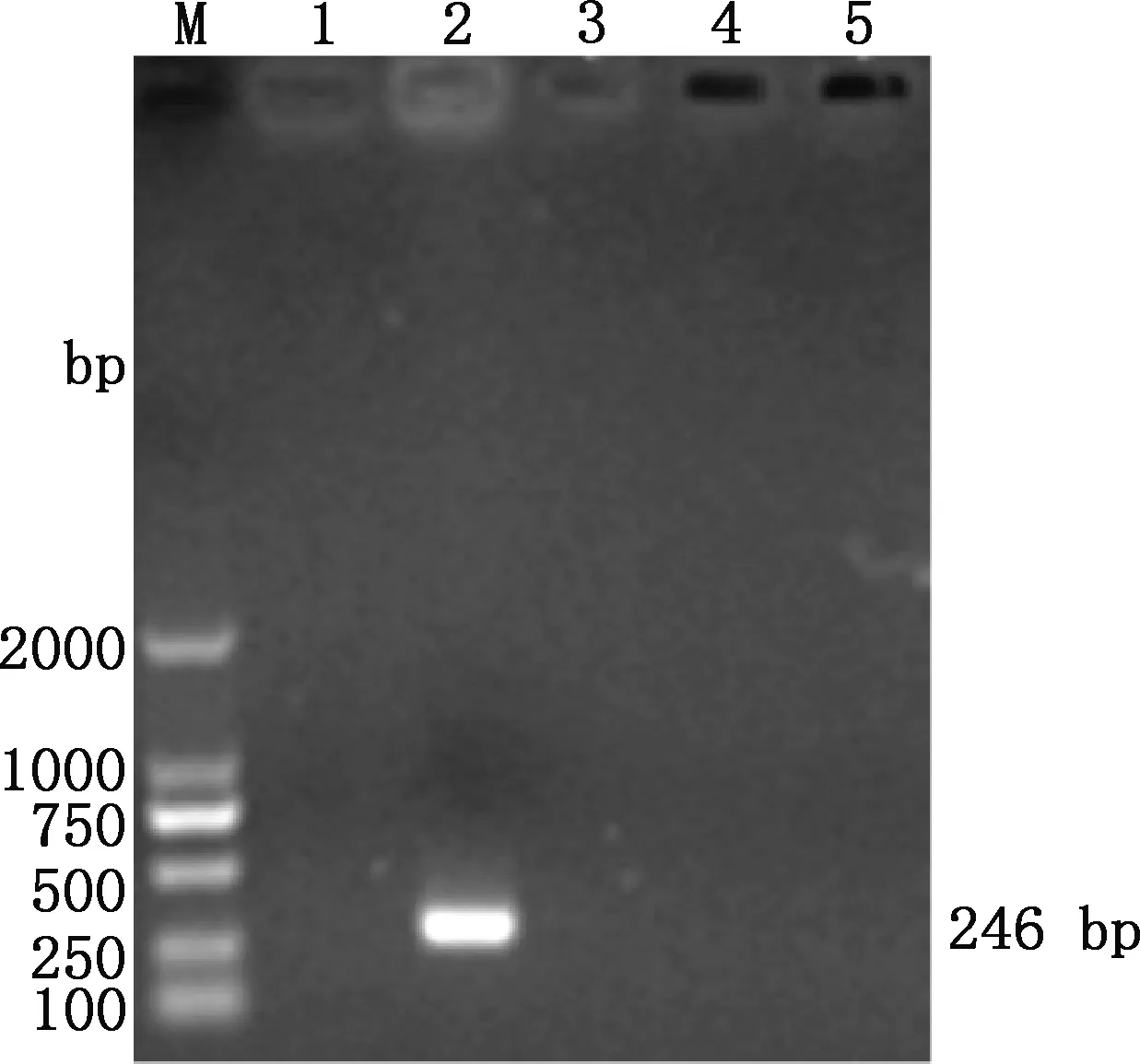
M,DL2000 DNA Marker;1,阴性对照;2,羊口疮病毒;3,山羊痘病毒;4,绵羊痘病毒;5,口蹄疫病毒M,DL2000 DNA Marker;1,Negative control;2,OrfV;3,GTPV;4,SPPV;5,FMDV图5 PMA-PCR特异性试验结果Fig.5 PMA-PCR specificity test results
2.6 不同比例活/热灭活OrfV混合病毒悬液样本检测
应用PCR检测验证PMA对活OrfV/热灭活OrfV混合样品的影响作用,结果见图6、7。当不同数量的活OrfV与固定数量的热灭活OrfV病毒悬液混合时,经PMA处理后DNA扩增条带亮度随活OrfV浓度减少而渐弱,且活OrfV浓度为10-0.68TCID50/0.1 mL时,条带亮度完全消失(图6);当固定数量活OrfV与不同数量的热灭活OrfV病毒悬液混合时,条带亮度均匀一致(图7),说明热灭活OrfV的扩增被完全抑制,而活OrfV的PCR扩增不受影响。因此,在含有不同比例的灭活、活OrfV的病毒悬液中,20 μmol/L PMA可完全抑制失活OrfV基因组的PCR扩增,且活OrfV不受抑制,检测的灵敏度达10-1.68TCID50/0.1 mL。
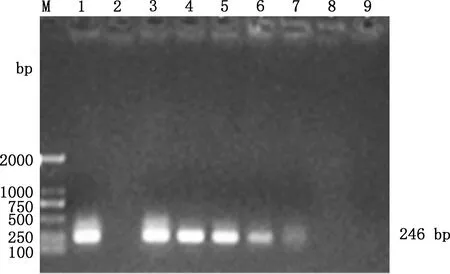
M,DL2000 DNA Marker;1,阳性对照;2,阴性对照,3~9,病毒滴度分别为10-5.68、10-4.68、10-3.68、10-2.68、10-1.68、10-0.68和100 TCID50/0.1 mL。图7同M,DL2000 DNA Marker;1,Positive control;2,Negative control;3-9,Virus titer was 10-5.68,10-4.68,10-3.68,10-2.68,10-1.68,10-0.68 and 100 TCID50/0.1 mL,respectively.The same as fig.7图6 固定数量灭活病毒与变化数量活病毒混合液PMA-PCR扩增Fig.6 PMA-PCR amplification of a fixed number of inactivated viruses and varying amounts of active virus mixture
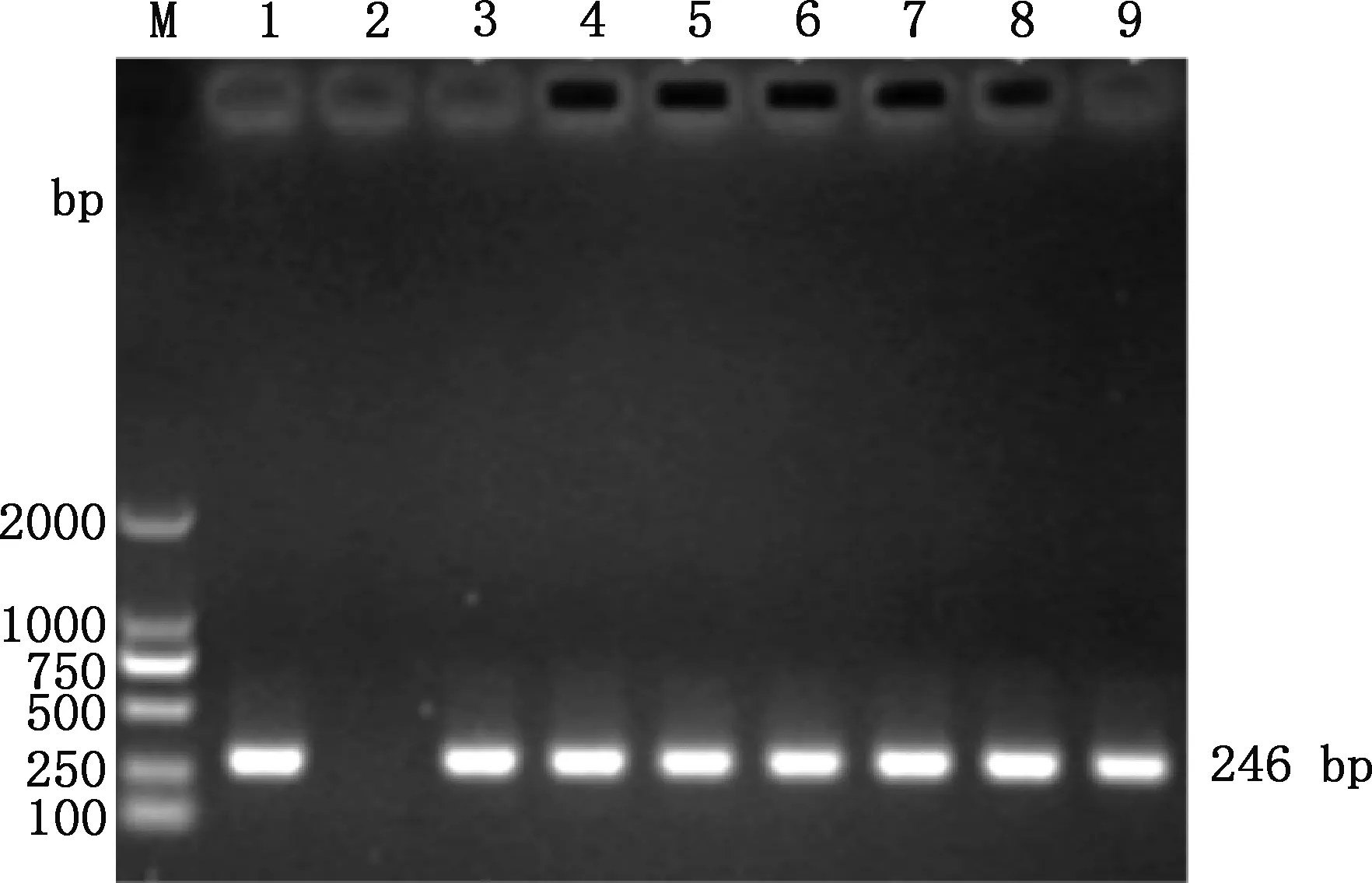
图7 固定数量活病毒与变化数量灭活病毒混合液PMA-PCR扩增Fig.7 PMA-PCR amplification of a fixed amount of active virus and varying amount of inactivated virus mixture
3 讨 论
由于活病毒具有传染性并能引起疾病,因此在畜牧兽医行业中,活病毒的检测才是检验卫生程序和生物危害防控的关键。利用现有的叠氮类染料选择性检测活病毒的基础是其对膜结构不完整的失活病毒具有膜渗透性,从而结合抑制失活病毒基因组的扩增。囊膜的主要功能是协助病毒进入宿主细胞,促进病毒在宿主细胞内的增殖,提高病毒的致病性[9];衣壳是病毒的蛋白质外壳,其作用是包裹保护病毒核酸,参与协助病毒感染[10]。单叠氮化乙锭(ethidium monoazide,EMA)和单叠氮化丙锭(propidium monoazide,PMA)作为核酸结合染料,均可渗透穿过失活病毒受损的囊膜、衣壳,经光活化后共价结合暴露出的病毒DNA与之发生交联反应,从而抑制或消除失活病毒基因组的扩增[11]。但Flekna等[12]研究表明,EMA能部分渗入活病毒内,导致病毒DNA分子和EMA之间的交联,造成活细胞中病毒基因组及PCR扩增信号的损失,易导致假阴性。PMA由于不能进入完整病毒囊膜或衣壳,可将其作为替代性非膜渗透核酸染料,较EMA更适合用于病毒的活性检测。常用于OrfV检测的靶标主要有B2L和F1L基因,B2L基因主要在病毒感染后期编码免疫原性蛋白,增强病毒毒力,协助病毒的增殖扩散[13];F1L基因编码的F1L蛋白具有肝素受体结合活性,在病毒吸附及入侵过程中起重要作用[14],且F1L蛋白在病毒表面具有特异性抗原决定簇,是OrfV单克隆抗体主要结合位点蛋白,对于OrfV具有重要研究意义[15]。因此,本研究选用F1L基因作为靶标来建立针对活OrfV的PMA-PCR检测方法。
PMA与病毒基因组共价结合可能受到病毒本身、与光源的距离、曝光时间、样本本身性质等多种因素的影响,本研究通过优化病毒灭活时间、曝光时间和PMA工作浓度来建立具有最佳工作效率的PMA-PCR检测方法。PMA的浓度影响其与DNA分子的结合效率,PMA浓度过低,则DNA不能被完全结合,无法抑制失活病毒的PCR扩增,浓度过高则会影响活病毒的扩增[16]。因此,应用PMA进行检测要保证PMA的量可以与全部失活病毒的DNA结合,同时还不会对活病毒产生影响[17]。本研究对PMA作用浓度进行优化,得到最佳反应浓度为20 μmol/L,在此工作浓度下PMA可完全抑制失活病毒的PCR扩增,而对活病毒的基因扩增无影响。PMA的作用还受曝光时间影响,于光照作用下未完全与失活病毒DNA结合的PMA可与水分子充分反应生成羟胺,后者无法与病毒DNA分子结合,即不抑制活病毒基因组扩增[18],所以要求试验过程中PMA染料的添加及孵育均需在避光条件下进行。本研究对曝光时间优化,结果表明将PMA曝光10 min,即可使PMA最大程度抑制失活病毒DNA的PCR扩增,且活病毒基因组有效扩增。
目前,PMA-PCR技术已广泛应用于多种类型活病毒的选择性检测。Fittipaldi等[19]在110 ℃下进行PMA灭活预处理后,PMA与噬菌体T4病毒的DNA有效结合,联合PCR扩增对热灭活病毒和活病毒进行区分,同时通过衣壳损伤监测确定了导致病毒失活的因素。Gloria等[20]分别使用PMA和RNase预处理热灭活病毒样本,通过实时荧光定量RT-PCR对甲型肝炎病毒做定量检测,结果表明,PMA处理在区分具有感染性的病毒和灭活病毒方面比RNase处理效果显著。Sandhya等[21]将PMA结合RT-PCR用于确定肠道RNA病毒在水中的传染性,有效检测存在于环境基质中的传染性脊髓灰质炎病毒和非传染性病毒,较常规的PCR检测和细胞培养结果更具可信性。在某些情况下,失活病原体脂蛋白膜结构仍完整,Nocker等[22]研究结果表明,紫外线通过诱导DNA损伤而不直接影响膜通透性来影响活力,PMA并不能监测紫外照射后病原活力的丧失。因此叠氮类染料检测在核酸扩增分析中的应用应谨慎,建议仅用于通过损伤细胞壁或改变细胞膜完整性而使微生物细胞失活的方法,而对于不同病毒的适用性仍有待研究。
4 结 论
本研究结果表明,经60 ℃热水浴10 min可完全灭活OrfV;当PMA浓度达20 μmol/L时即可完全抑制热灭活OrfV的PCR扩增;当PMA浓度超过35 μmol/L即会对OrfV的PCR扩增产生一定的抑制作用;且所建立的PMA-PCR检测方法只对活OrfV的DNA特异扩增,在不同滴度比例混合的病毒悬液中PMA对活OrfV的检测灵敏度为10-1.68TCID50/0.1 mL。 本试验所建立的PMA-PCR检测方法敏感特异,对活OrfV的检测有效可行。

