新城疫病毒样颗粒研究进展
郗珊珊,贾伟娟,何云江,孟庆磊,陈云娇,王学理
(内蒙古民族大学动物科技学院,通辽 028000)
新城疫(Newcastle disease,ND)又称“亚洲鸡瘟”或“伪鸡瘟”,是由新城疫病毒(Newcastle disease virus,NDV)引起的一种严重制约养禽业发展的Ⅰ类传染病[1-3]。NDV只有一种血清型,但其基因型上高度多样,最新的分类系统将NDV分为Ⅰ类(class Ⅰ)和Ⅱ类(class Ⅱ),Ⅰ类毒株只包含1个基因型,且在该基因型内的毒株几乎都是无毒的,而Ⅱ类有多种基因型,其中基因Ⅵ型和Ⅶ型NDV强毒株在中国最为常见,并具有高度特异性[4-6]。
ND的防控最初使用的是灭活苗免疫,但由于灭活苗保护水平有限,不能提供有效的黏膜免疫和细胞免疫应答,因此国内外科研人员大都致力于活疫苗的研发,目前使用的活疫苗主要有Ⅰ系(Mukteswar株)、Ⅱ系(B1株)、Ⅲ系(F株)、Ⅳ系(LaSota株)等[7-8]。近年来,很多研究证实了新城疫病毒样颗粒(Newcastle disease virus-like particles,NDV-VLPs)能诱导树突状细胞(dendritic cells,DCs)的分化与成熟,可作为疫苗研发的理想载体,用以研制安全有效的疫苗进而防控该病。目前,已上市的VLPs疫苗包括乙型肝炎病毒疫苗、戊型肝炎病毒疫苗、重组人乳头瘤病毒疫苗等,在疾病的预防和治疗上发挥着重要的作用[9]。笔者主要就NDV-VLPs的结构、其对DCs细胞成熟的影响及NDV-VLPs疫苗等相关内容进行阐述与讨论,以期在疫苗开发和疫病防控方面做出贡献。
1 NDV基因组
NDV属于副黏病毒科(Paramyxoviridae)正禽腮腺炎病毒属(Orthoavulavirus),是直径长100~400 nm的单股负链RNA病毒,外有囊膜包裹(图1)[10-12]。NDV基因组全长约15.2 kb,编码8种蛋白,包括6种结构蛋白(核衣壳蛋白(NP)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、血凝素神经氨酸酶蛋白(HN)和大聚合酶蛋白(L))及P基因编码的2种非结构蛋白(V和W)[13-14]。其中HN、F和M蛋白与病毒的脂质膜有关,NP、P和L蛋白与基因组RNA合成有关,非结构蛋白V和W可参与病毒毒力形成,具体功能见表1。
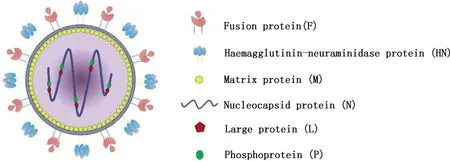
图1 NDV结构示意图[11]Fig.1 Schematic diagram of NDV structure[11]

表1 NDV蛋白功能Table 1 Function of NDV proteins
2 NDV-VLPs
VLPs是由病毒蛋白在感染过程中体外表达或自发组装而形成的。其形态与病毒相似,但由于不含遗传物质(DNA或RNA)而不具有感染性,因此常用于疫苗的生产。VLPs由结构蛋白和脂类组装而成,具有极强的免疫原性[23]。VLPs包括有囊膜的VLPs和无囊膜的VLPs,无囊膜的VLPs通常由一种或多种病毒结构蛋白组成,更易生产和纯化[24];而基于有囊膜病毒建立的VLPs系统能完美地展现病毒表面糖蛋白,可将不同病原体的抗原蛋白整合在其表面,构建多价、多联的VLPs,是目前新型疫苗研究的重点方向。VLPs表面结构高度重复有序,使其无需在T细胞帮助下即可完成与B细胞抗原受体(B-cell receptor,BCR)的交联,引起BCR膜相关免疫球蛋白的寡聚化[25]。在某些情况下,当VLPs对B细胞的刺激足够强时,可诱导非T细胞介导的IgM抗体。多种表达系统都可产生VLPs,包括大肠杆菌等原核表达系统、杆状病毒-昆虫细胞真核表达系统等。
NDV-VLPs主要是以NDV-M蛋白为骨架,来装配HN、F和NP蛋白,可表现出与活的NDV颗粒相似的外观和免疫原性,但不具有自主复制和引起感染的能力,因此是疫苗研发的理想载体[26]。与其他VLPs相比,NDV-VLPs中蛋白的比例与野生型病毒非常相似,而NDV-VLPs的释放率(84%)高于其他VLPs的释放率(10%~50%)[27]。NDV的HN、F蛋白分别为Ⅰ和Ⅱ型糖蛋白,在不影响自身合成的情况下,其他外源蛋白可通过替换以上2种蛋白胞外域的方式插入到NDV-VLPs中,构成嵌合型病毒样颗粒;也可通过糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚定的方式将外源蛋白展示于VLPs表面,以上构建策略为构建复杂多价、多联的NDV-VLPs提供了可能。
3 NDV-VLPs对DCs成熟的影响
VLPs是DCs的强激活剂,DCs是机体内最强大的抗原递呈细胞(antigen-presenting cells,APC),它们的激活促使B细胞和T细胞免疫介质的启动。DCs活化的第一步是VLPs与DCs表面的模式识别受体(pattern recognition receptor,PRR)结合,然后VLPs内化,之后再进行抗原处理和递呈,以及诱导启动获得性免疫[28-29]。
VLPs疫苗的免疫原性增强归因于它们能与DCs及DCs膜受体相互作用,来诱导更强大、特异性更高的免疫反应。致力于设计具有增强与DCs表面PRR相互作用能力的VLPs,是目前VLPs疫苗开发的主要特点。随着科研人员对DCs PRR和VLPs之间相互作用了解的日益加深,发现VLPs的摄取能力可通过对其结构进行改造来实现,其中包含肽序列可增强其摄取能力,而促进VLPs与DCs PRR相互作用不能达到这一效果[30]。成熟DCs(mature DCs,mDCs)被认为是特异性免疫应答的始动者,是由于mDCs可迁移至次级淋巴组织使初始型T细胞活化和增殖。体外培育的不成熟DCs(imDCs)可高效摄取VLPs,通过上调膜表面主要组织相容性复合体(MHC) Ⅱ类分子和改变细胞骨架结构,诱导其成为mDCs,并分泌炎性细胞因子和趋化因子,进而增强抗原递呈能力[31]。有研究证实,NDV-VLPs可通过TLR4/NF-κB途径诱导DCs成熟,导致MHC Ⅱ、共刺激分子和促炎细胞因子(γ干扰素(IFN-γ)和白细胞介素-12(IL-12))上调,同时还会上调DCs表面CCR7的表达,导致DCs在体外和体外向CCL19/CCL21迁移(图2)[32]。 这些结果为NDV-VLPs诱导DCs的成熟和迁移提供了新的见解,可更好地理解了VLPs诱发的先天免疫反应。

图2 NDV-VLPs激活DCs成熟和迁移的示意图[32]Fig.2 Schematic diagram of NDV-VLPs activated DCs maturation and migration[32]
丁佳欣等[33]通过NDV-VLPs(M+HN)刺激小鼠DCs来评价其成熟表征,结果显示,该颗粒可被DCs有效吞噬并递呈给初始型T细胞,来诱导DCs表面MHC Ⅱ和共刺激分子显著上调及促进DCs分泌促炎性细胞因子。Qian等[34]也对NDV-VLPs(M+HN)进行了研究并对其免疫原性进行了评价,结果显示,来自不成熟骨髓的DCs对NDV-VLPs的刺激是通过上调MHC Ⅱ、CD40、CD80和CD86分子的表达及增加细胞因子肿瘤坏死因子-α(TNF-α)、IFN-γ、IL-6和IL-12 p70的分泌来实现的。此外,NDV-VLPs不仅能增强DCs的免疫刺激能力及自身T细胞增殖,还能诱导小鼠产生有效的免疫应答,并能将成熟的DCs聚集到脾脏,表现为脾脏CD11c+、CD86+细胞的双阳性增殖明显增加。综上所述,NDV-VLPs可诱导DCs成熟,这为VLPs激活天然免疫应答提供了依据,且为NDV-VLPs成为疫苗候选载体打下基础。
4 NDV-VLPs疫苗
由于VLPs疫苗具有高制备率和引起强免疫应答的特点,因此可将其作为构建包括人类病毒在内的其他病毒疫苗的研发平台[35]。就NDV而言,VLPs是由病毒的多种结构蛋白组装而成的纳米级颗粒,表面有重复高密度的抗原表位,可诱导良好的黏膜免疫、体液免疫和细胞免疫应答;不含有病毒核酸有利于彻底清除ND,VLPs的种种优势恰好弥补了ND传统疫苗的不足[36]。目前,NDV-VLPs技术已成为NDV疫苗研究领域的一大热点,并获得了显著成果,这也为其他病毒组装成VLPs提供了技术平台[37]。然而,该疫苗的研发还面临一些问题,如基于VLPs疫苗的研发一般都较为复杂,且在每种新的VLPs使用之前必须评估佐剂效果和炎症反应,同时VLPs的纯化过程需使用密度梯度甚至层析,因此该疫苗的制备不仅难度大、耗时长且价格昂贵[38]。
4.1 基因Ⅶ型NDV-VLPs疫苗
4.1.1 基因Ⅶ型NDV-VLPs疫苗的制备 NDV基因型众多,不匹配的基因型导致疫苗的应用不能对禽群提供全面的保护,会使禽群中持续存在NDV和具有不典型的临床症状的病禽,不但给家禽养殖业造成经济损失,还会使野生菌株向毒力更强的菌株进化。Li等[39]用NA-1株攻毒后,F48E9株(基因Ⅸ型)和NA-1株疫苗(基因Ⅶ型)对鸡的免疫保护率分别为60%和90%,对鹅的保护率分别为70%和100%,且当疫苗株与流行毒株基因型不一致时会降低保护率,可见选择与当前流行毒株相匹配的基因型可降低传统疫苗存在的免疫偏差。对国内ND的流行情况进行调查后发现,基因Ⅶ型NDV广泛流行于不同种类宿主之间,因此基于基因Ⅶ型的NDV-VLPs候选疫苗株的研制势在必行,且在NDV的防控领域具有较好的发展前景[40]。
Xu等[41]利用Ⅶ型NDV(NA-1株),采用杆状病毒表达载体系统研制了一种基因型匹配的新型NDV-VLPs候选疫苗株。研究发现,该疫苗单独或与明矾佐剂联合使用足以保护商业鸡免受致死攻击,且与商品化的LaSota灭活疫苗相比,NDV-VLPs在肺脏组织中的脱落和病毒载量均显著减少,表明NDV-VLPs是一种很有前景的候选疫苗株,可用于现场控制Ⅶ型NDV。袁乾亮等[42]同样利用昆虫细胞/杆状病毒表达载体系统,将已构建编码NDV的M、F和HN基因的3种单顺反子重组杆状病毒粒子共同感染SF9昆虫细胞,制备了基因Ⅶ型NDV-VLPs疫苗,将其以含25 μg蛋白的剂量免疫蛋鸡后,发现可产生较高水平的HI抗体,且减少了攻毒鸡的排毒时间,从而减少NDV在健康鸡群中的传播机会。Xu等[43]将BCSP31基因融合到GPI锚定序列中,利用昆虫杆状病毒表达系统表达GPI-BCSP31蛋白,并与一种表达NDVM基因的重组杆状病毒(rBV-M)和rBV-GPI-BCSP31共感染NDV-VLPs。由此产生的嵌合病毒样颗粒在体外和体内均能有效地诱导DCs成熟,同时增加细胞内IFN-γ和IL-4水平,从而产生良好的免疫原性。
4.1.2 基因Ⅶ型NDV-VLPs的免疫效力 为评估基因Ⅶ型NDV-VLPs的免疫效力,袁乾亮等[44]将80只1日龄商品蛋鸡随机分为NDV-VLPs、NDV-VLPs联合铝佐剂(NDV-VLPs+Alum),LaSota灭活油乳商品疫苗(inactivated LaSota/commercial vaccine)、空白对照(PBS 0.01 mol/L,pH 7.4)4组。且每周定时进行HI抗体水平监测,免疫7周后以同样剂量二次免疫。二次免疫3周后以NA-1(1×106ELD50/0.1 mL)毒株进行攻毒试验。结果显示,NDV-VLPs+Alum免疫组于免疫后3周HI抗体达到峰值(7.5 log2),高于其他3组。各免疫组HI抗体达到峰值后均有降低,但NDV-VLPs免疫组降低得更快。 总体来说ND-VLPs产生HI抗体周期较短,而NDV-VLPs+Alum产生HI抗体维持时间较长。还有研究发现,与接种LaSota灭活苗的鸡相比,接种NDV-VLPs疫苗的鸡肺脏组织中具有较低的组织病毒载量和较短的病毒脱落期,这表明该疫苗在控制和消除ND方面作用显著[45-46]。
4.2 NDV和高致病性禽流感病毒双价VLPs疫苗
ND和高致病性禽流感(highly pathogenic avian influenza,HPAI)是禽类的两种主要致死性疾病,感染后均会导致严重的呼吸系统症状,死亡率高达100%,OIE将其列为A类疫病。ND和HPAI疫苗早已在禽类养殖业广泛使用,为了方便免疫和区分感染方式,科研人员对NDV和高致病性禽流感病毒(High pathogenic avian influenza virus,HPAIV)双价VLPs疫苗进行了探索[47]。目前在表达HPAIV-HA、M1和F/HA蛋白的昆虫细胞系中构建嵌合VLPs二联苗是一种广泛应用的方式,其中F/HA蛋白是一种含有NDV-F蛋白外区的嵌合蛋白,可与HPAIV-HA蛋白的跨膜区和细胞质结构域(TM/CT)融合。秦岭松[48]将H9N2型AIVHA基因与NDVHN基因融合并引入DCpep多肽制备二联嵌合型病毒样颗粒,能够诱导针对NDV和H9N2亚型AIV的双重免疫保护,且黏膜免疫应答增强。Shen等[49]以禽流感病毒M1蛋白为骨架,构建了含有禽流感病毒HA基因和NDVHN基因胞外片段的病毒样颗粒,该嵌合VLPs疫苗可完全抵抗高致病性NDV(F48E9株)的攻击,且在单次免疫雏鸡(10 μg/只)后就可诱导高水平的HPAIV和NDV抗体,还可通过NP-CELISA和HI试验对疫苗接种和自然感染动物进行区分。总之,使用昆虫病毒杆状表达系统产生嵌合VLPs为家禽抵御HPAIV和NDV提供了一种实用的解决方案,这些方法也将在开发其他病原体的双价疫苗方面发挥作用[50]。
4.3 NDV-VLPs在呼吸道合胞病毒中的应用
呼吸道合胞病毒(Respiratory syncytial virus,RSV)是导致婴幼儿细支气管炎的最主要原因,调查显示,全球5岁以下儿童因RSV造成的相关性急性下呼吸道感染每年约3 300万例,死亡率为1%~3%[51-52]。该病的发生不断威胁着儿童的健康,其中IgM的检测对该病的诊断具有指导意义,与此同时科研人员也正致力于疫苗的研发[53]。
RSV表面暴露的F和G糖蛋白是中和抗体的关键靶点,其中,F蛋白是膜融合和感染所必需的,可在病毒组装、融合和感染过程中发挥重要作用[37,54-55]。棉鼠是公认的RSV标准动物模型,比小鼠更易受到RSV感染,Blanco等[56]利用棉鼠的母体免疫模型,对含RSV F和G蛋白稳定融合后的NDV-VLPs疫苗有效性进行了评估,结果显示,在孕期对棉鼠进行接种,仅通过1次免疫就可有效地增强母体内已存的RSV抗体,加强对后代的保护并减少RSV感染相关的幼鼠肺部炎症,同时,对融合前后的2种疫苗进行比较发现,VLPs疫苗显示出一定的优越性[57]。McGinnes等[58]将RSV的F和G蛋白同时整合到NDV-VLPs骨架中,经小鼠免疫攻毒保护试验证实,以NDV-VLPs为骨架的RSV疫苗与其他非复制型RSV候选疫苗相比,具有较好的免疫保护效果。
综上所述,含RSV F和G蛋白的NDV-VLPs能诱使动物机体产生抗体,含有稳定的前融合蛋白的VLPs在诱导中和抗体方面比主要含有融合后的VLPs更有效,将F蛋白的融合形式包含在VLPs-RSV候选疫苗株中,可激发与保护性反应相关的所有位点的抗体,具有很好的免疫保护作用,该类NDV-VLPs在疫苗的研究领域将具有重要作用,也有望应用在人轮状病毒治疗方面。
5 展 望
近年来,随着现代分子生物学和高通量全基因组测序技术的出现,科研人员对NDV生物学特性的了解正在逐步加深,对NDV-VLPs的研究也不断深入,其在疫苗研究方面的应用,不仅对ND的防控提供帮助,还对其他疫苗的研制提供了新的思路。因为VLPs不可复制,不具有传染性病毒载体感染的风险,以NDV-VLPs为基础研制的疫苗安全性可得到保证。
VLPs的正确设计不应仅基于病毒结构蛋白的过度表达,还必须考虑病原体感染的分子机制、VLPs内化所附着的靶PRR及所需的免疫反应类型。VLPs也可设计用于治疗过敏性疾病,因为VLPs免疫可将免疫反应从辅助型T细胞2(T helper 2 cell,Th2)切换到辅助型T细胞1(T helper 1 cell,Th1)。由于VLPs可恢复免疫反应、交叉呈现和诱导细胞毒性T淋巴细胞反应,也可用于未来的癌症治疗。
准确设计的VLPs使其成为非常有吸引力的候选载体,该载体旨在生产针对传染病的病原体,以及用于过敏性疾病的治疗、恶性肿瘤的个性化治疗和良性肿瘤转化治疗的疫苗研制,为今后VLPs疫苗的研发搭建了一个坚固桥梁。尽管VLPs疫苗具有较高的安全性和免疫原性,以及可刺激细胞免疫、不依赖鸡胚等诸多优点,但目前VLPs疫苗主要是通过基因工程手段从酵母或感染重组杆状病毒的昆虫细胞中制备,人工VLPs主要通过化学合成手段获得,两者在技术上仍存在一定的难度,并且对操作者及操作条件均有较高的要求。另外,VLPs在存储、运输和使用等方面也存在着不便,如果能进一步降低成本和生产技术难度,将会得到广泛的实际应用。

