卵巢肿瘤去泛素化酶7A基因与鹅肥肝形成关系的研究
孙青云,范 翔,邢 娅,赵敏孟,刘 龙,耿拓宇,龚道清
(扬州大学动物科学与技术学院,扬州 225009)
鹅肝是具有较高经济价值的产品,经填饲后鹅肝可以增大8~10倍而不发生明显的病理症状[1],而人体肝脏脂肪聚集过多则会导致脂肪肝,易发展为非酒精性脂肪性肝炎、肝硬化甚至肝癌,这表明鹅肝脏中存在着某种脂肪耐受机制[2]。以往研究表明,鹅肥肝具有一些不同于哺乳动物脂肪肝疾病的特点,如鹅肥肝中脂肪酸去饱和酶升高及内质网应激基因表达下降[3]、脂联素受体基因表达增加[4]、肿瘤坏死因子-α(TNF-α)表达减少[5]、线粒体相关基因表达增加[6]和补体基因表达被抑制[7]等。非酒精性脂肪肝(NAFLD)通常与高血糖、高胰岛素血症和高血脂有关,作者所在研究团队前期研究发现,脂肪肝形成相关因子葡萄糖、胰岛素、油酸、亚油酸、棕榈酸等对鹅肥肝中胰岛素样生长因子结合蛋白2、己糖激酶基因的表达有一定调控作用[8-9]。王倩[9]报道,较高浓度的葡萄糖和饱和脂肪酸可诱导鹅原代肝细胞中己糖激酶1(HK1)基因的表达,而较高浓度的胰岛素和不饱和脂肪酸可抑制鹅原代肝细胞中HK1基因的表达。目前,鹅肥肝形成中的脂肪耐受机制尚不完全明确,对其进行研究有助于揭示鹅肥肝的形成机理,也可为其他畜禽和人类脂肪肝的研究提供参考。
卵巢肿瘤去泛素化酶7A(OTUD7A)又名细胞锌指结构抗NF-κB 2(CEZANNE)酶,属于卵巢肿瘤去泛素化酶家族的成员之一,该家族成员参与核因子κB(NF-κB)信号通路、干扰素信号通路和p97介导过程等多条信号通路的调控[10]。对哺乳动物的研究发现,肝脏组织的炎症反应是肝脏从脂肪变性发展为肝炎的重要生理过程[11]。NF-κB通路是其中关键促炎信号途径[12]。据报道,OTUD7A基因可通过调控靶蛋白去泛素化,抑制NF-κB信号通路,进而在抑制炎症反应中发挥作用[10,13]。因此,推测OTUD7A基因可能参与鹅肥肝的形成。但目前OTUD7A基因在鹅肥肝形成中的生理功能尚不清楚。本试验主要应用实时荧光定量PCR技术测定不同填饲阶段朗德鹅肝脏中OTUD7A基因的表达水平,以及不同浓度葡萄糖、胰岛素及脂肪酸处理对鹅原代肝细胞中OTUD7A基因表达水平的影响;利用转录组测序技术分析在鹅原代肝细胞中转染OTUD7A过表达载体对细胞功能的影响,旨在探索OTUD7A基因在脂肪肝形成中的作用,也为阐明鹅肥肝形成的机理提供参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂 Trizol Universal总RNA提取试剂盒、快速质粒小提试剂盒均购自天根生化科技(北京)有限公司;HisScriptTMQ RT SuperMix for qPCR反转录试剂盒、Vazyme AceQTMqPCR SYBR Green Master Mix试剂盒均购自诺唯赞生物有限公司;DMEM高糖培养基、DMEM低糖培养基、Opti-MEM培养基、胎牛血清(FBS)均购自Gibco公司;青霉素-链霉素购自上海碧云天生物技术研究所;PBSC10010(pH 7.4)购自扬州必帮生物技术有限公司;红细胞裂解液、DMSO、葡萄糖均购自Solarbio公司;表皮生长因子(EGF)购自PEPROTECH公司;Ⅳ型胶原酶购自Worthington公司;胰岛素、油酸钠、棕榈酸钾均购自Sigma公司;Lip2000 Transfection Reagent购自Biosharp公司;pcDNA3.1-OTUD7A载体、空载体均购自苏州吉玛生物科技有限公司;氯化钠、氯仿、异丙醇、无水乙醇等其他试剂均购自国药集团化学试剂有限公司。
1.1.2 试验动物 试验用朗德鹅由淮安笠诚畜禽养殖公司提供。 选取同批孵化、相同饲养条件下体重一致(3.6~3.8 kg)的70日龄朗德鹅公鹅40只。
1.2 方法
1.2.1 朗德鹅分组及处理 40只朗德鹅公鹅随机分为对照组和试验组(填饲组),每组20只。填饲饲料配制:将玉米颗粒倒入锅中煮沸5 min后取出沥干,加入1%植物油和1%食盐,每10 kg玉米添加20 g复合维生素,充分搅拌均匀后立即填饲。玉米购自吉林德惠;复合维生素购自扬大饲料厂(每g复合维生素组成:维生素A 5 000 IU,维生素D 1 000 IU,维生素E 7.50 IU,维生素K 0.75 mg,维生素B1 1 mg,维生素B2 2 mg,维生素B6 1.50 mg,维生素B12 0.01 mg,烟酸 30 mg,泛酸 6 mg,叶酸 0.25 mg,生物素 0.10 mg)。填饲方法参考Osman等[14]方法进行,填饲饲料现用现配。填饲的第1~5天每日采食量为500 g,每天分3次进行填饲;填饲第6~12天每日采食量为800 g,每天分4次进行填饲;填饲第13~19天每日采食量为1 200 g,每天分5次进行填饲。对照组饲喂同样的饲料,自由采食,每天每只鹅采食120~130 g。填饲第7、14、19天时,从对照组和填饲组随机选取6只鹅屠宰。取肝脏样品装入1.5 mL RNase-free冻存管中,液氮浸泡后于-80 ℃保存,用于OTUD7A基因mRNA表达水平的测定。
1.2.2 鹅原代肝细胞的分离培养 试验选用孵化23胚龄的朗德鹅鹅蛋,采用1 mg/mL Ⅳ型胶原酶消化分离鹅原代肝细胞,分离后肝细胞的培养参照洪胜辉等[15]方法进行。按6×105/孔的密度进行接种,并转移至37 ℃、5% CO2培养箱中进行培养;培养6 h后,用PBS漂洗以去除未贴壁细胞,更换新的DMEM完全培养基(100 mL DMEM基础培养液中加入10 mL FBS、1 mL青霉素-链霉素混合液(100 IU/mL)、20 μL EGF工作液(20 ng/mL)),于37 ℃、5% CO2培养箱中继续培养。
1.2.3 脂肪肝形成相关因子处理鹅原代肝细胞 脂肪肝形成相关因子处理浓度参考Osman等[14]。当鹅原代肝细胞生长汇合度达70%时,分别用含0(空白组)、125、250 mmol/L葡萄糖溶液,0(空白组)、50、100、200 nmol/L胰岛素溶液,0(空白组)、0.125、0.250 mmol/L油酸、亚油酸溶液,0(空白组)、0.25、0.50 mmol/L棕榈酸的DMEM完善培养基处理鹅原代肝细胞,每个处理组6个重复。各组细胞添加相应培养液后,放入CO2培养箱中培养24 h,收集细胞备用。
1.2.4 RNA提取、cDNA合成及实时荧光定量PCR检测 用Trizol法提取朗德鹅肝脏及鹅原代肝细胞RNA,反转录合成cDNA。根据GenBank中OTUD7A基因序列(登录号:NC_030817.1)用Primer Premier 5.0软件设计引物,引物信息见表1。以GAPDH为内参基因,进行实时荧光定量PCR。PCR反应体系20 μL:SYBR®Premix ExTaq(2×) 10 μL,ROX Reference Dye Ⅱ (50×) 0.4 μL,上、下游引物各0.4 μL,cDNA模板2.0 μL,ddH2O 6.8 μL。PCR反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。目的基因表达水平用2-ΔΔCt法进行计算。

表1 引物信息Table 1 Primer information
1.2.5OTUD7A基因过表达载体构建及转录组学测序
1.2.5.1OTUD7A基因过表达载体构建及验证 由苏州吉玛生物科技有限公司合成过表达载体pcDNA3.1-OTUD7A,用PCR方法得到OTUD7A基因序列片段,分别酶切OTUD7A基因与pcDNA3.1载体,并对纯化后产物进行连接。将连接产物转化大肠杆菌DH5α感受态细胞,对形成的克隆先进行酶切鉴定,证明目的基因已经定向连入目的载体。对阳性克隆进行测序和分析比对,比对正确的即为构建成功的目的基因表达质粒载体。将构建好的重组载体进行超纯抽提得到pcDNA3.1-OTUD7A载体。按照快速质粒小提试剂盒说明书进行过表达载体质粒提取操作。待鹅原代肝细胞生长汇合度达70%时,按照Lip2000(biosharp)说明书进行转染试验。转染6 h后,用预热的PBS清洗3遍,更换为DMEM完全培养基,在37 ℃的细胞培养箱中继续培养24 h后收集细胞,按照1.2.4的方法进行RNA提取、反转录并用实时荧光定量PCR验证过表达是否成功。
1.2.5.2 转录组学测序 将空载体(pcDNA3.1)转染组和过表达OTUD7A基因的鹅原代肝细胞进行RNA-Seq分析。RNA-Seq由上海派森诺生物科技股份有限公司完成。对测序数据进行过滤后,通过Bowtie2建立参考基因组索引,使用Tophat2软件将过滤后的Reads与参考基因组进行对比分析。 其中参考基因组为:鸿雁(登录号:AnsCyg_PRJNA183603_v1.0),得到的Mapping比例为53.55%~61.80%。 采用DESeq R包(1.18.0)进行差异表达基因分析,其筛选条件为:表达差异倍数|log2FoldChange|>1,P<0.05表示差异显著。P值使用Benjamini和Hochberg方法进行校正。使用GOseq软件(Release2.12)进行GO功能富集分析。先将全部基因映射到GO数据库的条目,计算各个条目的差异表达基因数目,再以整个基因组为背景,用超几何分布计算差异表达基因显著富集的条目。
1.3 数据统计与分析
用SPSS 16.0软件采用t检验进行差异显著性分析,结果用平均值±标准误表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 填饲对朗德鹅肝脏中OTUD7A基因表达的影响
由图1可知,在填饲第7和14天时,填饲组鹅肝脏中OTUD7A基因的表达显著高于对照组(P<0.05)。而在填饲第19天时,填饲组鹅肝脏中OTUD7A基因的表达极显著低于对照组(P<0.01)。

*,差异显著(P<0.05);**,差异极显著(P<0.01)。图3同*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01).The same as fig.3图1 朗德鹅肝脏中OTUD7A mRNA的相对表达水平Fig.1 The relative expression level of OTUD7A mRNA in Landes goose liver
2.2 脂肪肝形成相关因子对OTUD7A基因表达的影响
由图2可知,与空白组相比,125 mmol/L葡萄糖处理对鹅原代肝细胞中OTUD7A基因的表达无显著影响(P>0.05),但250 mmol/L葡萄糖处理显著提高了细胞中OTUD7A基因的表达水平(P<0.05);不同浓度的胰岛素、油酸、亚油酸处理鹅原代肝细胞后,各组间OTUD7A基因的表达水平均无显著差异(P>0.05);与空白组相比,0.25和0.50 mmol/L棕榈酸处理均显著提高OTUD7A基因的表达水平(P<0.05)。

肩标不同字母表示差异显著(P<0.05);肩标相同字母或无字母标注表示差异不显著(P>0.05)Values with different letter superscripts mean significant difference (P<0.05); While with the same or no letter superscripts mean no significant difference (P>0.05)图2 脂肪肝形成相关因子对鹅原代肝细胞中OTUD7A mRNA表达水平的影响Fig.2 Effects of fatty liver formation related factors on OTUD7A mRNA expression level in goose primary hepatocytes
2.3 OTUD7A基因过表达载体的验证
由图3可知,与空载体组相比,过表达组OTUD7A基因mRNA水平的表达量极显著提高(P<0.01),故pcDNA3.1-OTUD7A过表达载体构建成功。
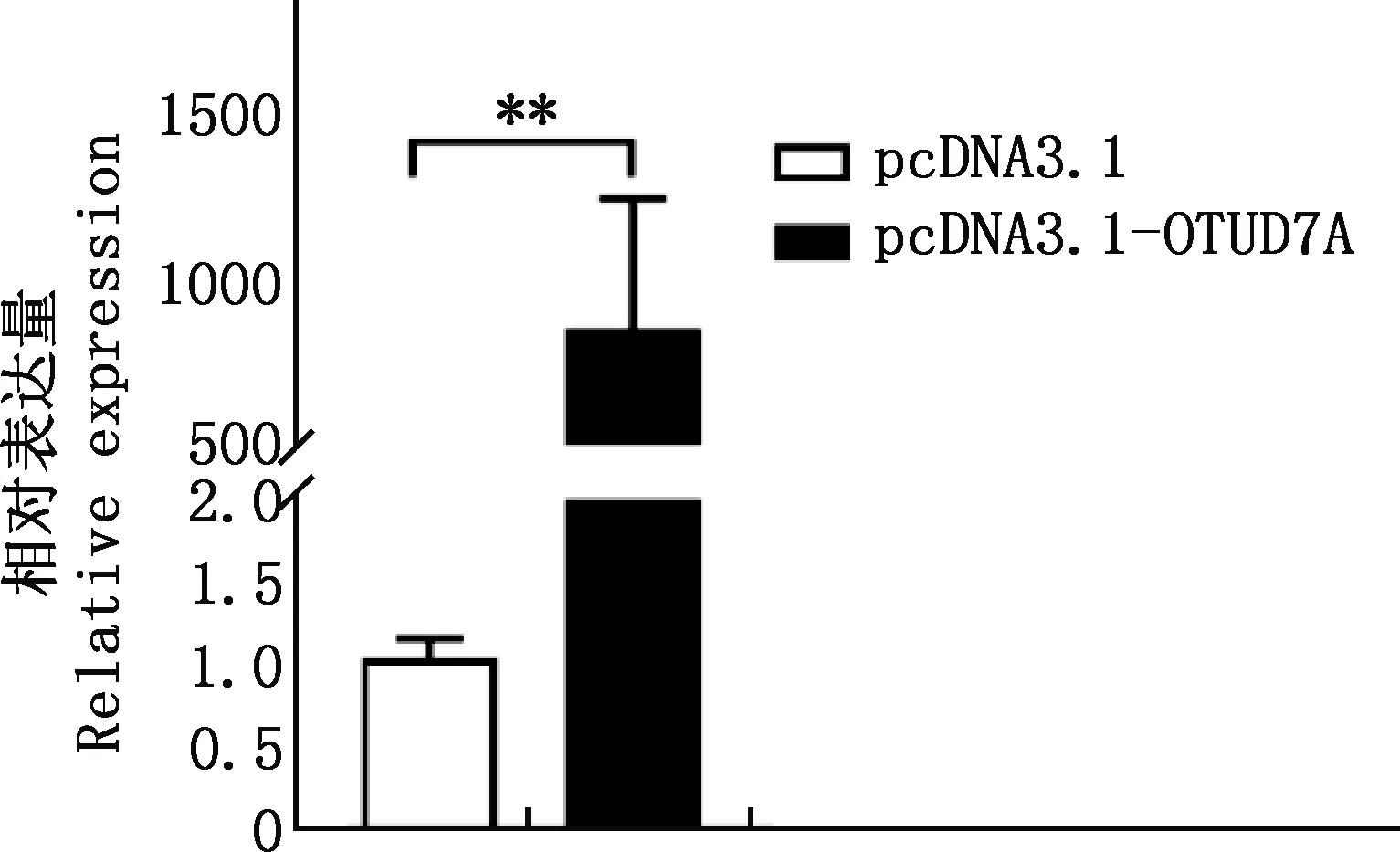
图3 过表达后鹅原代肝细胞中OTUD7A mRNA的表达水平Fig.3 Expression level of OTUD7A mRNA in goose primary hepatocytes after overexpression
2.4 OTUD7A基因过表达后差异表达基因GO功能富集分析
转录组测序结果表明,与空载体组相比,OTUD7A基因过表达后共筛选到34个差异表达基因,其中有19个基因表达上调、15个基因表达下调。对差异表达基因进行GO功能富集分析发现,这些差异表达基因被注释到165条GO条目中。其中,100条被注释到生物过程(biological process),31条被注释到细胞组分(cellular component),34条被注释到分子功能(molecular function)。
由表2可知,生物过程差异表达基因主要富集在对微生物的防御反应(defense response to other organism)、对外界生物刺激的反应(response to external biotic stimulus)、对微生物的反应(response to other organism)、T细胞分化(T cell differentiation)等;在细胞组分方面,差异表达基因主要富集在细胞外区域部分(extracellular region part)、细胞质(cytoplasm)、非包膜细胞器(non-membrane-bounded organelle)、细胞外外泌体(extracellular exosome)、细胞骨架(cytoskeletal part);而在分子功能方面,差异表达基因则主要富集在GTP酶活性(GTPase activity)、水解酶活性(hydrolase activity)、核苷三磷酸酶活性(nucleoside-triphosphatase activity)、肽酶活性(peptidase activity)、催化活性(catalytic activity)等。 其中,CLMP、PROCR、SH3BP1、ARHGAP28、ACE、OTUD7A、LOC106045877、LOC106048002基因的表达上调,TNFSF8、DDX60、PLAC8、RSAD2、MX1、RSAD2、GBP1基因的表达下调。

表2 OTUD7A基因过表达后差异表达基因GO功能富集分析Table 2 GO function enrichment analysis of differentially expressed genes after OTUD7A gene overexpression
3 讨 论
本研究前期数据表明,填饲7、14、19 d后,填饲组朗德鹅肝脏重量分别从填饲前的86.45、92.90、80.63 g增加到填饲后的182.76、416.00和826.00 g[16],证明鹅肥肝模型建立成功。人肝癌细胞试验发现,OTUD7A基因可以通过对肿瘤坏死因子受体相关分子6(TRAF6)基因进行去泛素化调节,起到抑制NF-κB通路的作用[13]。研究表明,通过抑制NF-κB通路,可降低肝脏中炎症因子(如TNF-α)的表达,缓解NAFLD的发展[17]。本研究结果发现,在填饲第7和14天时,填饲组鹅肝脏中OTUD7A基因的表达量显著高于对照组,表明短期填饲可以促进鹅肥肝中OTUD7A基因的高表达,而OTUD7A表达增高可能抑制鹅肥肝中炎症的发生。
哺乳动物NAFLD的形成常伴随着高血糖症、高血脂症和高胰岛素血症[18-19]。据报道,鹅肥肝形成过程中也出现了葡萄糖、胰岛素和脂肪酸升高等现象[20-21]。本研究结果表明,250 mmol/L葡萄糖及0.25和0.50 mmol/L的棕榈酸处理均显著提高OTUD7A基因的表达水平,说明高浓度葡萄糖和低浓度棕榈酸(饱和脂肪酸)可以诱导鹅肝细胞中OTUD7A基因的表达。用油酸(单不饱和脂肪酸)和亚油酸(多不饱和脂肪酸)处理肝细胞后对OTUD7A基因的表达无显著变化,与棕榈酸的处理结果并不相同,这可能是因为饱和脂肪酸和不饱和脂肪酸具有的不同生物学效应。杨彪[4]研究发现,在鹅原代肝细胞中,葡萄糖和油酸提高了脂联素受体2(Adipor2)的表达,胰岛素抑制Adipor2基因的表达,而棕榈酸对其表达无显著影响。可见,当用不同因子处理鹅肝细胞后,不同基因的表达情况不尽相同,可能与这些因子激活不同的信号通路和转录因子有关。
GO功能富集分析发现,差异表达基因主要富集在对其他生物的防御反应、对外界生物刺激的反应、T细胞分化和外泌体等条目。 研究发现,NAFLD患者脂肪肝的严重程度与T细胞亚群的变化有关,当脂肪肝的严重程度增加时,CD8+T细胞数量逐渐下降,CD4+T细胞数量逐渐升高,而增加的CD4+T细胞可通过TNF-α、白细胞介素-1β(IL-1β)的产生参与NAFLD的发生与发展[22]。外泌体作为介导细胞间信号传递的载体,可调节肝细胞与炎症细胞间的信号交流及物质传递,影响单核巨噬系统的活性,起到调节肝脏炎症反应的作用。Ibrahim等[23]研究发现,棕榈酸能激活肝细胞的混合谱系激酶3,使肝细胞释放出含有趋化因子配体10(CXCLl0)的外泌体,进而调节巨噬细胞的活化,加速肝脏损伤。因此,OTUD7A基因可能通过调控对其他生物的防御反应、对外界生物刺激的反应、T细胞分化和外泌体等条目相关基因的表达参与鹅肥肝的形成。
肿瘤坏死因子超家族成员(TNFSF)是由免疫细胞分泌的具有多种生物学效应的细胞因子,TNFSF及其膜受体(TNF-R)相互作用参与调控细胞生长与凋亡、机体炎性反应和免疫应答等[24]。据报道,TNFSF8和其受体TNFRSF8结合后,TNFRSF8通过与TRAF蛋白结合,激活NF-κB信号通路,从而可介导白细胞介素2(IL-2)、白细胞介素6(IL-6)、TNF-α等细胞因子的分泌[25-26]。转录组学结果表明,在鹅原代肝细胞中过表达OTUD7A基因可抑制TNFSF8基因的表达,提示鹅肝脏TNFSF8基因的表达可能受到OTUD7A基因的调控,且OTUD7A基因有可能通过调控TNFSF8基因参与鹅肥肝形成中的炎症反应。
自由基S-腺苷蛋氨酸结构域2(RSAD2)是一种抗病毒蛋白,可被干扰素诱导表达[27]。此外,RSAD2还有一些其他的生物学功能,Qiu等[28]研究发现,RSAD2在NF-κB活性的调节和CD4细胞的分化发育中具有重要作用,在RSAD2基因敲除小鼠中,表现出NF-κB活性的降低,导致细胞因子包括白细胞介素4(IL-4)、白细胞介素5(IL-5)和白细胞介素13(IL-13)的表达水平降低。抗黏液病毒1(MX1)蛋白是Ⅰ型干扰素诱导产生的一类活性蛋白质,在固有免疫反应中发挥重要功能[29]。鸟苷酸结合蛋白1(GBP1)在抗病原微生物中发挥重要作用,α干扰素(IFN-α)、β干扰素(IFN-β)和γ干扰素(IFN-γ)均能够诱导GBP1的表达[30]。本试验结果表明,在鹅原代肝细胞中过表达OTUD7A基因后,RSAD2、MX1和GBP1基因表达水平均显著下调,推测鹅肝脏中RSAD2、MX1和GBP1基因的表达可能受到OTUD7A基因的调控。而RSAD2、MX1和GBP1作为与免疫相关的基因,可能与鹅肝脏中抑制炎症发生过程相关。
CLMP被认为是脂肪细胞黏附分子(ACAM),在啮齿动物和肥胖人类的成熟脂肪细胞中上调。在喂食高脂肪、高蔗糖(HFHS)食物的ACAMTg小鼠中,ACAM在成熟脂肪细胞的质膜上大量表达,其中形成了小带黏附样结构[31]。小带黏附的形成可以增加机械强度,抑制脂肪细胞肥大,提高胰岛素敏感性。蛋白C受体(PROCR)是Th17致病性的负调控因子,下调多个致病特征基因的表达,包括IL-1和IL-23受体[32]。本研究转录组测序结果显示,在鹅原代肝细胞中过表达OTUD7A基因可使CLMP和PROCR基因的表达上调,说明OTUD7A基因可能通过调控CLMP和PROCR基因参与鹅肥肝的形成过程。
4 结 论
综上所述,在朗德鹅填饲前期OTUD7A基因的表达显著上调;250 mmol/L葡萄糖和0.25、0.50 mmol/L棕榈酸处理能显著诱导鹅原代肝细胞中OTUD7A基因的表达,OTUD7A基因通过参与调控TNFSF8、RSAD2、MX1、GBP1、CLMP和PROCR等基因的表达参与鹅肥肝的形成。

