牛源CCR7基因克隆、生物信息学及表达分析
申 祥,陈伶慧,姚竞杰,王三虎,白跃宇,张晓建
(1.河南科技学院动物科技学院,新乡 453000;2.河南省动物卫生监督所,郑州 410100)
CC趋化因子(CC chemokines)又称为β-趋化因子(β-chemokines),是指28种具有N-端CC结构域的趋化细胞因子[1],所有的趋化因子都会特异性地与10个趋化因子受体(1-10)相结合,在淋巴细胞、树突状细胞、嗜酸性粒细胞、巨噬细胞、单核细胞、NK细胞中发挥着重要的作用,对免疫系统细胞行使正常功能至关重要[2]。CC趋化因子受体7(CC chemokine receptor 7,CCR7)属于G蛋白偶联受体超家族,对于正常免疫功能和多种炎症性疾病中的白细胞募集起着关键的作用[3-4]。CCR7在不同类型的白细胞中表达,与趋化因子结合并发出信号,调节白细胞对趋化因子表达量较高部位的黏附和趋化。趋化因子配体和CCR7在一个复杂的网络中相互作用,大多数趋化因子可以激活多个趋化因子受体,而CCL19和CCL21是CCR7仅有的配体[5]。CCR7在T细胞的运输中起着关键的作用,有助于正常的T细胞选择,增强机体对病毒感染的免疫反应和自身免疫反应。此外,CCR7还会促进癌细胞的增殖[6-8]和干细胞分化[9-11]。目前,国内外针对CCR7的研究主要集中在免疫和癌症等方面,与牛炎症相关的报道较少。本研究以中国荷斯坦奶牛为研究对象,使用PCR方法扩增并克隆牛CCR7基因CDS区序列,通过生物信息学方法对其进行分析和预测,利用实时荧光定量PCR方法检测CCR7基因在健康奶牛和患乳腺炎奶牛乳腺组织中的表达差异,以期为奶牛乳腺炎中CCR7基因的分子机制研究提供参考依据。
1 材料与方法
1.1 材料
1.1.1 试验动物 选取河南省某规模化养殖场内4岁左右的健康和金黄色葡萄球菌感染的中国荷斯坦奶牛各3头,采集乳腺组织放入液氮中保存。
1.1.2 主要试剂 大肠杆菌DH5α感受态细胞购自全式金生物技术有限公司;pMD18-T载体、限制性内切酶(NdeⅠ和XhoⅠ)、Taq酶、DL2000 DNA Marker均购自TaKaRa公司;DNA胶回收试剂盒、细胞/组织总RNA提取试剂盒、FastSuper RT Kit cDNA第一链合成试剂盒均购自北京百泰克生物技术有限公司;胰蛋白陈、酵母提取物均购自OXOID公司;琼脂粉、氨苄青霉素、X-Gal、IPTG均购自Solarbio公司。其他试剂如无特殊说明均为国产分析纯。
1.2 方法
1.2.1 引物设计与合成 根据NCBI中牛CCR7基因编码序列(GenBank登录号:NM_001024930.3)和GAPDH内参基因序列(登录号:NM_001034034.2),利用NCBI中的Primer-BLAST设计特异性引物,引物信息见表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 引物序列信息Table 1 Primer sequence information
1.2.2 总RNA提取与cDNA合成 按RNA提取试剂盒说明书提取奶牛乳腺组织RNA,琼脂糖凝胶电泳和NanoDrop分光光度计检测RNA质量及浓度。 按照反转录试剂盒说明书合成cDNA,-20 ℃保存备用。
1.2.3 克隆 PCR扩增体系25 μL:cDNA模板1 μL,PremixTaq12.5 μL,上、下游引物各1 μL,ddH2O补足体系。PCR反应条件:95 ℃预变性5 min;94 ℃变性30 s,64.7 ℃退火1 min,72 ℃延伸90 s;72 ℃延伸10 min;4 ℃保存。PCR产物使用1.0%琼脂糖凝胶电泳检测,利用胶回收试剂盒进行纯化回收,将回收得到的目的条带与pMD18-T载体进行连接。连接体系10 μL:酶切产物1 μL,酶切质粒6 μL,Buffer 2 μL,T4连接酶1 μL。4 ℃过夜连接。连接产物与100 μL大肠杆菌DH5α感受态细胞在冰上混合,30 min后42 ℃水浴90 s,立刻冰水浴2 min;加入900 μL无AMP+培养基,37 ℃、160 r/min摇菌1 min,180 r/min摇1 h;7 000 r/min离心2 min,弃去800 μL,余下的混匀涂板,37 ℃培养过夜。挑取阳性菌落进行菌液PCR验证及测序,测序结果用DNAMAN软件进行序列比对分析。
1.2.4 生物信息学分析 利用NCBI获取不同物种CCR7基因序列:牛(登录号:NM_001024930.3)、犬(登录号:XM_038676552.1)、马(登录号:XM_001500181.5)、猫(登录号:XM_003996833.4)、鸡(登录号:NM_001198752.1)、人(登录号:NM_001301714.2)、小鼠(登录号:NM_001301713.1)、绵羊(登录号:XM_004012868.4)、猪(登录号:NM_001001532.3),并运用软件DNAStar中MegAlign进行相似性比对,利用Mega 7.0软件构建系统进化树。利用ProtParam程序分析蛋白基本理化性质;利用ProtScale程序分析蛋白亲/疏水性;利用SOPMA和SWISS-MODEL程序预测蛋白二级结构和三级结构;利用PSORT Ⅱ软件预测亚细胞定位;利用预测蛋白互作网络关系(https:∥www.genecards.org/);利用SignalP-4.1软件预测蛋白信号肽剪切位点;利用TMHMM 2.0软件分析跨膜结构域,具体网址如表2所示。

表2 生物信息学分析软件Table 2 Bioinformatics analysis softwares
1.2.5 实时荧光定量PCR检测CCR7基因的表达 利用实时荧光定量PCR技术对CCR7基因在健康和炎性奶牛乳腺组织中的表达进行检测。PCR反应体系20 μL:cDNA模板2 μL,上、下游引物(10 μmol/L)各0.8 μL,SYBR®Premix ExTaqTMⅡ 10 μL,RNase-free ddH2O 6.4 μL。PCR反应程序:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸30 s,共35个循环。结果用2-ΔΔCt相对定量分析方法进行分析,采用IBM SPSS Statistics 24.0软件进行t检验分析,结果用平均值±标准差表示,P<0.05为差异显著;P<0.01为差异极显著。
2 结 果
2.1 牛CCR7基因CDS区的克隆
以奶牛乳腺组织cDNA为模板进行CCR7基因CDS区扩增,结果显示,扩增条带清晰明亮,序列长度为1 325 bp(图1),与目的片段大小一致。用TA克隆方法对CCR5基因PCR产物与pMD18-T载体进行连接,测序结果使用DNAMAN软件进行分析后显示,成功克隆了牛CCR7基因的CDS区域序列。
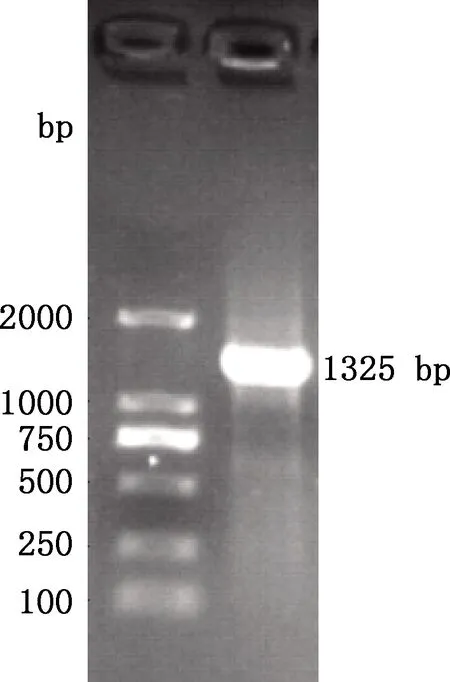
图1 牛CCR7基因CDS区PCR扩增结果Fig.1 PCR amplification results of CDS region of bovine CCR7 gene
2.2 相似性比对和系统进化树构建
通过NCBI数据库检索收集到9个物种CCR7基因编码序列,利用MegAlign软件进行比对分析,结果显示,牛与绵羊之间相似性较高,为95.2%;与鸡相似性较低,为56.4%(图2)。系统进化树显示,牛与绵羊之间的遗传距离最近,而与鸡最远(图3),与相似性分析结果一致。
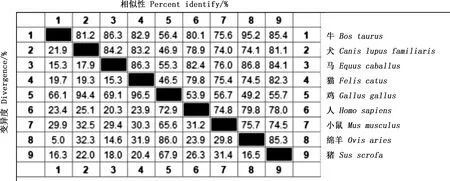
图2 CCR7基因核苷酸序列相似性比对Fig.2 Similarity alignment of nucleotide sequences of CCR7 gene
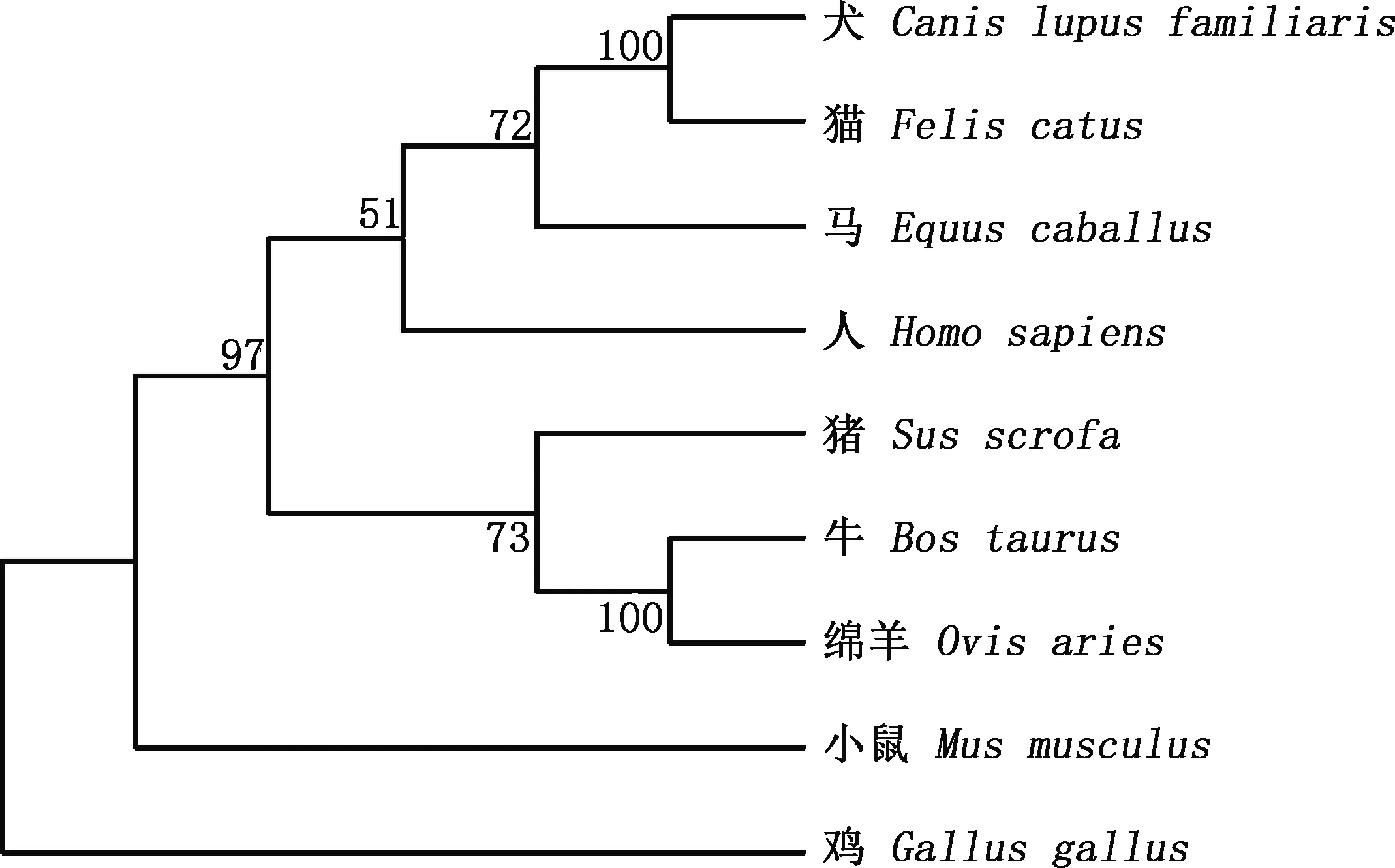
图3 CCR7基因系统进化树Fig.3 Phylogenetic tree of CCR7 gene
2.3 生物信息学分析
2.3.1 理化性质 牛CCR7蛋白编码379个氨基酸,分子质量为14.56 ku,分子式为C1970H3112N486O521S27,有6 116个原子,理论等电点为8.89,预测不稳定系数为31.29,表明该蛋白理化性质稳定。在组成牛CCR7基因编码氨基酸的20种氨基酸中,亮氨酸含量最多,缬氨酸含量次之,组氨酸和色氨酸的含量最低(表3),其中,带负电荷的残基总数(Asp+Glu)为24个,带正电荷的残基总数(Arg+Lys)为34个。
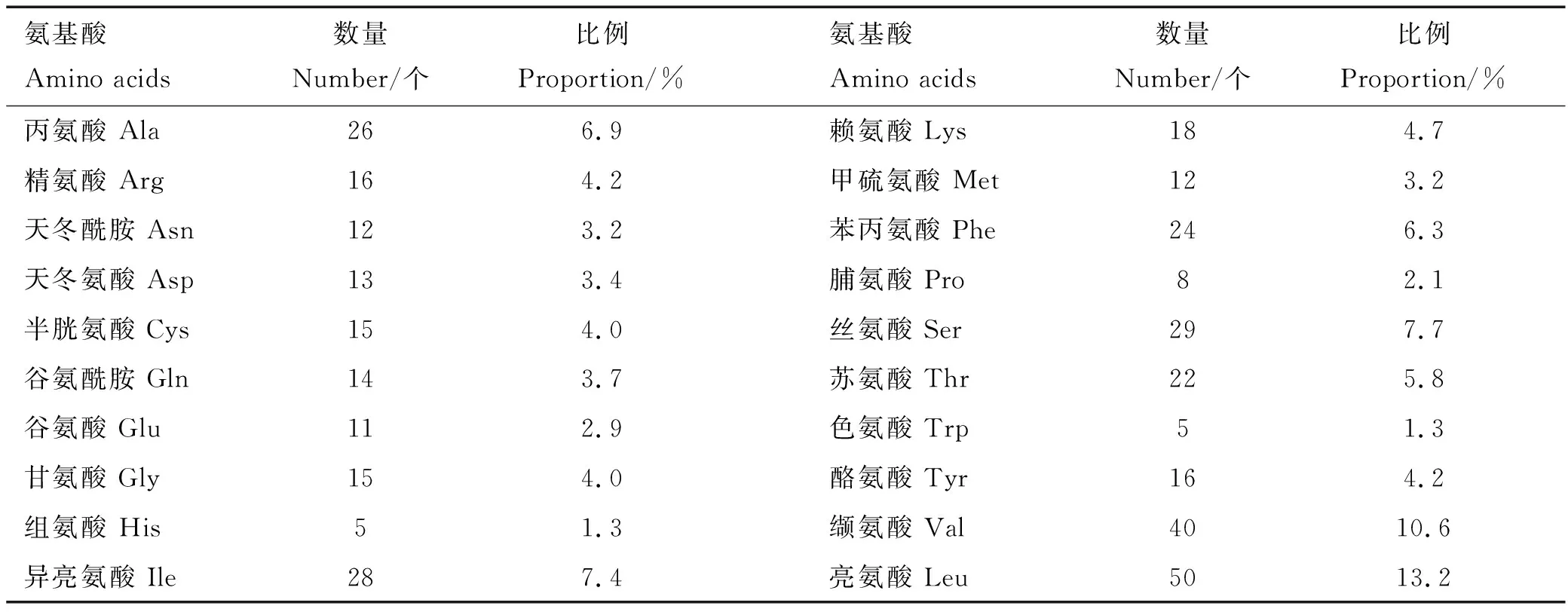
表3 牛CCR7蛋白氨基酸组成Table 3 Amino acid composition of bovine CCR7 protein
2.3.2 信号肽和跨膜螺旋结构 SignalP-4.1软件预测结果显示,牛CCR7蛋白信号肽切割位点可能存在于第24和25位氨基酸之间(图4)。 TMHMM 2.0软件预测结果显示,牛CCR7蛋白存在6个跨膜结构,分别位于第63-85、97-116、131-150、171-190、229-251及264-286位氨基酸处(图5)。

图4 牛CCR7蛋白信号肽预测Fig.4 Signal peptide prediction of bovine CCR7 protein
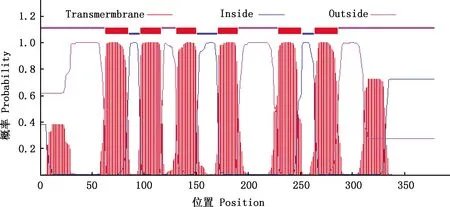
图5 牛CCR7蛋白跨膜结构域预测Fig.5 Transmembrane domain prediction of bovine CCR7 protein
2.3.3 亲/疏水性分析 亲/疏水性分析结果显示,牛CCR7蛋白整个多肽中第269位缬氨酸分值最高(3.844),疏水性最强;第256位苯丙氨酸分值最低(-2.478),亲水性最强。平均亲水系数(GRAVY)为0.640,表明该基因编码蛋白为疏水性蛋白(图6)。

图6 牛CCR7蛋白疏水性预测Fig.6 Hydrophobicity prediction of bovine CCR7 protein
2.3.4 二级结构和三级结构 牛CCR7蛋白二级结构主要由α-螺旋、 β-转角、 延长链及无规则卷曲构成,占比分别为51.72%、1.85%、14.78%和31.65%(图7)。CCR7蛋白三级结构主要为α-螺旋和无规则卷曲(图8)。蛋白互作分析显示,牛CCR7蛋白可能与CCL19、CCL21、CD247等蛋白之间存在互作(图9)。
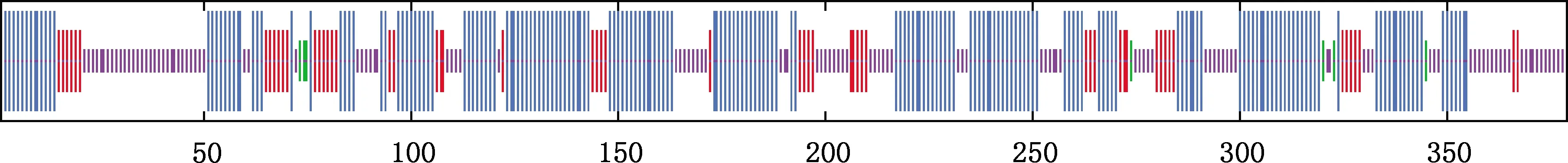
最短竖线,无规则卷曲;较短竖线,β-转角;较长竖线,延伸链;最长竖线,α-螺旋The shortest vertical line,Random coil;The shorter vertical line,Beta turn;The longer vertical line,Extended chain;The longest vertical line,Alpha helix图7 牛CCR7蛋白二级结构预测Fig.7 Secondary structure prediction of bovine CCR7 protein
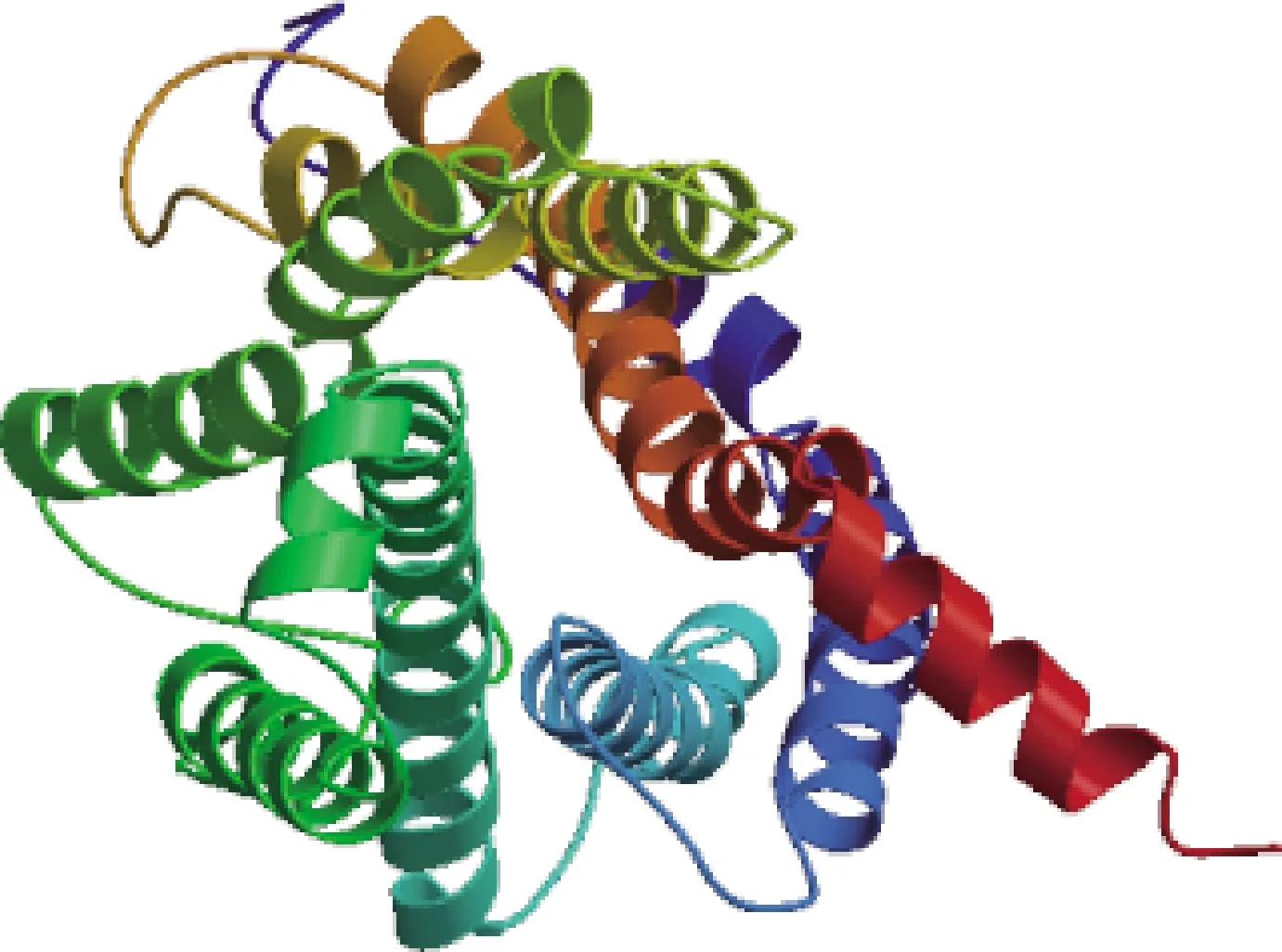
图8 牛CCR7蛋白三级结构预测Fig.8 Tertiary structure prediction of bovine CCR7 protein

图9 牛CCR7蛋白相互作用分析Fig.9 Interaction analysis of bovine CCR7 protein
2.3.5 亚细胞定位 亚细胞定位发现,牛CCR7蛋白主要存在于细胞质中(66.7%),线粒体(22.2%)和细胞外(11.1%)也有分布,推测其可能是一种跨膜蛋白。
2.4 CCR7基因在健康和炎性奶牛乳腺组织中的表达量
实时荧光定量PCR结果显示,CCR7基因在健康奶牛乳腺组织中的表达量极显著低于炎症奶牛乳腺组织(P<0.01,图10)。
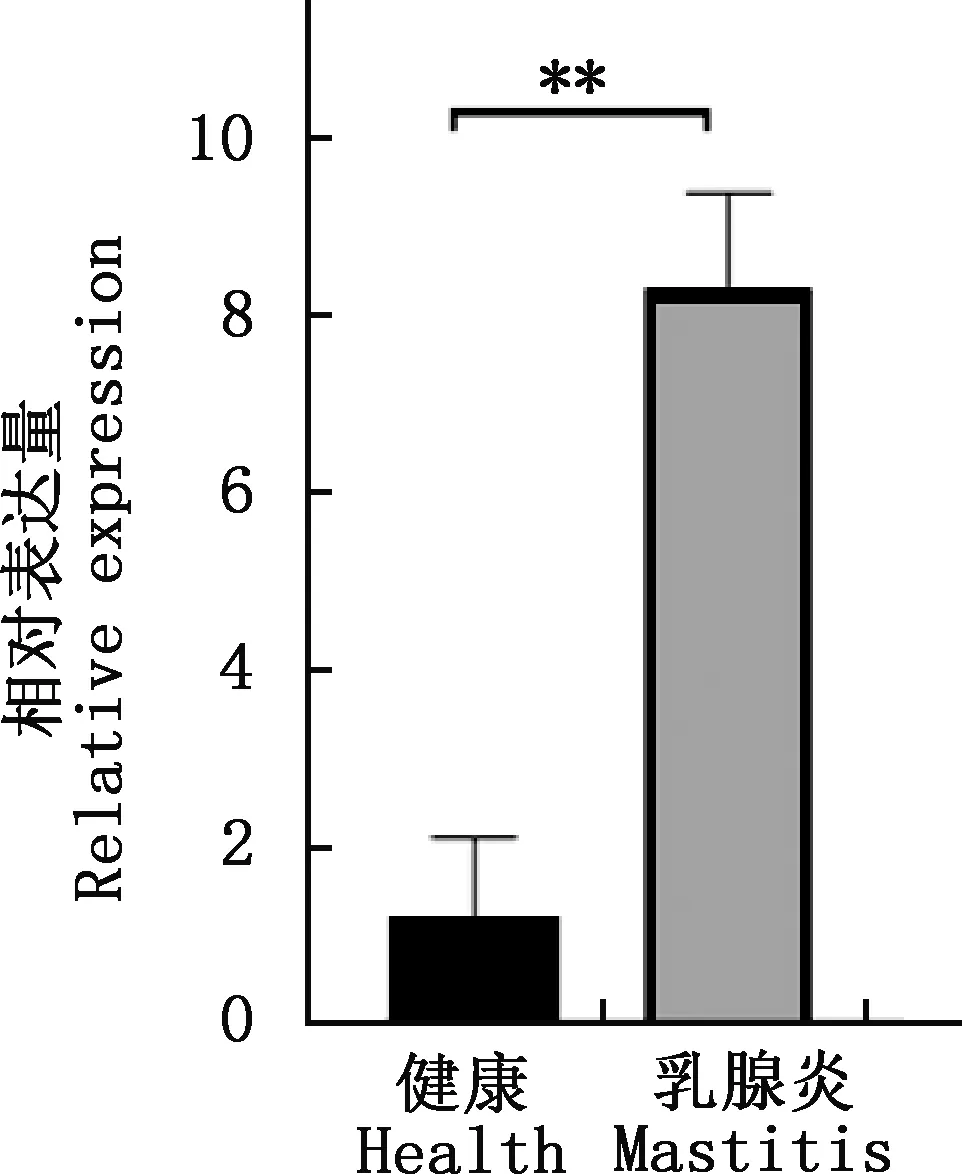
**,差异极显著(P<0.01)**,Extremely significant difference (P<0.01)图10 CCR7基因在健康和炎性奶牛乳腺组织中的表达差异Fig.10 The expression difference of CCR7 gene in breast tissues between healthy and inflammatory dairy cows
3 讨 论
20世纪末,Birkenbach等[12]使用爱泼斯坦-巴尔病毒(Epstein Barr virus,EBV)感染B细胞时,发现了一种新的产物并把它命名为EBI-1,之后Yashida等[13]将其改名为CCR7,CCR7逐渐成为趋化因子受体中的热门研究对象之一。CCR7主要通过淋巴细胞表达[14-15],在与其配体CCL21结合后,可使细胞内的肌动蛋白聚合,引起钙离子向细胞内流动,细胞形成伪足[16],调控淋巴细胞归巢,启动适应性免疫反应,并促进细胞增殖,但如果这些调节出现问题时,会导致一些慢性炎症性疾病和肿瘤疾病的发生[17]。据报道,在黑色素瘤、胃癌、胰腺癌、卵巢癌、甲状腺癌、食管癌、乳腺肿瘤、肺癌等疾病中都发现了CCR7蛋白的表达出现异常[9,18-21,22-23]。 CCR7在肿瘤患者中的表达与CCL21水平呈显著正相关,CCR7趋化因子轴由CCR7-CCL21和CCR7-CCL19组成,其对于癌症来说有2个重要的作用:一是该轴明显与多个效应细胞的运输过程有关,这些效应细胞会对生长中的肿瘤产生免疫应答作用,说明阻止癌症蔓延的治疗过程中可能会涉及到增强该轴的作用;二是CCR7轴在肿瘤细胞向淋巴系统的迁移和转移中发挥着重要的作用,其会导致癌症的扩散和加重,说明如果减少CCR7轴信号传导的话,可能会有利于癌症的预防和治疗[24]。研究表明,CCR7-CCL21轴通过激活JAK2/STAT3信号通路调控上皮细胞向间质细胞的转化,增加口腔鳞状细胞癌(OSCC)的细胞干性,推测CCR7-CCL21可能会作为OSCC预防和治疗过程中的一个有效靶点[11]。CCR7在肿瘤转移的预防及治疗等方面存在巨大的潜力,其可作为肿瘤标记物,通过检测CCR7及其相关蛋白和因子的表达来预测肿瘤的诊断和转移方向,从而对肿瘤的临床治疗提供一定的指导。本试验预测了CCR7编码蛋白的性质和结构,对将CCR7用于肿瘤的防治提供一定的参考。
CCR7通过多种途径参加了许多炎性疾病的发生,利用抗体或药物来控制CCR7基因的表达可能会是今后治疗这些炎症疾病的一个重要策略。研究发现,在人类哮喘疾病中,CCR7与CCL21之间的相互作用会导致树突状细胞成熟并向T细胞递呈抗原,从而促使T细胞活化产生气道炎症反应,患者血清及大鼠肺脏组织中CCR7基因表达量明显增高,经过药物治疗后模型小鼠体内的CCR7基因表达水平明显下降[25],风湿关节炎患者的滑膜组织中CCR7基因表达量明显升高,患者血浆中CCR7基因表达量也会升高[26];CCR7与CCL21的相互作用还会导致巨噬细胞向着分泌IL-6和IL-23的M1细胞转化,而M1细胞又会让T细胞分化为Th17细胞,从而诱导破骨细胞的生成,加剧患者的病情[27]。Kawashima等[28]研究发现,慢性肠炎患者肠系膜淋巴结中CCR7基因mRNA高表达,推测CCL21和CCR7+T细胞可能会产生Th1优势免疫应答反应,从而形成慢性肠炎的一种免疫反应机制。综上所述,CCR7基因在炎性疾病的发生中起着重要的作用,抑制CCR7基因表达可以对炎症疾病的治疗产生积极的作用。本试验中,实时荧光定量PCR结果显示,在炎性乳腺上皮细胞中CCR7基因表达量极显著增高,与上述研究结果具有一致性。
4 结 论
试验成功克隆了牛CCR7基因,其CDS区片段全长1 325 bp,编码379个氨基酸,属于疏水性跨膜蛋白,与绵羊相似性较高,亲缘关系较近,其二级结构、三级结构均主要由α-螺旋和无规则卷曲构成。定量结果显示,CCR7基因在健康牛乳腺组织中的表达量极显著低于炎性牛乳腺组织。

