线粒体自噬在脑出血中的神经保护机制研究概述
张柏雯 邹伟

〔摘要〕 线粒体自噬发生于脑出血原发性损伤和继发性损伤中,并与脑出血后受损脑组织周围发生的多种生物学效应密切相关,因此探究线粒体自噬对脑出血神经保护机制至关重要。由于脑内微环境在病理状态下的变化,导致多种细胞状态如炎症、凋亡、自噬等发生并对脑神经产生一定的影响,故本文基于线粒体自噬与细胞炎症、凋亡、铁死亡在脑出血继发性损伤中的相互作用关系,探讨线粒体自噬对脑出血后脑组织的神经保护作用。
〔关键词〕 脑出血;神经保护机制;线粒体自噬;凋亡;炎症;铁死亡
〔中图分类号〕R285;R743 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.05.028
Overview of neuroprotective mechanism of mitochondrial autophagy in intracerebral hemorrhage
ZHANG Baiwen ZOU Wei
(1. Heilongjiang University of Chinese Medicine, Harbin, Heilongjiang 150040, China;
2. The First Affiliated Hospital of Heilongjiang University of Chinese Medicine, Harbin, Heilongjiang 150040, China)
〔Abstract〕 Mitochondrial autophagy occurs in primary and secondary injury of intracerebral hemorrhage (ICH), which is closely related to many biological effects around damaged brain tissue after ICH, so it is very important to explore its neuroprotective mechanism of mitochondrial autophagy in ICH. Due to the changes of brain microenvironment in pathological state, a variety of cell states such as inflammation, apoptosis, and autophagy occur as well as have a certain impact on the brain nerve. Based on the interaction between mitochondrial autophagy and cell inflammation, apoptosis, ferroptosis in the secondary injury of ICH, this study explores the neuroprotective effect of mitochondrial autophagy on brain tissue after ICH.
〔Keywords〕 intracerebral hemorrhage; neuroprotective mechanism; mitochondrial autophagy; apoptosis; inflammation; ferroptosis
线粒体自噬是一种选择性自噬,可清除细胞内受损线粒体,以维持线粒体的质量控制及胞体稳态。既往研究发现,脑出血后可发生线粒体自噬,并认为其有益于神经功能的修复[1-3]。线粒体自噬主要基于PTEN诱导假定激酶1(PTEN-induced putative kinase 1, PINK1)/E3泛素连接酶Parkin通路、Bcl-2/腺病毒E1B 19 kDa相互作用蛋白3(Bcl-2/adenovirus E1B 19 kDa interacting protein 3, BNIP3)/Nip3样蛋白X(Nip3-like protein X, Nix)通路和FUN14结构域蛋白1(FUN14 domain-containing protein 1, FUNDC1)通路发挥作用。本研究结合脑出血后其他细胞反应活动与上述通路之间的联系,进一步探討线粒体自噬对脑出血的影响。
1 线粒体自噬与脑出血
脑出血后对脑组织的原发性损伤主要由血肿所致,且往往造成不可逆的后果。而大量红细胞溶解释放的血红蛋白、血红素和铁以及其他内源性分子包括谷氨酸、钙离子(Ca)、活性氧(reactive oxygen species, ROS)、凝血酶、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等是造成脑出血继发性损伤的主要原因[4-6],而上述条件均能导致线粒体损伤。损伤后的线粒体使细胞内能量供应显著降低、Ca等离子调节紊乱、ROS生成增加,均为加重脑出血继发性脑损伤的重要因素[7]。线粒体接触位点和嵴组织系统(mitochondrial contact site and cristae organizing system, MICOS)复合物中的MIC60(Mitofilin)有维持线粒体结构和功能的作用,其表达减少可诱导脑出血的神经元死亡,加重脑水肿、神经功能障碍和认知功能障碍[8],提示线粒体损伤加重脑出血继发性损伤,因此,保持线粒体功能完整有益于脑出血神经功能的恢复。此外,线粒体质量控制机制通过线粒体自噬、线粒体生物发生等,对损伤线粒体进行清除并生成新的线粒体,确保细胞发挥正常功能[9]。星形胶质细胞数量约占脑中神经细胞的50%,它在颅内维持大脑内环境稳态以及神经元正常功能时需消耗大量能量,而线粒体为能量供给的主要来源,除此之外,线粒体在调控细胞生长、信号转导、有丝分裂、细胞离子和电解质稳态中亦有重要意义[10]。在脑出血过程中,线粒体自噬能清除受损线粒体并维持线粒体各种功能的正常运行而发挥脑保护功能的作用。
在脑出血发生时,周围组织氧化应激及离子紊乱导致线粒体膜电位和ROS含量改变,使线粒体外膜发生去极化,可引起PINK1/Parkin通路诱导的线粒体自噬。在这种条件下,上游因子人第10号染色体缺失的磷酸酶及张力蛋白同源基因(gene of phosphatase and tensin homolog deleted on chromosome 10, PTEN)将诱导PINK1与细胞质中以Parkin为代表的E3泛素连接酶相结合,下游底物包括线粒体融合蛋白2(mitofusin2, Mfn2)和分裂蛋白,即动力相关蛋白1(dynamin-related peptide, Drp1)使线粒体外膜泛素化形成多种泛素链,同时导致线粒体中自噬底物蛋白P62积累,继而同自噬体膜上的蛋白微管相关蛋白轻链3(microtubule-associated protein 1 light chain 3, LC3)相互作用进入自噬体,启动线粒体自噬[11],随后通过自噬-溶酶体途径降解。
BNIP3/Nix和FUNDC1通路上的重要蛋白即BNIP3、Nix、FUNDC1均在线粒体外膜上,这些蛋白被激活后可直接与自噬体结合发生线粒体自噬。缺氧是引发上述两种通路诱导线粒体自噬最常见的条件之一,是脑出血周围组织中的常见病理状态。在缺氧条件下,缺氧诱导因子-1α(hypoxia induced factor-1α, HIF-1α)作用于BNIP3/Nix通路,可上调Nix、BNIP3的水平[9],增加线粒体自噬发生。HIF-1α也能使FUNDC1通路中关键蛋白FUNDC1中的丝氨酸13(serine 13, Ser-13)和酪氨酸18(L-tyrosine 18,Tyr-18)发生去磷酸化,进而与LC3相结合启动线粒体自噬[12]。
上述两种通路介导的线粒体自噬均为受体型发生途径,不同于PINK1/Parkin通路,其特点为这些通路上的蛋白BNIP3、Nix以及FUNDC1本身含有能与自噬体中LC3相结合的微管相关蛋白轻链3识别序列结构域(LC3-interacting region, LIR),因此,自噬体上的LC3蛋白可直接招募上述活化后的蛋白与其相结合直接介导线粒体自噬的发生[13]。
由于脑出血后病变组织周围微环境的改变,细胞间除发生线粒体自噬,还将同时存在炎症、凋亡等反应,各种分子机制相互影响,对周围组织产生保护或损伤作用。
2 线粒体自噬调控神经凋亡在脑出血中的作用
脑出血可导致损伤线粒体的通透性转变孔(mitochondria permeability transition pore, MPTP)开放和细胞色素c(cytochrome c, Cyt c)的释放,能导致线粒体自噬发生,同时还将激活并增强细胞内Caspase级联反应,促进受损细胞凋亡[7],对脑细胞起到一定的保护作用。Wu等[14]发现PINK1/Parkin通路的激活能抑制凋亡,增加脑神经细胞的存活,产生脑保护作用。类似的神经保护机制在脑缺血继发性损伤中可以得到验证。高金鹏等[15]将小鼠头部开一骨窗,用控制性皮质损伤仪进行颅脑打击造成创伤性脑损伤小鼠模型,以此探究内源性神经保护因子沉默信息调节因子2相关酶1(silentmating type information regulation 2 homolog 1, SIRT1)在脑保护中与线粒体自噬的关系,结果得到,SIRT1上调PINK1/Parkin通路介导的线粒体自噬,并抑制脑神经细胞凋亡,从而改善神经功能。Sha等[16]在对帕金森疾病的细胞研究中发现,PINK1可以作为Parkin的上游因子促进核因子-κB(nuclear factor-κB,NF-κB)活化,继而减轻鱼藤酮诱导的细胞凋亡,对脑神经细胞起到一定的保护作用。此外,PINK1/Parkin通路激活还能作为诱导c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)或蛋白53(protein 53, p53)活化的上游通路,发生线粒体自噬相关的细胞凋亡[17]。
Cai等[18]发现,在脑缺血再灌注损伤的情况下,应用tPA可以增加腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)的磷酸化和FUNDC1的表达,增加线粒体自噬的同时抑制细胞凋亡,进而改善线粒体功能起到保护脑神经的作用。这种促进线粒体自噬同时抑制细胞凋亡而保护神经的机制对颅内神经损伤相关疾病亦有指导意义。以上研究均能得出,线粒体自噬与细胞凋亡在脑组织中可能相互影响,最终起到改善神经损伤、保护神经元的作用。
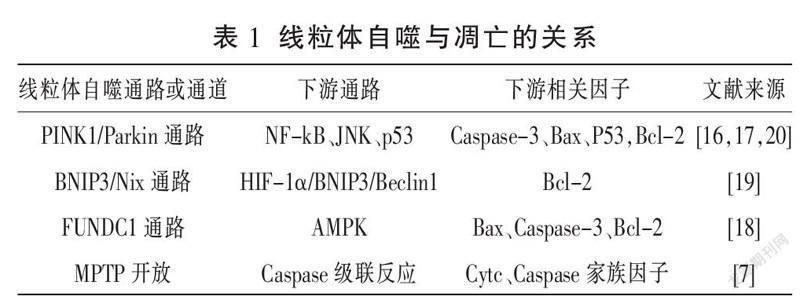
LIU等[19]发现,在缺氧条件下HIF-1α上调,从而激活HIF-1α/BNIP3/Beclin1信号通路,使组织中BNIP3及Beclin1的含量增加,它们与凋亡抑制蛋白(B-cell leukemia-2, Bcl-2)的表达有相同的结合位点,故而可以间接减少组织中Bcl-2表达,促进线粒体自噬发生的同时抑制凋亡。Guan等[20]在应用电针“百会”透“曲鬓”的方法治疗脑出血的实验研究中发现,治疗后细胞中PINK1、Parkin和BNIP3的表达逐渐增加,并在第3天达到高峰。透射电镜检查发现,胞内存在自噬空泡、溶酶体和降解的线粒体,这均为线粒体自噬被激活的神经元形态学特征。然而,Caspase-3、Bcl-2相关X蛋白(Bcl-2 associated X, Bax)、p53表达水平降低,Bcl-2表达增强,抑制了细胞凋亡的发生。再次证实线粒体自噬发生于脑出血后继发性损伤,并提示电针诱导的线粒体自噬发生和抑制凋亡有益于脑出血症状的改善,继而可以认为调节线粒体自噬与凋亡之间的平衡可作为促进脑出血恢复的机制之一。然而与之前讨论的疾病不同的是,線粒体自噬与凋亡在发挥神经保护作用时往往相拮抗,通过以上研究均可得出,增加线粒体自噬的同时抑制细胞凋亡(见表1),更有益于恢复神经元功能。
3 线粒体自噬调控神经炎症在脑出血发病中的作用
在脑出血急性期炎症因子的释放对神经功能修复存在一定的争议,多数学者认为急性期炎性因子的释放有益于保护脑组织功能,Taylor等[21]也证明了转化生长因子β1(transforming growth factor-β1,TGF-β1)在脑出血急性期升高,可调节小胶质细胞介导的神经炎症反应并促进功能性恢复。但是Lan等[22]研究得出不同的结论,其结果显示减少炎症因子白细胞介素-1β(Interleukin-1β, IL-1β)、IL-6、TNF-α以及NF-κB和Toll样受体4(toll like receptors4, TLR4)表达,在急性脑出血中起到保护作用。这提示在脑出血急性期用药后影响细胞内多种因子改变,抓住其中对治疗疾病起主导作用的因子是研究的重点,其次脑出血后微环境的改变使得各种因子间可能发生相互影响,因此,针对脑出血急性期炎症干预的研究仍需多方面、深层次地挖掘。
脑出血后的慢性炎症是导致严重继发性损伤的重要因素,各种促炎细胞因子如基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)、TNF-a、IL-11、TLR2和TLR4等引起的慢性炎症导致小鼠脑出血后存活率明显降低,血肿体积增大,神经功能缺损加重,血脑屏障破坏,脑水肿和神经元死亡增加[23-25]。因此,抑制炎症反应可减轻脑出血继发性损伤,对脑神经具有保护作用。Yu等[26]研究再次证实上述结论,抑制脑出血小鼠TNF-α、IL-1β和IL-6以及它们的下游因子髓样分化因子88(myeloid differentiation factor 88, MyD88)、接头蛋白β干扰素诱导型含TIR结构域的接头分子(TIR domain-containing adaptor inducing interferon-β, TRIF)、核因子抑制蛋白α(inhibitor kappaB alpha, IκBα)、NF-κB、p65等的表达,减少胶质细胞活化等抗炎反应,能显著改善小鼠的脑水肿情况并有益于神经功能的恢复。
核因子-E2相关因子2(NF-E2-related factor 2, Nrf2)能抑制氧化应激、发挥脑保护作用,还可以诱导视神经磷酸酶(Optineurin, OPTN)介导的线粒体自噬抑制Nod样受体蛋白3(nod-like receptor protein 3, NLRP3)炎性小体激活,抑制神经细胞损伤。而奥替普拉(Oltipraz)、富马酸二甲酯、肼等作为Nrf2的调节因子,在Nrf2/OPTN介导的线粒体自噬中有重要意义[27],临床中可从上述调节因子入手诱导线粒体自噬以治疗疾病。
吕景淑等[28]通过观察肝缺血再灌注后的幼鼠海马神经元,发现应用自噬抑制剂3-甲基腺嘌呤(3-methyladenine, 3-MA)后,线粒体自噬蛋白下降,而脑损伤标志物神经元特异性烯醇化酶(neuron-specific enolase, NSE)、S100钙结合蛋白B(S100 Calcium Binding Protein β, S100β)以及IL-6、TNF-α炎癥因子较对照组有明显增多,证明线粒体自噬能减少炎症因子,并对脑组织产生保护作用。此外,Zheng等[2]研究通过FUNDC1通路也能抑制脑出血后NLRP3介导的炎症反应,起到神经保护作用,可以得出在脑细胞中能通过线粒体自噬抑制炎症反应来保护脑神经。Murata等[29]的实验可为PINK1/Parkin通路介导炎症反应提供证明依据,PINK1可作为哺乳动物雷帕霉素2(mammalian target of rapamycin 2, mTOR2)的上游因子,使其发生磷酸化进而激活蛋白激酶B(protein kinase B, Akt)通路,参与炎症反应。张宇梁[30]在研究脑卒中这一疾病中发现,在周围组织缺少血氧供应的条件下,HIF-1α可通过HIF-1α/BNIP3/Notch1通路促进线粒体自噬的发生,而Notch信号受体1(notch signal receptor 1, Notch 1)蛋白的表达增多可特异性激活下游Notch相关通路的表达,促进周围炎症因子的释放。由此得出,可以通过改善血氧供应或减少BNIP3介导的线粒体自噬,减少炎性病变,保护神经元细胞。
上述实验说明,3种线粒体自噬经典发生途径均能参与炎症反应发生(见表2),在临床中可以通过线粒体自噬途径减少炎性反应的发生,保护脑组织神经细胞。
4 线粒体自噬调控铁死亡在脑出血中的作用
有研究在脑出血急性期血肿区较远部位发现,铁调节相关基因前列腺素内源性过氧化物合酶 2(prostaglandin-endoperoxide synthase 2, PTGS2)上调,并由透射电镜观察到与铁死亡发生时相同的线粒体形态改变,认为此时发生神经元性铁死亡[31],而早期持续应用铁死亡抑制剂(ferrostatin-1, Fer-1)有益于脑保护并能保持其远期疗效,对神经保护效率可高达80%[32]。
铁死亡发生主要依赖于ROS的过量产生和细胞内铁的积累[33],而上述条件在脑出血继发性损伤后的微环境中均可发生。脑出血后,血红蛋白在血液中释放的铁在脑组织中大量沉积并可以产生ROS等物质,使神经元细胞发生氧化应激导致继发性脑损伤[34]。在脑出血动物模型中,Bartnikas等[35]发现应用铁死亡特异性抑制剂能够减轻神经损伤。这类抑制剂通过抑制脂质ROS的产生,防止神经元死亡或减少血红蛋白诱导的铁沉积,发挥神经保护作用,改善神经功能[31-32]。线粒体BNIP3/Nix和FUNDC1通路对缺氧信号敏感,容易诱导线粒体自噬,铁死亡抑制剂可通过抑制细胞内ROS含量而减少线粒体自噬发生。神经胶质细胞与神经元之间相互作用维持正常脑功能状态,有研究认为脑出血后联合使用不同细胞的铁死亡抑制剂有更好的疗效,神经胶质细胞、小胶质细胞和少突胶质细胞等均可联系神经元共同抑制铁死亡,减轻大脑神经细胞损伤[36-38]。
有研究表明,PINK1突变可让患者脑内发生铁聚集,这种PINK1缺乏介导的铁聚集可能同线粒体膜铁转运蛋白SLC25A37(Mfrn1)和SLC25A28(Mfrn2)的降解有关,而PINK1是导致线粒体自噬发生的重要因子[39-41],说明在脑组织中的铁代谢同线粒体自噬PINK通路存在一定的联系,PINK减少可以在一定程度上减少颅内铁代谢。而铁超载又能通过激活AMPK通路促进间充质细胞线粒体碎裂,促进线粒体自噬发生[42]。
Wang等[43]认为病变部位铁代谢异常不仅能诱导线粒体自噬发生,还与凋亡存在一定的关系。他们经实验得出铁载体螯合血小板中的铁,破坏线粒体呼吸链,导致线粒体损伤和去极化,使血小板发生线粒体自噬,而这种铁载体诱导的线粒体自噬对血小板有害,从而加剧血小板的凋亡,对机体凝血功能产生一定的影响。
上述研究可以得出,铁死亡在脑出血早期即可发生并持续存在,损伤脑神经细胞,因此,尽早持续抑制铁死亡并联合多种细胞共同发挥作用,有益于脑出血的远期预后。铁死亡与线粒体自噬发生相互影响,然而具体发生通路及分子间上下游的调控关系还有待进一步探究。
5 中医药调控线粒体自噬在脑出血中的作用
针灸和中药是中医治疗疾病的重要临床手段。近年来,针灸作用机制及中药成分被不断研究,为中医治疗疾病提供更多的科学依据。
有研究指出,应用活血解毒的中药制剂醒脑静注射液能改善大鼠脑出血症状,发现该药可抑制铁死亡并调节铁离子代谢[44]、抑制自噬[45]、促进凋亡[46]、抑制炎性因子[47],从而减少神经元损伤。蔡昱[48]使用胶原酶Ⅳ注射法将大鼠制成脑出血模型,观察中药制剂忍冬苷对大鼠的影响,得出忍冬苷可以激活PI3K(p85α)/Akt/GSK3-β级联通路,减少病变细胞凋亡,减轻大鼠脑水肿症状和病变体征。以上研究均能说明,中药制剂能通过调节颅内导致细胞损伤的各种通路发挥药性,保护大脑神经元细胞。邹伟等[49-51]用自体血注射法将大鼠造模为脑出血,并研究“百会”透“曲鬓”这一针刺手法对该模型大鼠的影响,得出针刺能够调节Nrf2/抗氧化反应元件(antioxi-dant response element, ARE)通路、Shh(sonic hedgehog)通路[50]、蛋白激酶R样内质网激酶(protein kinase-like ER kinase, PERK)通路等,减轻脑组织周围炎性损伤、凋亡、铁死亡等生物学效应,从而保护脑神经,证明针刺可以作为改善脑出血预后的治疗手段之一。中医药治疗脑出血的方法手段层出不穷,然而,关于线粒体自噬在脑出血中的保护机制研究较少,但其对脑神经的保护作用已经得到了验证。
刘佳佳等[52]在关于活血凉血中药在缺血性脑卒中的作用机制研究中发现,紫草素能减少小鼠脑梗死面积,通过线粒体自噬途径减少细胞凋亡,保护海马区神经元细胞。王春玲等[53]在观察敛肝熄风止颤方对帕金森大鼠的治疗效果中发现,用药后大鼠症状明显好转,且大鼠纹状体上Ca/钙调素依赖蛋白激酶β(Ca/Calmodulin-dependent protein kinase
kinase β, CaMKKβ)、p-AMPK蛋白表达上调,线粒体自噬增强,认为该方通过CaMKKβ/AMPK通路增加纹状体线粒体自噬的发生,從而保护神经功能。颜思阳等[54]用活血荣络方干预脑缺血损伤再灌注大鼠,通过调节信号转导与转录激活因子(signal transducers and activators of transcription, STAT)-3/miR-17反馈环路,上调线粒体自噬,从而对损伤大脑起到一定的神经保护作用。
除上述中医经典用方,现代医疗技术将中药提取物制成各种药剂,在临床中亦有广泛应用。在魏思灿等[55]对脑缺血大鼠的实验中发现,应用槲皮素能在一定程度上减轻大鼠脑缺血再灌注损伤,而这种保护作用是基于调控PINK1/Parkin通路,从而激活线粒体自噬实现。类似的药物还包括山茱萸环烯醚萜苷[56]、白藜芦醇[57]以及合成制剂谷红注射液[58]等,均能通过调节线粒体自噬改善脑缺血大鼠神经功能。
权起焕[59]用电针治疗阿尔兹海默病模型小鼠时发现,予百会、肾俞、太溪低频电针刺激后,可减缓小鼠病情发展,并观察到胞外PINK1明显减少,且线粒体自噬增强,可以得出电针加强了PINK1进入胞内的数量并增加小鼠脑组织线粒体自噬的发生,起到保护小鼠颅内神经元的作用。
上述研究均能得出,针灸或中药能够促进颅内组织线粒体自噬的发生从而起到保护神经的作用。然而通过各种中医药方法诱导的线粒体自噬,在脑出血这一疾病中的机制还有待进一步研究。Ahluwalia等[60]研究提出,靶向保护线粒体可作为治疗脑出血和创伤性脑损伤的一种治疗手段。而线粒体自噬则是保护线粒体结构和功能完整性的一种重要的生物学效应,因此,探究更多中医药治疗同线粒体自噬的调控关系是今后需要研究的方向。
6 线粒体自噬抑制脑出血神经功能修复
研究表明,自噬在脑出血中有双重作用。正常情况下,自噬能清除受损细胞器以维持细胞稳态;自噬不足则不能清除损伤的细胞内容物,而过度自噬将引发不同形式的细胞死亡,均对正常细胞功能造成一定影响[61-62]。
线粒体自噬是一种选择性自噬,可能具有与自噬相同的作用。既往研究发现,在线粒体受损之初,线粒体自噬并没有被激活发挥作用,只有当线粒体内有害物质聚集到一定阈值或线粒体严重损伤时线粒体自噬才会被激活[63-64]。此外,有研究认为细胞内的一些生物学效应会受到线粒体产生ATP以及ROS的影响。当细胞内ATP充足时,细胞中以发生线粒体自噬为主;然而,在ATP缺乏伴随Ca及ROS增多的情况下,将导致更多细胞发生凋亡及坏死[65-66]。而这种细胞死亡与细胞间的串扰不同,对神经细胞功能及修复可能产生一定的抑制作用。
蛋白质聚集和多细胞器损伤是神经元迟发性死亡的主要特征,线粒体自噬能清除蛋白质聚集体和受损的细胞器来修复神经细胞。然而,在局灶性腦缺血后的早期阶段,过度激活自噬或自噬诱发不足可能会加剧脑组织损伤[67]。电针能减轻脑缺血再灌注小鼠的神经损伤,Tian等[68]研究发现,这种保护机制可能是通过电针抑制了磷酸化Unc-51样激酶1 (p-unc-51like kinase 1, p-ULK1)/FUNDC1介导的线粒体自噬相关通路发挥的作用,表明在某种条件下抑制线粒体自噬对脑组织起到一定的保护作用。
线粒体质量控制主要为线粒体生物发生和线粒体自噬的相互作用,以维持细胞内线粒体的数量和正常功能,有证据表明线粒体质量控制在急性和慢性疾病中的作用不同[69]。线粒体自噬因子可在脑出血发生针刺后第3天达到高峰,而第7天时有所降低[70],提示在脑出血急性期线粒体自噬即可出现,而脑出血发生继发性损伤后脑组织内微环境的变化,可导致线粒体自噬现象持续存在[71]。因此,探讨线粒体自噬对不同时期脑出血的影响及其与细胞其他病理变化相互作用的机制,对脑出血神经功能的预后有重要意义。
7 结语
脑出血后细胞可能发生炎症、凋亡、铁死亡、细胞焦亡等多种神经元细胞损伤形式[72],本研究仅探讨了线粒体自噬同炎症、凋亡和铁死亡之间的相互作用关系,在脑出血发生后的不同时期,由于内环境发生变化,上述细胞发生不同的生物学效应,对脑功能修复的影响亦有所差别。因此,在治疗疾病时应先了解这些细胞生物学效应对疾病的影响,再进行针对性调节。本研究得出,线粒体自噬多为一种保护机制,与线粒体生物发生相互作用维持细胞线粒体功能的稳定。对于脑出血继发性损伤,能通过促进线粒体自噬抑制炎症、凋亡和铁死亡,从而更有益于脑神经细胞的修复。因此,应用各种途径促进线粒体自噬可能成为脑出血继发性损伤的一种治疗方法。与其相关的中医疗法包括中药提取物制剂、中药汤剂以及针灸等,均能在一定程度上改善实验动物和临床患者的症状。然而,线粒体自噬过表达或发生不足将促使细胞丧失功能甚至死亡,因此,进一步探究线粒体自噬在脑出血中不同时期产生不足和过表达的阈值对临床上治疗疾病应有重要意义,同时,对于中医药、针灸等各种手段治疗疾病更深层的作用机制研究也待继续挖掘。
参考文献
[1] GUAN R Q, ZOU W, DAI X H, et al. Mitophagy, a potential therapeutic target for stroke[J]. Journal of Biomedical Science, 2018, 25(1): 87.
[2] ZHENG S Y, JIAN D, GAN H, et al. FUNDC1 inhibits NLRP3-mediated inflammation after intracerebral hemorrhage by promoting mitophagy in mice[J]. Neuroscience Letters, 2021, 756: 135967.
[3] 叶 亮,袁 淼,肖文峰.脑损伤模型大鼠Pink1/Parkin介导的线粒体自噬作用[J].中国组织工程研究,2020,24(11):1695-1700.
[4] IACOBUCCI G J, POPESCU G K. NMDA receptors: Linking physiological output to biophysical operation[J]. Nature Reviews Neuroscience, 2017, 18(4): 236-249.
[5] LEE K W, LIOU L M, WU M N. Fulminant course in a patient with anti-N-methyl-D-aspartate receptor encephalitis with bilateral ovarian teratomas: A case report and literature review[J]. Medicine, 2018, 97(15): e0339.
[6] WANG G Q, WANG L, SUN X G, et al. Haematoma scavenging in intracerebral haemorrhage: From mechanisms to the clinic[J]. Journal of Cellular and Molecular Medicine, 2018, 22(2): 768-777.
[7] 杨婷婷,江振洲,张陆勇.经由线粒体损伤诱发的药源性肝损伤研究进展[J].药学进展,2014,38(11):809-818.
[8] DENG R M, WANG W J, XU X, et al. Loss of MIC60 aggravates neuronal death by inducing mitochondrial dysfunction in a rat model of intracerebral hemorrhage[J]. Molecular Neurobiology, 2021, 58(10): 4999-5013.
[9] PICKLES S, VIGIÉ P, YOULE R J. Mitophagy and quality control mechanisms in mitochondrial maintenance[J]. Current Biology, 2018, 28(4): R170-R185.
[10] 卢言新.氯化镧对原代星形胶质细胞线粒体分裂/融合以及线粒体自噬的影响[D].沈阳:中国医科大学,2020.
[11] LAZAROU M, SLITER D A, KANE L A, et al. The ubiquitin kinase PINK1 recruits autophagy receptors to induce mitophagy[J]. Nature, 2015, 524(7565): 309-314.
[12] CHEN G, HAN Z, FENG D, et al. A regulatory signaling loop comprising the PGAM5 phosphatase and CK2 controls receptor-mediated mitophagy[J]. Molecular Cell, 2014, 54(3): 362-377.
[13] NAIK P P, BIRBRAIR A, BHUTIA S K. Mitophagy-driven metabolic switch reprograms stem cell fate[J]. Cellular and Molecular Life Sciences, 2019, 76(1): 27-43.
[14] WU X W, LI X M, LIU Y, et al. Hydrogen exerts neuroprotective effects on OGD/R damaged neurons in rat hippocampal by protecting mitochondrial function via regulating mitophagy mediated by PINK1/Parkin signaling pathway[J]. Brain Research, 2018, 1698: 89-98.
[15] 高金鵬,李 涛.沉默信息调节因子2相关酶1通过PINK1-Parkin线粒体自噬减轻创伤性脑损伤研究[J].创伤与急危重病医学,2021,9(1):7-10,15.
[16] SHA D, CHIN L S, LI L. Phosphorylation of parkin by Parkinson disease-linked kinase PINK1 activates parkin E3 ligase function and NF-kappaB signaling[J]. Human Molecular Genetics, 2010, 19(2): 352-363.
[17] 李 阳,李洪蕊,杨倩倩. PINK1特性及其作用的研究进展[J].医学影像学杂志,2020,30(8):1494-1497.
[18] CAI Y, YANG E Y, YAO X H, et al. FUNDC1-dependent mitophagy induced by tPA protects neurons against cerebral ischemia-reperfusion injury[J]. Redox Biology, 2021, 38: 101792.
[19] LIU X W, LU M K, ZHONG H T, et al. Panax notoginseng saponins attenuate myocardial ischemia-reperfusion injury through the HIF-1α/BNIP3 pathway of autophagy[J]. Journal of Cardiovascular Pharmacology, 2019, 73(2): 92-99.
[20] GUAN R Q, LI Z H, DAI X H, et al. Electroacupuncture at GV20-GB7 regulates mitophagy to protect against neurological deficits following intracerebral hemorrhage via inhibition of apoptosis[J]. Molecular Medicine Reports, 2021, 24(1): 492.
[21] TAYLOR R A, CHANG C F, GOODS B A, et al. TGF-β1
modulates microglial phenotype and promotes recovery after intracerebral hemorrhage[J]. The Journal of Clinical Investigation, 2017, 127(1): 280-292.
[22] LAN X, HAN X N, LI Q, et al. Pinocembrin protects hemorrhagic brain primarily by inhibiting toll-like receptor 4 and reducing M1 phenotype microglia[J]. Brain, Behavior, and Immunity, 2017, 61: 326-339.
[23] YANG Q W, ZHUANG X R, PENG F, et al. Relationship of plasma matrix metalloproteinase-9 and hematoma expansion in acute hypertensive cerebral hemorrhage[J]. The International Journal of Neuroscience, 2016, 126(3): 213-218.
[24] YANG G, SHAO G F. Elevated serum IL-11, TNF α, and VEGF expressions contribute to the pathophysiology of hypertensive intracerebral hemorrhage (HICH)[J]. Neurological Sciences, 2016, 37(8): 1253-1259.
[25] RODRÍGUEZ-YÁÑEZ M, BREA D, ARIAS S, et al. Increased expression of Toll-like receptors 2 and 4 is associated with poor outcome in intracerebral hemorrhage[J]. Journal of Neuroimmunology, 2012, 247(1/2): 75-80.
[26] YU A Y, DUAN H Z, ZHANG T X, et al. IL-17A promotes microglial activation and neuroinflammation in mouse models of intracerebral haemorrhage[J]. Molecular Immunology, 2016, 73: 151-157.
[27] CHENG Y J, LIU M J, TANG H, et al. iTRAQ-based quantitative proteomics indicated Nrf2/OPTN-mediated mitophagy inhibits NLRP3 inflammasome activation after intracerebral hemorrhage[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 6630281.
[28] 呂景淑,贾莉莉,喻文立.异丙酚通过诱导幼鼠海马神经元线粒体自噬减轻其肝缺血再灌注后脑损伤[J].天津医科大学学报,2019, 25(1):28-31.
[29] MURATA H, SAKAGUCHI M, JIN Y, et al. A new cytosolic pathway from a Parkinson disease-associated kinase, BRPK/PINK1: Activation of AKT via mTORC2[J]. The Journal of Biological Chemistry, 2011, 286(9): 7182-7189.
[30] 张宇梁.基于HIF-1α/BNIP3/Notch1通路研究HSYA调节自噬治疗缺血性脑卒中的机制[D].保定:河北大学,2021.
[31] CHEN B, CHEN Z H, LIU M J, et al. Inhibition of neuronal ferroptosis in the acute phase of intracerebral hemorrhage shows long-term cerebroprotective effects[J]. Brain Research Bulletin, 2019, 153: 122-132.
[32] ZILLE M, KARUPPAGOUNDER S S, CHEN Y X, et al. Neuronal death after hemorrhagic stroke in vitro and in vivo shares features of ferroptosis and necroptosis[J]. Stroke, 2017, 48(4): 1033-1043.
[33] SONG X H, LONG D X. Nrf2 and ferroptosis: A new researchdirection for neurodegenerative diseases[J]. Frontiers in Neuroscience, 2020, 14: 267.
[34] XU J Z, MARZETTI E, SEO A Y, et al. The emerging role of iron dyshomeostasis in the mitochondrial decay of aging[J]. Mechanisms of Ageing and Development, 2010, 131(7/8): 487-493.
[35] BARTNIKAS T B, STEINBICKER A U, ENNS C A. Insights into basic science: What basic science can teach us about iron homeostasis in trauma patients[J]. Current Opinion in Anaesthesiology, 2020, 33(2): 240-245.
[36] LI Q, HAN X N, LAN X, et al. Inhibition of neuronal ferroptosis protects hemorrhagic brain[J]. JCI Insight, 2017, 2(7): e90777.
[37] FAN B Y, PANG Y L, LI W X, et al. Liproxstatin-1 is an effective inhibitor of oligodendrocyte ferroptosis induced by inhibition of glutathione peroxidase 4[J]. Neural Regeneration Research, 2021, 16(3): 561-566.
[38] LAIRD M D, WAKADE C, ALLEYNE C H J, et al. Hemin-induced necroptosis involves glutathione depletion in mouse astrocytes[J]. Free Radical Biology & Medicine, 2008, 45(8): 1103-1114.
[39] SCHWEITZER K J, BRüSSEL T, LEITNER P, et al. Transcranial ultrasound in different monogenetic subtypes of Parkinson's disease[J]. Journal of Neurology, 2007, 254(5): 613-616.
[40] LI C F, ZHANG Y, CHENG X, et al. PINK1 and PARK2 suppress pancreatic tumorigenesis through control of mitochondrial iron-mediated immunometabolism[J]. Developmental Cell, 2018, 46(4): 441-455.
[41] KANG R, XIE Y C, ZEH H J, et al. Mitochondrial quality control mediated by PINK1 and PRKN: Links to iron metabolism and tumor immunity[J]. Autophagy, 2019, 15(1): 172-173.
[42] ZHENG Q Q, ZHAO Y S, GUO J, et al. Iron overload promotes mitochondrial fragmentation in mesenchymal stromal cells from myelodysplastic syndrome patients through activation of the AMPK/MFF/Drp1 pathway[J]. Cell Death & Disease, 2018, 9(5): 515.
[43] WANG W Y, LU Y F, WANG Y L, et al. Siderophores induce mitophagy-dependent apoptosis in platelets[J]. Annals of Translational Medicine, 2020, 8(14): 879.
[44] 周玉嘉.基于GPX4通路調控铁死亡探讨活血解毒法治疗脑出血火毒证机制研究[D].北京:北京中医药大学,2021.
[45] WEI G, HUANG Y C, LI F, et al. XingNaoJing, prescription of traditional Chinese medicine, prevents autophagy in experimental stroke by repressing p53-DRAM pathway[J]. BMC Complementary and Alternative Medicine, 2015, 15: 377.
[46] PAN C, LIU N, ZHANG P, et al. EGb761 ameliorates neuronal apoptosis and promotes angiogenesis in experimental intracerebral hemorrhage via RSK1/GSK3β pathway[J]. Molecular Neurobiology, 2018, 55(2): 1556-1567.
[47] MA R, MA X, WEN J X, et al. Preclinical evidence and mechanism of xingnaojing injection for cerebral ischemia: A systematic review and meta-analysis of animal studies[J]. Evidence-Based Complementary and Alternative Medicine, 2018, 2018: 9624175.
[48] 蔡 昱.忍冬苷对大鼠脑出血后神经元凋亡的保护作用及机制研究[D].泸州:西南医科大学,2021.
[49] 戴晓红,于学平,匡炳霖,等.针刺对急性脑出血大鼠Nrf2/ARE信号通路关键因子表达的影响[J].针灸临床杂志,2021,37(9):64-69.
[50] 张 菶,邹 伟.头针抑制脑出血后神经细胞凋亡机制初探[J].针灸临床杂志,2021,37(5):76-81.
[51] 邹 伟,牛明明,于学平,等.“百会”透“曲鬓”针刺法对脑出血大鼠脑组织中PERK蛋白表达影响的实验研究[J].中医药信息,2017,
34(2):75-79.
[52] 刘佳佳.活血凉血中药入脑有效成分抗缺血性脑卒中的作用及机制研究[D].扬州:扬州大学,2021.
[53] 王春玲,罗 宁,蒋媛静,等.基于CaMkkβ/AMPK通路介导线粒体自噬探讨敛肝熄风止颤方的神经保护机制[J].世界中医药,2021,16(5):765-768,774.
[54] 颜思阳,杨仁义,刘利娟,等.基于“STAT3/miR-17”反馈环探讨活血荣络方对脑缺血再灌注损伤模型大鼠的保护作用机制[J].湖南中医药大学学报,2021,41(4): 489-497.
[55] 魏思灿,林天来,黄 玲,等.槲皮素通过PINK1/parkin通路激活线粒体自噬减轻大鼠脑缺血再灌注损伤[J].中国病理生理杂志,2020,36(12):2251-2257.
[56] 王明洋,孙争宇,张 丽,等.山茱萸环烯醚萜苷对脑缺血再灌注大鼠线粒体损伤的影响[J].首都医科大学学报,2020,41(3):385-390.
[57] 向 菲,李明航,徐 露,等.白藜芦醇通过促进线粒体自噬减轻小鼠脑缺血/再灌注损伤的实验研究[J].中国药理学通报,2019,35(6):815-821.
[58] 冯 璐,王明洋,刘俊雅,等.谷红注射液对脑缺血大鼠大脑皮质线粒体功能的改善作用[J].医学研究杂志,2017,46(1):27-30.
[59]权起焕.“肾脑相济”电针疗法對阿尔茨海默小鼠PINK1和PARKIN的影响[D].沈阳:辽宁中医药大学,2019.
[60] AHLUWALIA M, KUMAR M, AHLUWALIA P, et al. Rescuingmitochondria in traumatic brain injury and intracerebral
hemorrhages-A potential therapeutic approach[J]. Neurochemistry International, 2021, 150: 105192.
[61] 李明月,李 响,邹 伟.自噬在脑出血中的作用及针刺调节机制研究探析[J].针灸临床杂志,2019,35(10):1-5.
[62] JIA J J, JIN H Q, NAN D, et al. New insights into targeting mitochondria in ischemic injury[J]. Apoptosis, 2021, 26(3/4): 163-183.
[63] BOZI L H M, BECHARA L R G, DOS SANTOS A F, et al. Mitochondrial-derived vesicles: A new player in cardiac mitochondrial quality control[J]. The Journal of Physiology, 2016, 594(21): 6077-6078.
[64] SOTO-HEREDERO G, BAIXAULI F, MITTELBRUNN M. Interorganelle communication between mitochondria and the endolysosomal system[J]. Frontiers in Cell and Developmental Biology, 2017, 5: 95.
[65] 张永智,刘彬冰,田 杨,等.线粒体自噬在蛛网膜下腔出血中的研究进展[J].中国卒中杂志,2021,16(7):752-756.
[66] KIM J S, HE L H, LEMASTERS J J. Mitochondrial permeability transition: A common pathway to necrosis and apoptosis[J]. Biochemical and Biophysical Research Communications, 2003, 304(3): 463-470.
[67] LUO T F, PARK Y, SUN X, et al. Protein misfolding, aggregation, and autophagy after brain ischemia[J]. Translational Stroke Research, 2013, 4(6): 581-588.
[68] TIAN W Q, ZHU M M, ZHOU Y D, et al. Electroacupuncture pretreatment alleviates cerebral ischemia-reperfusion injury by regulating mitophagy via mTOR-ULK1/FUNDC1 axis in rats[J]. Journal of Stroke and Cerebrovascular Diseases, 2022, 31(1): 106202.
[69] ANZELL A R, MAIZY R, PRZYKLENK K, et al. Mitochondrial quality control and disease: Insights into ischemia-reperfusion injury[J]. Molecular Neurobiology, 2018, 55(3): 2547-2564.
[70] MA K L, ZHANG Z, CHANG R, et al. Dynamic PGAM5
multimers dephosphorylate BCL-xL or FUNDC1 to regulate mitochondrial and cellular fate[J]. Cell Death and Differentiation, 2020, 27(3): 1036-1051.
[71] ZHENG J W, SHI L G, LIANG F, et al. Sirt3 ameliorates oxidative stress and mitochondrial dysfunction after intracerebral hemorrhage in diabetic rats[J]. Frontiers in Neuroscience, 2018, 12: 414.
[72] FRICKER M, TOLKOVSKY A M, BORUTAITE V, et al. Neuronal cell death[J]. Physiological Reviews, 2018, 98(2): 813-880.
(本文编辑 匡静之)

