青光安Ⅱ号方及其有效组分对DBA/2J小鼠视网膜Ras、MEK及ERK蛋白表达的影响
秦惠钰 曾志成 李银鑫 彭清华

〔摘要〕 目的 觀察青光安Ⅱ号方及其有效组分对DBA/2J小鼠视网膜细胞中Ras、MEK与ERK蛋白表达的影响,探讨其对视神经保护的作用机制。方法 将8只雌性C57BL/6J小鼠作为正常对照组(A组),采用随机数字表法将48只雌性DBA/2J小鼠分为6组:模型组(B组)、阳性对照组(C组)、青光安Ⅱ号方汤剂组(D组)、青光安Ⅱ号方有效组分低剂量组(E组)、青光安Ⅱ号方有效组分中剂量组(F组)、青光安Ⅱ号方有效组分高剂量组(G组),每组8只。A、B组给予12.91 mL/(kg·d)蒸馏水;C组给予0.31 g/(kg·d)益脉康分散片;D组给予9.67 g/(kg·d)青光安Ⅱ号方汤剂;E、F、G组分别给予0.85、1.70、3.40 g/(kg·d)青光安Ⅱ号方有效组分。每4周进行眼压测量以及裂隙灯检查;灌胃4周后取视网膜组织行Western blot检测各组小鼠视网膜Ras、MEK与ERK蛋白的表达水平。结果 C57BL/6J小鼠不同时相点的眼压不随年龄增长而变化(P>0.05);DBA/2J小鼠眼压在第18~38周高于C57BL/6J小鼠(P<0.05)。裂隙灯检查C57BL/6J小鼠眼前段均未见明显异常;DBA/2J小鼠随周龄增长逐渐出现角膜钙化、虹膜基质萎缩、瞳孔后粘连等眼前节病变。与A组比较,B组Ras、MEK、ERK蛋白表达水平均降低(P<0.05);与B组比较,C、D、E、F、G组Ras蛋白表达水平均升高(P<0.05),G组MEK、ERK蛋白表达水平均升高(P<0.05);与C组比较,G组Ras蛋白表达水平升高(P<0.05);与D组比较,G组MEK蛋白表达水平升高(P<0.05);与E、F组比较,G组Ras蛋白表达水平升高(P<0.05)。结论 青光安Ⅱ号方及其有效组分低、中、高剂量对DBA/2J小鼠视网膜Ras、MEK、ERK蛋白可起到不同程度的上调作用,以青光安Ⅱ号方有效组分高剂量组效果最佳。
〔关键词〕 青光眼;青光安Ⅱ号方;DBA/2J小鼠;视网膜神经节细胞;视神经保护
〔中图分类号〕285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.05.008
Effect of Qingguang'an Ⅱ Decoction and its effective components on the expression of Ras,
MEK and ERK proteins in retina of DBA/2J mice
QIN Huiyu ZENG Zhicheng LI Yinxin PENG Qinghua
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Department of Ophthalmology, Hubei Hospital of Traditional Chinese Medicine, Wuhan, Hubei 430006, China; 3. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China)
〔Abstract〕 Objective To observe the effect of Qingguang'an Ⅱ Decoction and its effective components on the expression of Ras, MEK and ERK proteins in retina of DBA/2J mice, and to explore its mechanism of action on optic nerve protection. Methods 8 female C57BL/6J mice were divided into normal control group (group A). A total of 48 female DBA/2J mice were divided into 6 groups by random number table method: model group (group B), positive control group (group C), Qingguang'an Ⅱ Decoction group (group D), Qingguang'an Ⅱ Decoction effective component low-dose group (group E), Qingguang'an Ⅱ Decoction effective component medium-dose group (group F), Qingguang'an Ⅱ Decoction effective component high-dose group (group G), with 8 mice in each group. Groups A and B were given 12.91 mL/(kg·d) distilled water; group C was given 0.31 g/(kg·d) Yimaikang dispersible tablets; group D was given 9.67 g/(kg·d) Qingguang'an Ⅱ Decoction; groups E, F and G were given 0.85, 1.70, 3.40 g/(kg·d) Qingguang'an Ⅱ Decoction effective component, respectively. Intraocular pressure measurement and slit lamp examination were performed every 4 weeks. After 4 weeks of intragastric administration, retinal tissues were collected for Western blot to detect the relative expression of Ras, MEK and ERK proteins in the retina of mice in each group. Results The intraocular pressure of C57BL/6J mice at different time points did not change with age (P>0.05). The intraocular pressure of DBA/2J mice was higher than C57BL/6J mice at 18-38 weeks (P<0.05). Slit lamp examination showed no abnormal anterior segment of C57BL/6J mice; DBA/2J mice gradually developed corneal calcification, iris matrix atrophy, retropupil adhesion and other anterior segment lesions with age. Compared with group A, the protein expression levels of Ras, MEK and ERK in group B were decreased (P<0.05); compared with group B, the expression of Ras protein in groups C, D, E, F and G increased (P<0.05), and the protein expression levels of MEK and ERK in group G increased (P<0.05); compared with group C, the expression level of Ras protein in group G was increased (P<0.05); compared with group D, the expression of MEK protein in group G increased (P<0.05); compared with groups E and F, the expression of Ras protein in group G increased (P<0.05). Conclusion Qingguang'an Ⅱ Decoction and its effective component at low, medium and high doses could up-regulate Ras, MEK and ERK proteins in retina of DBA/2J mice to different degrees. The effect of the high-dose group of Qingguang'an Ⅱ Decoction is the best.EB65E8DF-5337-45BA-A6FD-4CA01EDF54A7
〔Keywords〕 glaucoma; Qingguang'an Ⅱ Decoction; DBA/2J mice; retinal ganglion cells; optic nerve protection
青光眼视神经病变以视网膜神经节细胞(retinal ganglion cells, RGCs)进行性凋亡为主要病理特征[1],病理性眼压增高程度、持续时间与其严重程度密切相关,但临床病例资料显示,患者术后即使眼压控制稳定,部分仍出现视神经进行性损伤,即存在RGCs进行性凋亡[2-3]。为了减缓视神经损伤的发展,降低或阻断RGCs凋亡、提高其存活率逐渐成为主要研究方向[4]。相关研究表明,视网膜中Ras蛋白与ERK蛋白的表达可抑制RGCs凋亡,提高其存活率,从而起到保护神经的作用,丝裂原活化蛋白激酶/细胞外信号调节激酶通路(mitogen-ativated protein kinase/extracellular signal-regulated kinase, MAPK/ERK)是其主要信号通路[5],而丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase, MEK)也是此通路上的关键蛋白[6]。
中医学认为青光眼视神经损伤的病机为气血失和,目中玄府闭塞,神水瘀积,综合现代血瘀特征,其综合病理应为血瘀水停[7]。对此,彭清华教授创制了具有滋补肝肾、益气活血之功效的青光安Ⅱ号方。本实验通过观察青光安Ⅱ号方及其有效组分对DBA/2J小鼠视网膜细胞中MAPK/ERK信号通路Ras、MEK与ERK蛋白表达的影响,进一步明确其对视神经保护的作用机制,为青光眼视神经保护作用药物的研究发展提供实验依据。
1 材料与方法
1.1 實验动物
健康、无眼部疾患的雌性DBA/2J小鼠50只,SPF级,10周龄,体质量18~22 g,由北京维通利华实验动物技术有限公司提供,实验动物许可证号:SCXK(京)2016-0006;健康、无眼部疾患的雌性C57BL/6J小鼠8只,SPF级,10周龄,体质量18~22 g,由湖南斯莱克景达实验动物有限公司提供,实验动物许可证号:SCXK(湘)2016-0002。
本实验通过湖南中医药大学动物实验伦理委员会批准,审批编号:LL2019100802,实验动物饲养于湖南中医药大学中医药防治眼耳鼻咽喉疾病湖南省重点实验室,实验动物使用许可证号:SYXK(湘)2019-0009,动物饲养和实验操作遵循湖南中医药大学制定的科研动物和实验室使用规范。
1.2 实验药品
青光安Ⅱ号方组成:枸杞子、女贞子、牛膝、黄芪、灯盏花、川芎(比例为1.5∶1.5∶1∶1.5∶1∶1),由湖南中医药大学第一附属医院药剂科提供;青光安Ⅱ号方有效组分:对青光安Ⅱ号方原材料进行水提取和80%乙醇提取、溶剂分配分离、AB-8大孔吸附树脂法分离、洗脱,采用UPLC-Q-TOF法[8]从提取物中鉴定出有效组分复合物;益脉康分散片(湖南湘雅制药有限公司,国药准字:Z20080073,批号:1903119,规格:0.4 g/片)。
1.3 主要试剂
RIPA裂解液(批号:G2002)、BCA蛋白定量检测试剂盒(批号:G2026)、HRP标记山羊抗兔(批号:GB23303)均购自武汉赛维尔生物科技有限公司;兔抗Ras多克隆抗体(批号:BJ08049011)、兔抗ERK多克隆抗体(批号:BO09128315)均购自北京博奥森生物技术有限公司;兔抗MEK多克隆抗体(江苏亲科生物研究中心有限公司,批号:61u0921);兔抗β-actin多克隆抗体(武汉赛维尔生物科技有限公司,批号:G12001)。
1.4 主要仪器
Tono-pen笔式眼压计(美国Reichert公司,型号:AVIA);裂隙灯显微镜(日本Topcon公司,型号:SL-2G);眼科手术显微镜(苏州六六视觉科技股份有限公司,型号:YZ20T4);超声裂解仪(美国SONICS&MATERIALS公司,型号:VCX130);台式高速冷冻离心机(香港力康生物医疗科技控股有限公司,型号:Neofuge 13R);匀浆仪(型号:KZ-Ⅱ)、涡旋混合器(型号:MX-F)、脱色摇床(型号:TSY-B)均购自武汉赛维尔生物科技有限公司;双垂直电泳仪(型号:DYCZ-24DN)、转印电泳仪(型号:DYCZ-40D)均购自北京六一生物科技有限公司;PVDF膜0.45 μm(型号:IPVH00010)、PVDF膜0.22 μm(型号:ISEQ00010)均购自美国Millipore公司。
1.5 动物模型的建立
检测内容包括眼压和眼前节的改变。DBA/2J小鼠是一种天然的年龄相关慢性高眼压模型鼠[9],随着月龄增大出现角膜钙化、虹膜基质萎缩、房角关闭等眼前节病变[10]。每4周对所有进入实验室经过适应性饲养后的小鼠进行眼压测量以及裂隙灯检查,将38周龄眼压值超过20 mmHg(眼压异常高值小鼠不纳入实验分组)、至少有一眼出现明显角膜钙化斑、虹膜萎缩、瞳孔变形的DBA/2J小鼠视为模型建立成功[11],最终纳入48只DBA/2J小鼠。
1.6 分组及给药
8只C57BL/6J小鼠为正常对照组(A组);按照随机数字表法将48只DBA/2J小鼠平均分为模型组(B组)、阳性对照组(C组)、青光安Ⅱ号方汤剂组(D组)、青光安Ⅱ号方有效组分低剂量组(E组)、青光安Ⅱ号方有效组分中剂量组(F组)、青光安Ⅱ号方有效组分高剂量组(G组),共7组。参照《中医科研设计与统计学》[12],将小鼠体质量(各体质量差异小,取均值28 g)与成人体质量60 kg进行等效药物剂量换算,以蒸馏水为溶剂进行配制(混悬液给药前需摇匀),连续4周给小鼠灌胃。剂量如下:A、B组:12.91 mL/(kg·d)蒸馏水;C组:益脉康分散片0.31 g/(kg·d);D组:青光安Ⅱ号方汤剂9.67 g/(kg·d);E、F、G组:青光安Ⅱ号方有效组分0.85、1.70、3.40 g/(kg·d)(相当于成人一日等效剂量的0.5倍、1倍、2倍)。EB65E8DF-5337-45BA-A6FD-4CA01EDF54A7
1.7 动物取材
灌胃4周后对所有实验小鼠行颈椎脱臼处死。剜出小鼠眼球,沿角巩膜缘剪开,除去角膜、虹膜、晶状体剥离出视网膜组织置入EP管,标记后保存于液氮罐中。各组小鼠右眼视网膜组织用于Western blot检测Ras、MEK、ERK蛋白。
1.8 Western blot检测视网膜Ras、MEK及ERK蛋白表达水平
对样本进行组织匀浆,4 ℃、12 000 r/min离心5 min,离心半径10 cm,上清即为总蛋白溶液,用BCA测定法测定蛋白浓度,进行SDS-PAGE电泳、转膜、染色与封闭,孵育一抗(兔抗Ras、兔抗MEK、兔抗ERK多克隆抗体,均按照1∶1000稀释),再孵育二抗,滴加ECL发光工作液与PVDF膜上孵育后显色,再以β-actin蛋白作为内参,采用AlphaEaseFC灰度分析软件对蛋白电泳条带进行灰度值分析,得出蛋白表达量。
1.9 统计学方法
采用SPSS 22.0统计软件对实验结果进行分析,计量资料以“x±s”表示,先进行正态性及方差齐性检验,若满足正态性和方差齐性,多组比较采用单因素方差分析;不满足方差齐性时,则用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两类小鼠眼压变化结果
第10~38周龄的8只C57BL/6J小鼠双眼眼压波动范围在11~16 mmHg;48只DBA/2J小鼠双眼眼压从第10周开始逐渐上升,第18周开始明显上升。
C57BL/6J小鼠不同时相点的眼压不随年龄增长而变化(P>0.05);将C57BL/6J小鼠和DBA/2J小鼠同一时相点眼压比较,发现DBA/2J小鼠眼压第18~38周均高于C57BL/6J小鼠(P<0.05)。详见表1。
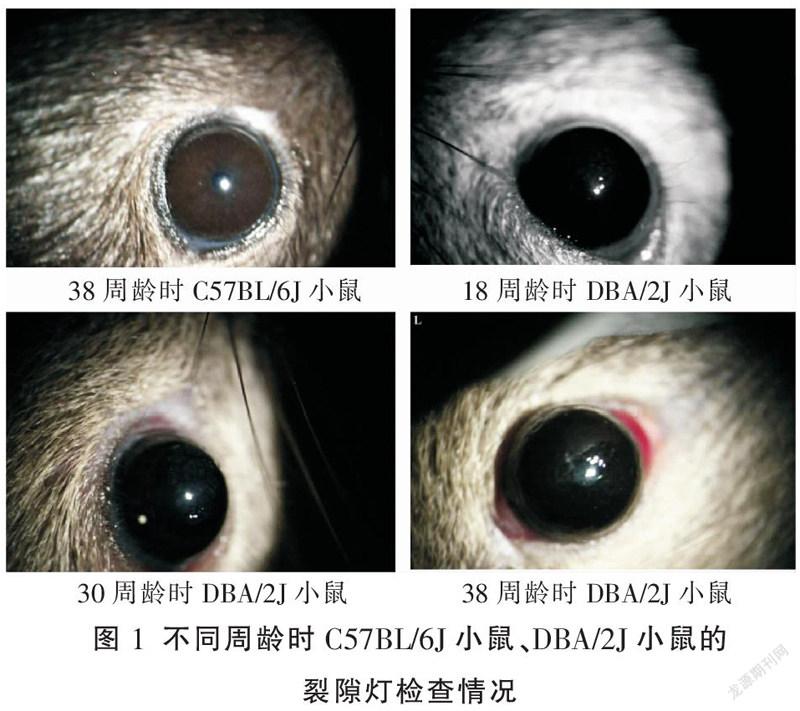
2.2 裂隙灯检查情况
第10~38周龄的C57BL/6J小鼠角膜透明,虹膜纹理清晰,瞳孔居中而圆,眼前段均未见明显异常;DBA/2J小鼠在第10周龄出现边界不清的角膜钙化斑,第18周龄时可见清晰成片的角膜钙化斑;第22、26周可观察到逐渐加重的角膜钙化斑,多数在第30周龄可见密集的角膜钙化斑,局部出现虹膜基质萎缩,瞳孔后粘连;第38周龄虹膜明显萎缩,瞳孔不规则。各眼前节情况见图1。
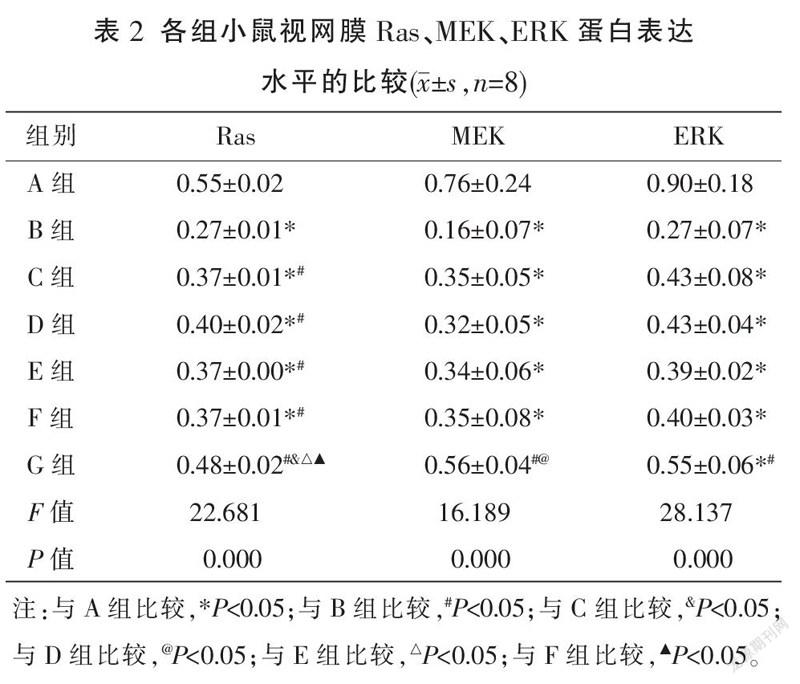
2.3 各组Ras、MEK及ERK蛋白表达水平比较
与A组比较,B组Ras、MEK、ERK蛋白表达水平均降低(P<0.05);与B组比较,C、D、E、F、G组Ras蛋白表达水平均升高(P<0.05),G组MEK、ERK蛋白表达水平均升高(P<0.05);与C组比较,G组Ras蛋白表达水平升高(P<0.05);与D组比较,G组MEK蛋白表达水平升高(P<0.05);与E、F组比较,G组Ras蛋白表达水平升高(P<0.05)。详见图2、表2。
3 讨论
青光眼作为世界首位不可逆性致盲眼病,40岁以上高眼压症人群达3%~10%,若不进行干预,将有10%以上在5~10年內发展为青光眼[13]。与此同时,青光眼RGCs凋亡相关信号通路的研究逐渐成为热点,真核细胞中存在广泛的丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs),而参与细胞内重要信号传导的MAPK信号通路,在细胞的生长、增殖、分化、凋亡等过程中起着重要作用[14],其主要途径Ras-Raf-MEK-ERK符合经典的三步酶促级联反应:细胞外各刺激物结合受体后,上游激活蛋白Ras释放二磷酸鸟苷,同时结合三磷酸鸟苷活化,通过激活MAPK激酶Raf后将其从胞质转移至胞膜,C端催化区域再与MEK结合,被激活的双重特异性激酶MEK能使ERK的苏氨酸和络氨酸双位点磷酸化,激活ERK移位进入细胞核内造成多种转录因子磷酸化,促进一系列基因表达和抗凋亡作用产生[15]。相关实验研究显示,MAPK/ERK信号通路能抑制炎症因子,促进小胶质细胞活化,从而起到保护视神经的作用,提高了RGCs存活率,是重要的抑制细胞凋亡的经典通路[16]。
近年来,中医药在青光眼视神经保护方面取得了一定成绩,彭清华教授创制的青光安Ⅱ号方以枸杞子、女贞子为君药,枸杞子补肾益精、养肝明目,枸杞多糖上调大鼠模型中具有神经保护作用的HSP70和神经肽mRNA的表达,改善神经退行性病变[17];女贞子补益肝肾、明目,能够调节细胞凋亡的调控因子,保护神经细胞[18]。以牛膝、黄芪为臣药,牛膝补肝肾、活血化瘀,性善下行,利水通淋,可用于非动脉炎性前部缺血性视神经病变[19];黄芪益气固表,黄芪注射液能上调大鼠视网膜组织NGF、TrKA蛋白表达以及抑制p75NTR mRNA及JNK蛋白,促进NF-κB蛋白表达,对视神经牵拉伤大鼠RGCs具有保护作用[20-21]。以灯盏花、川芎为佐药,灯盏花活血化瘀通络,其有效成分野黄芩苷、咖啡酸、东莨菪内酯等可促进体外RGCs存活[22];川芎活血行气、祛风止痛,其主要成分川芎嗪具有改善微循环、抗炎和抑制细胞凋亡作用[23],能改变RGC-5细胞内抗氧化酶表达,起到对氧化损伤的RGCs的保护作用[24]。另有实验表明,川芎嗪注射液可能通过升高视网膜Bcl-2蛋白表达水平、降低Bax蛋白表达水平、改变Bcl-2/Bax比值,从而减少RGCs凋亡[25]。诸药相合,共奏滋补肝肾、益气活血之效,能有效改善局部微循环从而保护视神经。
本实验通过对DBA/2J小鼠各周龄进行眼压以及眼前节裂隙灯检查,验证了DBA/2J小鼠是慢性高眼压的理想模型。从第38周龄开始用青光安Ⅱ号方及其有效组分、益脉康分散片进行为期4周的灌胃干预,实验结果表明:成模后的DBA/2J小鼠视网膜中Ras、MEK、ERK蛋白表达水平降低,说明MAPK/ERK信号传导通路被抑制,而青光安Ⅱ号方及其有效组分低、中、高剂量对DBA/2J小鼠视网膜Ras、MEK、ERK蛋白起到一定程度的上调作用,以青光安Ⅱ号方有效组分高剂量组效果最佳。从理论角度分析,青光安Ⅱ号方及其有效组分是通过激活视网膜MAPK/ERK信号通路,上调通路相关蛋白表达,从而达到抑制RGCs凋亡保护视神经的作用,青光安Ⅱ号方是一种价廉、安全的青光眼视神经保护药物,有望投入临床治疗中。EB65E8DF-5337-45BA-A6FD-4CA01EDF54A7
参考文献
[1] LEVKOVITCH-VERBIN H. Retinal ganglion cell apoptotic pathway in glaucoma: Initiating and downstream mechanisms[J]. Progress in Brain Research, 2015, 220: 37-57.
[2] PATIL K R, TEZEL G G, YANG J, et al. Serum autoantibody against glutathione S-transferase in patients with glaucoma[J]. Investigative Ophthalmology and Visual Science, 2001, 42(6):1273-1276.
[3] CHEN Y J, TAI M C, CHENG J H, et al. The longitudinal changes of the visual field in an Asian population with primary angle-closure glaucoma with and without an acute attack[J]. Journal of Ocular Pharmacology and Therapeutics, 2012, 28(5): 529-535.
[4] 李 強,王红义,任 丽,等.视网膜神经节细胞凋亡机制的研究进展[J].中医眼耳鼻喉杂志,2019,9(2):96-98.
[5] 陈 驰,燕晋媛,曹 霞,等.脑源性神经营养因子在青光眼高眼压导致的视神经节细胞的凋亡抑制作用的研究概述[J].重庆医学,2017,46(33):4735-4738.
[6] 郝佩琪,安 输,杨 洋,等.MEK激酶及其抑制剂的研究进展[J].中国细胞生物学学报,2015,37(10):1425-1431.
[7] 彭清华.眼科活血利水法的研究[M].北京:中国中医药出版社,2019:3.
[8] 鄂秀辉,孙宁宁,杨 雪,等.UPLC-Q-TOF/MS法分析加参片提取物入血成分[J].中华中医药学刊,2019,37(9):2077-2081.
[9] MOON J I, KIM I B, GWON J S, et al. Changes in retinal neuronal populations in the DBA/2J mouse[J]. Cell and Tissue Research, 2005, 320(1): 51-59.
[10] 杨 帆,吴玲玲,郭秀娟,等.青光眼动物模型DBA/2J小鼠的眼部特征及组织学观察[J].眼科研究,2010,28(2):103-108.
[11] WONG A A, BROWN R E. A neurobehavioral analysis of the prevention of visual impairment in the DBA/2J mouse model of glaucoma[J]. Investigative Ophthalmology & Visual Science, 2012, 53(9): 5956-5966.
[12] 贺石林,王 健,王净净.中医科研设计与统计学[M].长沙:湖南科学技术出版社,2006:48-49.
[13] 高惠娟.高眼压症相关因素分析、检查及处理对策[J].医学理论与实践,2019,32(13):2003-2005.
[14] 陈建勇,王 聪,王 娟,等.MAPK信号通路研究进展[J].中国医药科学,2011,1(8):32-34.
[15] 刘 伟,黄 玮,李瑞琴.MAPK/ERK信号传导通路与肿瘤发生的相关机制研究进展[J].中国现代医药杂志,2016,18(8):97-100.
[16] 陈 宾.MAPK/ERK信号通路在大鼠视神经损伤后小胶质细胞活化中的作用及机制研究[J].卒中与神经疾病,2018,25(4):427-430.
[17] 杜然然,毕宏生,郭俊国,等.枸杞多糖对体外培养视网膜神经节细胞的保护作用[J].眼科新进展,2014,34(2):119-122.
[18] 井晓磊,赵 铎.女贞子对大鼠脊髓损伤后细胞凋亡及Bcl-2、Bax的表达影响[J].中国实用神经疾病杂志,2011,14(22):28-30.
[19] 吴鲁华,李 欣,何 萍,等.基于聚类分析的非动脉炎性前部缺血性视神经病变用药规律探讨[J].中华中医药学刊,2016,34(8):1926-1929.
[20] 谷新怡,刘爱伟,苏 艳,等.黄芪注射液对视神经牵拉伤大鼠NGF、TrkA表达的影响[J].北京中医药大学学报,2016,39(1):26-29.
[21] 谷新怡,周 剑,闫晓玲,等.黄芪注射液通过调节JNK和NF-κB通路抑制视网膜神经节细胞凋亡[J].中国中医基础医学杂志,2016,
22(3):358-361.
[22] 王竞男,杨立群,邓宇斌.灯盏花素对人视网膜色素上皮细胞和糖尿病大鼠视网膜VEGF表达的影响[J].中国病理生理杂志,2015,31(5):900-905.
[23] LU C F, XU W X, ZHANG F, et al. Ligustrazine prevents alcohol-induced liver injury by attenuating hepatic steatosis and oxidative stress[J]. International Immunopharmacology, 2015, 29(2): 613-621.
[24] 孙 旋,冯卓蕾,陈 娜.川芎嗪对过氧化氢致大鼠视网膜神经节细胞氧化损伤的抑制作用及机制[J].眼科新进展,2019,39(6):515-518.
[25] 杜红彦,李建良,骆 煌,等.川芎嗪注射液对高眼压大鼠视网膜Bcl-2、Bax蛋白表达和视网膜神经节细胞凋亡的影响[J].中国中医急症,2017,26(10):1703-1706.
(本文编辑 周 旦)EB65E8DF-5337-45BA-A6FD-4CA01EDF54A7

