耐药性嗜水气单胞菌感染致四眼斑龟死亡的病例报告
赵 颖 , 杜孟泽 , 黄亚东 , 张 迪 , 林德贵
(1.中国农业大学动物医学院 , 北京 海淀 100193 ; 2.北京龟道生物科技有限公司 , 北京 昌平 102208)
龟鳖行业是两广地区的特色和新兴产业,是农民增收致富的重要途径[1]。近年来,随着人民对龟鳖宠物和药用需求的不断增加,龟鳖市场逐渐繁荣[2]。然而,由于市场发展速度与饲养管理发展的不平衡,导致龟鳖疾病频发[3],尤以细菌感染类疾病引起的经济损失最为严重[4-5]。当前引起广西地区龟鳖病害的细菌以嗜水气单胞菌、肺炎克雷伯菌和变形杆菌为主,其中又以嗜水气单胞菌最为常见[6]。气单胞菌是一种广泛分布于水体的常见菌[7],其中致病性的嗜水气单胞菌是引起水生动物发病的重要病原体之一,可对龟鳖养殖行业造成严重的经济损失[8]。为此在水产养殖中使用抗生素成为治疗该疾病的主要手段。但大量研究表明,嗜水气单胞菌对多种药物已经产生耐药性[9]。本试验中的四眼斑龟来源于广西防城港市某养殖户,养殖期间有大量龟突发四肢肿大、精神不振等症状,重者甚至死亡。养殖场常用的抗生素类药物有青霉素、庆大霉素与恩诺沙星。疫情期间,驻场兽医曾对患病龟注射青霉素进行治疗,但是治疗效果不佳。为查明死亡原因并给予养殖户合理的防疫意见,本试验对病死龟进行了组织病理学检查和病原分离纯化,并对分离的菌株进行了16S rDNA测序、全基因测序、耐药性试验和小鼠回归感染试验。旨在鉴定病原体,为科学防控龟类细菌疾病提供一定的参考依据。
1 材料与方法
1.1 主要试剂与仪器 MH(A)琼脂培养基、MH(B)肉汤培养基,均购自北京陆桥科技有限公司;无菌脱纤维绵羊血、2×TaqPCR Master Mix,均购自北京索莱宝科技有限公司;DNA Marker、琼脂糖和核酸染料,均购自生工生物工程(上海)股份有限公司;大肠杆菌ATCC 25922,购自杭州天和微生物试剂有限公司;细菌DNA提取试剂盒,购自北京天根生物科技有限公司。本试验所用引物均由北京天一辉远生物科技有限公司合成。PCR仪,购自赛默飞世尔(中国)科技有限公司集团;光学显微镜,购自奥林巴斯(中国)有限公司。
1.2 实验动物 SPF级BALB/c小鼠,雄性,6~8周龄,体重(15±1)g,购自北京维通利华实验动物科技有限公司。
1.3 试验方法
1.3.1 组织病理学检查 分离切取剖检死龟的脏器组织,10%福尔马林溶液固定1周,按常规脱水、透明、包埋、切片,经苏木精-伊红(Htoxylin eosin, H.E.)染色,于光学显微镜下观察并记录各脏器组织的病理变化。
1.3.2 细菌分离与分离菌16S rDNA分子鉴定 无菌操作于发病龟的各组织(皮下、心脏、肾脏)切面蘸取病料,接种于血平板上,28 ℃培养24 h,分别挑取优势菌落进行多次划线纯化,直到得到形态一致、特征稳定的菌落。选取单个菌落接种于琼脂斜面,28 ℃培养18 h,置4 ℃冰箱保存。取3种不同组织中分离的代表菌株,菌液100 ℃煮沸10 min后作为PCR模板。PCR引物:F:5′-GTACTCCTACGG-GAGGCAGCA-3′; R: 5′-GTGGACTACHVGGGTWTCTAAT-3′。PCR程序:94 ℃ 5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 2 min,共30个循环;72 ℃ 10 min。切胶回收后送往北京天一辉远生物科技有限公司进行测序,测序结果在NCBI数据库中进行比对。
1.3.3 药敏试验 本试验中使用了氨苄青霉素、链霉素、卡那霉素、庆大霉素、阿米卡星、恩诺沙星、氟苯尼考和喹乙醇测试分离的嗜水气单胞菌的药物敏感性。将待测菌接种于MH(B)肉汤培养基中,37 ℃、200 r/min培养12 h,用MH(B)肉汤将菌液稀释到5.00×105CFU/mL。取无菌96孔细胞培养板,将抗菌药物母液体按照倍比稀释的方法稀释成10个梯度,使用微量加样器将稀释好的药物加入96孔板中。每孔含有100 μL药液和100 μL稀释好的待测菌液。同时将200 μL菌液作为阳性对照,200 μL MH(B)肉汤作为阴性对照。试验过程中使用大肠杆菌ATCC 25922作为质控菌株,每组药物重复3次。细菌和药物充分混合后置于37 ℃培养18 h后观测结果。
1.3.4 全基因组测序 使用细菌DNA提取试剂盒提取菌体DNA。全基因组草图由上海美吉科技有限公司进行测序得到。使用MiSeq测序平台测序获得的序列,由SOAPdenovo 2软件进行拼装。
1.3.5 动物回归感染试验 取皮下组织分离菌接种于血平板,28 ℃培养20 h,挑取单菌落接种于LB培养液中扩大培养18~24 h。培养物离心后,沉淀物用生理盐水重新悬浮。重悬菌液计数后,稀释成所需浓度。分别将4种浓度的菌液接种于各小鼠体内。接种量分别为1.00×108、4.00×107、2.00×107CFU/只和1.00×107CFU/只。质控对照组接种大肠杆菌(ATCC 25922)1.00×108CFU/只。48 h后记录每组死亡比例,计算出分离菌半数致死量。将接种量为2.00×107CFU/只的小鼠的器官进行匀浆并涂板,28 ℃培养18 h,计算不同器官的载菌量。将小鼠脏器中分离所得的菌进行菌种鉴定,确定是否与接种菌一致。本试验进行过程中,所有操作均严格遵守实验动物伦理和福利委员会制定的标准操作规范进行。
1.3.6 数据分析 半数致死量的计算方式是将攻菌数取自然对数,将死亡率换算成“概率单位”。剂量的自然对数与概率单位呈现线性关系,利用Excel软件生成两者关系的线性回归方程,即可通过回归方程推算出半数致死量[10]。
2 结果
2.1 病理剖检 动物双前肢与脖颈处有肿胀,肿胀处皮肤发绀,除此之外体表无其他病理性异常症状。锯开两侧背腹甲间连接的桥板结构,用钳剪断四肢附近骨性连接结构,掀开腹甲,暴露体腔腹侧,过程中有大量淡黄色澄清液体流出,无血性、脓性分泌物。观察体腔各脏器外观,可见肝脏横亘体腔中段位置,包被胃、肠、胰腺等部分消化器官,其表面有光泽,边缘清晰锐利,无明显充血、淤血情况。肠道与胃未见水肿、气体充盈等现象,十二指肠近胃幽门部有一直径约0.6 cm的出血斑。位于体腔背侧的肺脏内有多量气体,充盈呈多泡囊状,半透明,无明显血性或泡沫状分泌物。暗红色至黑色的心脏位于体腔中央位置,心包膜完整清晰,与附近脏器无黏连现象。心包膜外脂肪组织中有胶冻状物质蓄积。前肢肿胀部位剖检发现,左前肢上臂肌群僵直变硬,淤血严重,外观呈黑色,右前肢皮下有气体充盈。剪开盆腔的骨性结构,其中脏器(肾脏、膀胱、半阴茎、睾丸等)未见肉眼可见病变。
2.2 组织病理学检查 心脏腔室内有大量淤血,心脏内膜水肿明显,局部视野心肌内有大量异嗜性粒细胞浸润(图1A、1B),提示心肌炎。肝脏部分中央静脉淤血,未见其他显著异常。小肠与大肠的浆膜层、肌层、黏膜下层与黏膜层结构清晰。小肠绒毛顶端局部存在黏膜缺失(图1C)。大肠黏膜光滑平整,无溃疡脱落等现象,但可见浆膜水肿(图1D)。肠管内未见明显的异物。其他器官在显微镜下均未见明显变化。

图1 四眼斑龟脏器组织病理学检测 (H.E.染色)
2.3 细菌分离与16S rDNA分子鉴定 分离菌在血平板上生长良好,形成边缘整齐、表面湿润、光滑的圆形菌落,菌落呈半透明、灰白色,并可形成明显的β溶血环。PCR扩增序列大小为500 bp左右(图2),通过BLAST序列比对,扩增出的序列与Aeromonashydrophila相匹配(相似度为99.5%)。结果表明该分离菌为嗜水气单胞菌(Aeromonashydrophila)。
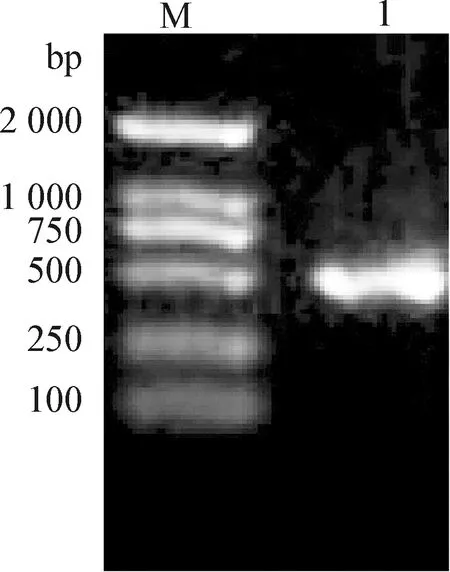
图2 分离菌的16S rDNA PCR鉴定
2.4 药物敏感试验 结果显示分离菌对氨苄青霉素和喹乙醇不敏感(表1)。

表1 分离菌的药敏试验
2.5 全基因组测序 经过MiSeq平台测序,共获得4 582 510个短序列,包含1 383 918 020对碱基序列,共组装55个序列片段(Scaffolds)。使用CGE(Center for Genomic Epidemiology)数据库将基因组信息进行比对分析,最终获得了分离菌所包含的毒力基因信息。其中攻击性毒力因子以黏附相关的为主,而防御性毒力因子以抗吞噬作用的为主。其中攻击性毒力因子包含了分泌系统相关(如T6SS)、黏附相关(如Flagella)和毒素相关(如Cya)的基因,见表2。使用CARD(Comprehensive Antibiotic Resistance Database)数据库对基因组进行比较分析,最终确定分离菌的基因组含有AmpH和Imis两个耐药基因(表2)。
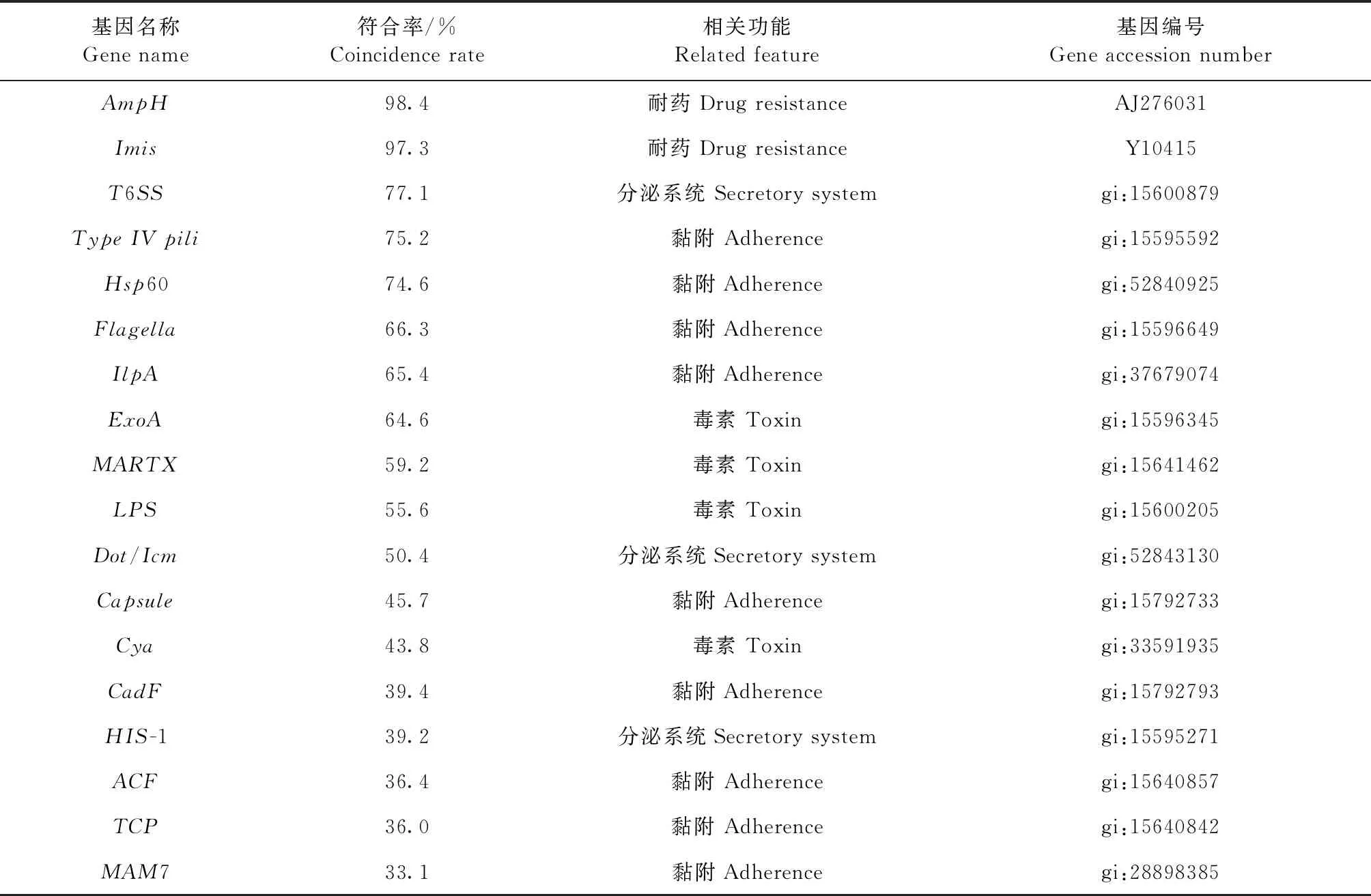
表2 分离菌所包含的毒力基因与耐药基因
2.6 动物回归感染试验 接种分离菌的各组小鼠均存在精神抑郁、被毛凌乱等症状。48 h内2个高剂量组小鼠全部死亡,2.00×107CFU/只组的小鼠死亡3只,1.00×107CFU/只组的小鼠没有死亡,质控对照组小鼠没有死亡。根据不同组小鼠的死亡率,得出小鼠的半数致死量为2.00×107CFU/只。注射量2.00×107CFU/只组的小鼠,不同内脏的载菌量如图3所示,分离菌接种后在小鼠体内主要侵袭脏器为肝脏(1.8×107CFU)、肾脏(1.2×107CFU)和肺脏(6.2×106CFU)。对小鼠分离菌重新进行16S rDNA鉴定,结果显示分离菌与接种菌一致,均为嗜水气单胞菌。
3 讨论
在治疗细菌疾病时,了解致病菌的耐药性才能制订出科学的防治计划。在龟鳖发病时期,养殖户常盲目使用抗生素治疗,但效果多不明显,长期使用还会产生耐药菌株。据覃俊奇等[6]报道,广西63例龟鳖病例中对氨苄青霉素敏感的细菌占27.1%。康绍珠等[11]调查显示,从甲鱼中分离的4株嗜水气单胞菌均对青霉素G不敏感。在其他水产品种中分离的嗜水气单胞菌对β-内酰胺类也普遍存在耐药性[12-13]。而本试验结果显示,分离菌对氨苄青霉素耐药,且其基因组内含有AmpH和Imis两个耐药基因,这可能与饲养场长期使用青霉素治疗病龟有关。虽然本试验中的分离菌对喹乙醇也不敏感,但并未在基因组中找到类似oqxAB等与喹乙醇相关的耐药基因[14],这可能是由于分离菌含有新型耐药基因,需要进一步研究。全基因组测序结果显示,本试验分离菌的毒力因子主要起黏附作用,令细菌更容易感染动物。
小鼠回归感染试验证明,该分离菌具有致病能力,可以在低于质控菌株接种量的情况下致死小鼠。且从死亡小鼠中也分离到了接种菌,符合科赫法则。攻菌后小鼠不同内脏载菌分布结果显示,分离菌主要侵袭小鼠的肝脏与肾脏。由于实验动物与本体动物尚有区别,因此本试验分离菌的致病特点与致病机理尚需要回归本体动物进行进一步深入研究。
综上所述,本试验确定了引起广西养殖户四眼斑龟发病的病原菌为嗜水气单胞菌,并成功将其分离培养。该菌基因组内包含AmpH与Imis两个β-内酰胺耐药基因,且对氨苄青霉素与喹乙醇具有耐药性。本试验为该地区观赏龟防控和水产业发展提供了参考数据。但由于相关研究较少,尚且无法解析该菌产生对喹乙醇耐药的原因,因此还需对该分离菌进行更深入的研究和分析。

