鼷鼠肉螨的形态学观察和分子鉴定
刘 馨 , 田永路 , 王海良 , 李夏莹 , 潘保良
(1.中国农业大学动物医学院 , 北京 海淀 100193 ; 2.北京大学实验动物中心 , 北京 海淀 100871 ;3.北京市兽药监察所 , 北京 大兴 102629)
寄生于皮毛上的螨虫是实验小鼠常见的病原体,常见的有鼷鼠肉螨(Myobiamusculi)、亲近雷螨(Radfordiaaffinis)、鼠癣螨(Myocoptesmusculinis)[1]。其中,鼷鼠肉螨对小鼠的致病性最强。螨感染后会导致实验小鼠出现溃疡性皮炎[2-3]、全身免疫反应[4-5]、生殖指数下降[2],从而影响科学实验的准确性。有数据表明,在北美洲实验小鼠螨的感染率达到12%[6]。实验小鼠被广泛应用于科学研究当中,在我国实验动物质量检测中偶有发现鼷鼠肉螨的感染,但目前国内对鼷鼠肉螨感染的报道较少,鼷鼠肉螨的具体形态学观察的文献大多是模式图,很少有镜下形态学相关图片,并且目前国内对于鼷鼠肉螨的分子鉴定方面尚未有报道。本试验报道实验小鼠感染鼷鼠肉螨的案例,收集整理了鼷鼠肉螨的镜下形态学图像,并建立了聚合酶链式反应(Polymerase chain reaction, PCR)分子鉴定方法,以期为从事实验动物的工作人员提供参考。
1 材料与方法
1.1 实验动物 普通级C57BL/6J小鼠,10周龄,饲养于独立通风笼具(IVC)系统,感染小鼠拨开体表被毛后可见体表有毛屑样物质,其他临床症状不明显。
1.2 仪器设备 倒置显微镜及成像系统,奥林巴斯有限公司产品;基因扩增仪,赛默飞世尔科技有限公司产品;电泳仪,北京六一生物科技有限公司产品;凝胶成像分析系统,上海天能科技有限公司产品。
1.3 试剂 丁香油、树胶,均购自阿拉丁公司;乙醇,购自北京化工厂;通用基因组DNA提取试剂盒,购自北京索莱宝科技有限公司;2×TaqPCR Mix,购自北京汇天东方科技有限公司。
1.4 诊断方法
1.4.1 透明胶纸法 在小鼠清醒状态下,固定小鼠,在每只小鼠的头部、颈部、腹部、背部粘贴1条4 cm ×2 cm的透明胶带。之后将胶带粘贴到载玻片上,在光学显微镜下检查是否存在螨虫或螨虫卵。
1.4.2 被毛采集法 小鼠进行轻微麻醉或安乐死后,立即将其置于解剖光学显微镜下进行全身毛皮检查,用镊子分开毛发,从口角开始到尾基部结束,重点检查后颈部、腹部两侧和腹股沟区域,采集被毛观察并收集螨虫卵或成虫,用于形态学详细观察和PCR检测。
1.5 螨虫封片的制作 用解剖针挑取小鼠皮肤上的螨虫,或采集螨虫感染部位的皮毛,将其放到载玻片上,分别于30%、40%、50%、60%、70%、80%、90%、95%和100%等不同浓度的酒精中浸泡脱水(各0.5~1 h),之后用1∶1无水乙醇和丁香油混合溶液、丁香油原液分别透明0.5~1 h,用树胶封片后在显微镜下观察。
1.6 PCR方法检测并鉴定鼷鼠肉螨 建立鼷鼠肉螨PCR快速检测方法,首先需要选取适合的基因。在大多数研究中,18S rRNA基因通常用于螨虫系统发育分析,该基因也能用于螨的分子鉴定。本试验选定18S rRNA基因(引物MC-18S-F1:5′-CTTGCTCAAAGATTAAGCCATGCA-3′,MC-18S-F2:5′-TGA TCCTTCCGCAGGTTCACCT-3′)进行扩增[7],应用于小鼠体表鼷鼠肉螨的检测。首先采集皮毛通过显微镜进行观察,选择含有疑似鼷鼠肉螨和卵的样品。之后筛选出阳性样本,用组织DNA提取试剂盒提取DNA,于-20 ℃保存。未感染小鼠的毛发作为阴性对照。PCR检测总反应体系为20 μL:10 μL 2×TaqPCR Mix,1 μL正向引物,1 μL反向引物,6 μL 模板DNA,2 μL Nuclease-free water。PCR反应条件:98 ℃ 10 s,1个循环;98 ℃ 10 s,60 ℃ 30 s,72 ℃ 2.5 min,40个循环;72 ℃ 5 min,1个循环。用琼脂糖凝胶电泳检测PCR扩增产物,产物由生工生物工程(上海)股份有限公司使用ABI 3730XL DNA分析仪进行测序,将得到的测序结果与NCBI数据库进行序列比对分析。
2 结果
2.1 形态学鉴定 在显微镜下,所检出的螨虫大体形态特征如图1~4所示:虫体呈白色,长椭圆形,中央稍宽,前后两端稍窄,与其他种类的螨虫一样,有4对足,第1对足压缩变短,位于头部顶端,螨用其抓附鼠毛,后3对足均由5节组成,且跗节末端各有1根爪样的构造(爪间突爪),呈镰刀状[8]。螨虫后3对足的体侧缘有明显外突的现象。口器小,有的虫体伸出的口器较长,有小而简单的须肢及匕首状的螯肢。背部、腹部均分布有刚毛,其中尾端有2根特征性的后端毛,从尾乳突中长出。
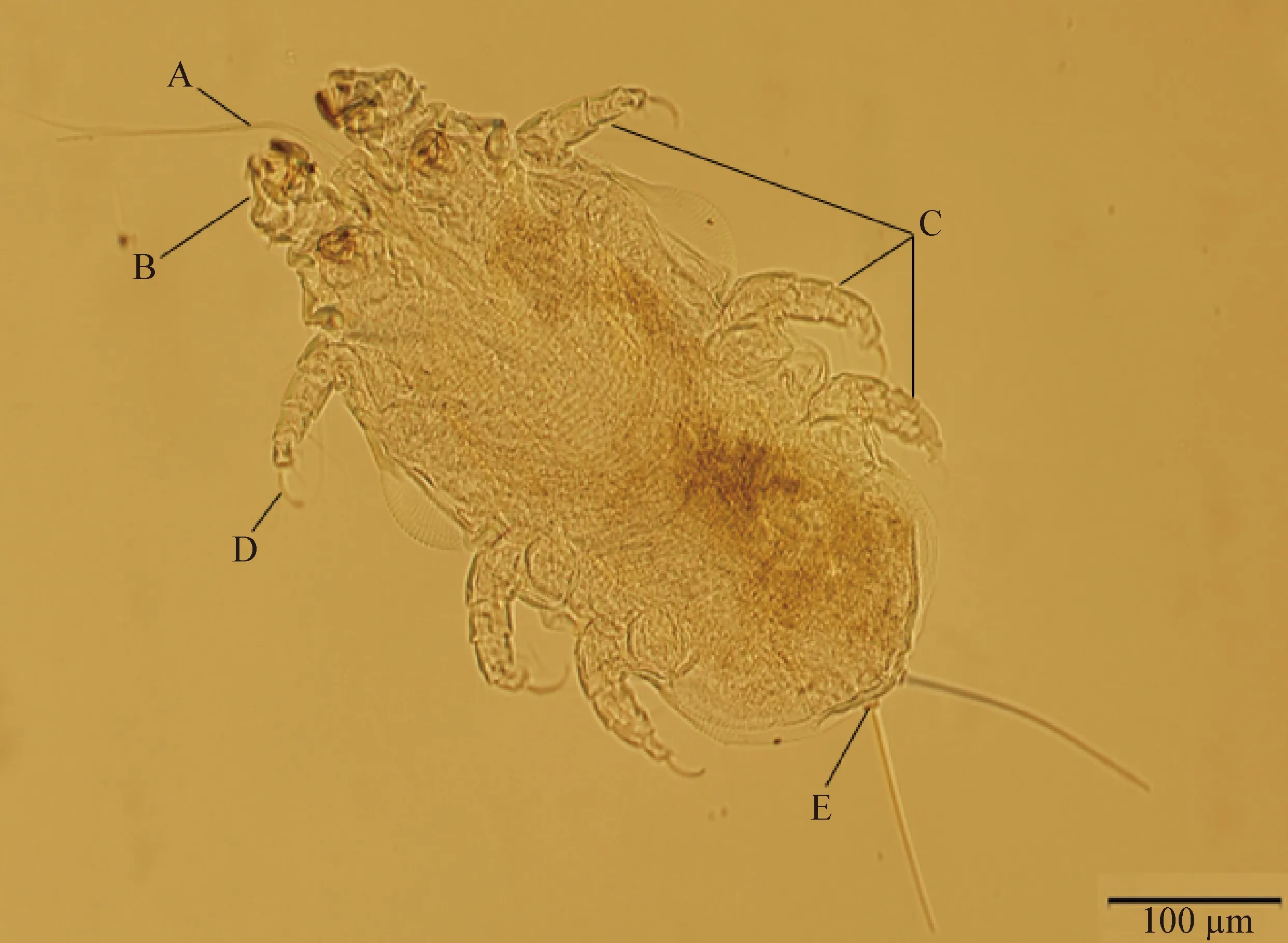
图1 雄性鼷鼠肉螨(腹面)
经形态学鉴定,初步确定小鼠感染螨虫为鼷鼠肉螨(M.musculi)。鼷鼠肉螨与另一种亲近雷螨(Radfordiaaffinis)形态上非常相近,但其与鼷鼠肉螨的区别是第2对足有1对跗爪,而本试验观察到的虫体只有1只跗爪,所以该螨很可能为鼷鼠肉螨。
2.1.1 鼷鼠肉螨雄虫形态学 鼷鼠肉螨雄虫大小为(0.325~0.479) mm×(0.186~0.217) mm(n=5),体型与雌虫相比较小,有较长的口器,体表分布有刚毛,尾端有1对相互靠近的尾乳突,每个尾乳突上各有1根明显的刚毛。雄螨的尾乳突相互靠近,依靠尾乳突之间的距离可以辨别雄螨和雌螨。体表有清晰的条纹状纹路结构。背面和腹面结构无可清晰分辨的特殊性结构(图1、图2)。

图2 雄性鼷鼠肉螨(背面)
2.1.2 鼷鼠肉螨雌虫形态学 鼷鼠肉螨雌虫大小为(0.404~0.529) mm×(0.211~0.233) mm(n=5),体表分布有刚毛,尾端的尾乳突与雄性相比相距较远,2根刚毛从尾乳突中长出,长而明显,肛门位于体后缘。雌螨体表纹路模糊,腹部可见大量圆形孕卵存在。背面和腹面结构无可清晰分辨的特殊性结构(图3、图4)。
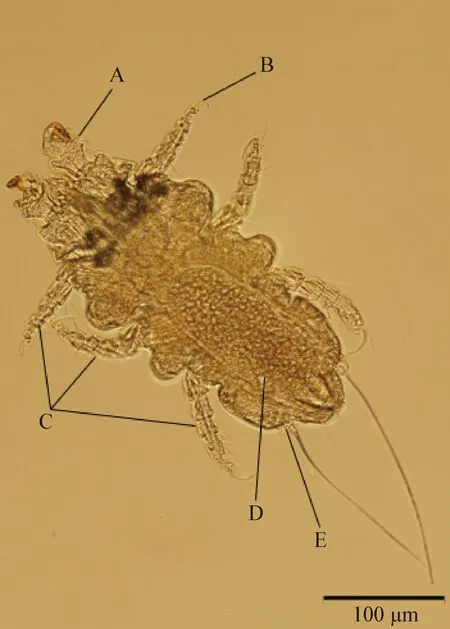
图4 雌性鼷鼠肉螨(背面)
2.1.3 鼷鼠肉螨虫卵形态学 鼷鼠肉螨的虫卵形态如图5所示:虫卵呈宽椭圆形,大小约为0.196 mm×0.09 mm(n=5),紧密附着在小鼠的绒毛基部或中部。虫卵黏着处有一层胶性物质,除去胶性物质后,光镜下的虫卵卵壳表面光滑,无特殊构造。
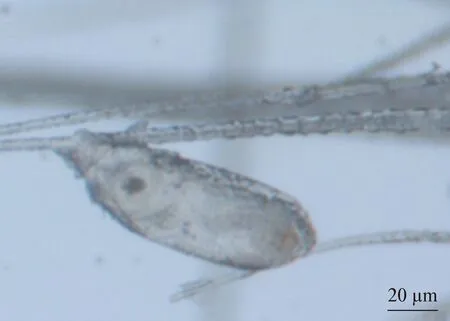
图5 鼷鼠肉螨卵
2.2 鼷鼠肉螨的分子鉴定 对镜检螨阳性样本所提取的DNA进行PCR检测,结果如图6所示,样本均可检出鼷鼠肉螨靶标基因特异性目的片段,大小约1 807 bp,与预期片段大小相符。将PCR产物进行测序得到基因序列。将获得的鼷鼠肉螨基因序列提交至NCBI数据库进行比对分析,结果显示得到的DNA序列与国际上公布的鼷鼠肉螨18S rRNA序列(GenBank登录号为JF934703.1)同源性达98.68%。本试验中检测出的鼷鼠肉螨18S rRNA基因与NCBI数据库中已发表的部分虫株18S rRNA序列构建的分子进化树见图7。PCR扩增和测序结果从分子水平证明了鼷鼠肉螨的感染。
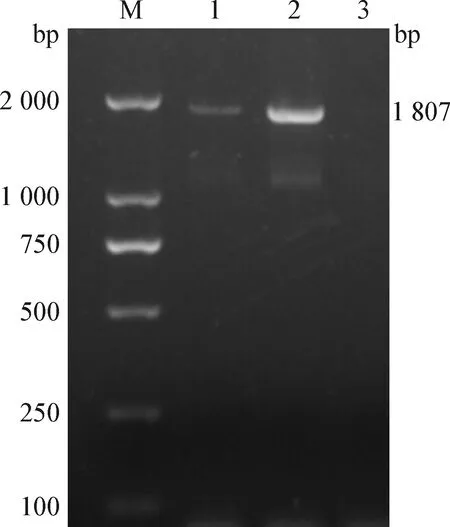
图6 鼷鼠肉螨核酸琼脂糖凝胶电泳
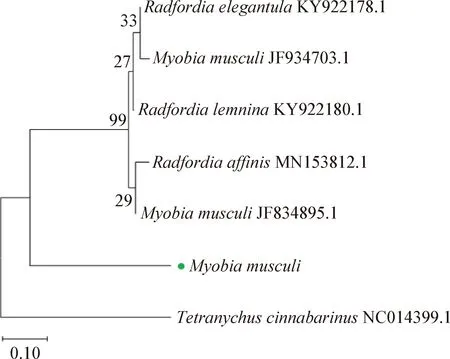
图7 Myobia musculi 18S rRNA基因组序列遗传进化分析
3 讨论
实验小鼠被广泛应用于医药开发、教学实验、药品生产、生物检定等方面,随着国内科研水平的提高,国内外实验动物机构间动物的交换日益频繁,转基因动物的使用数量日益增加,实验小鼠寄生虫感染问题日益凸显。
鼷鼠肉螨是小鼠感染最常见的螨虫之一,常寄生在小鼠的头部、颈部和背部,通过直接接触和间接接触在种群中进行传播。小鼠感染鼷鼠肉螨后会出现一系列临床症状和生理学反应,这对科学实验的准确性会造成不良影响。对鼷鼠肉螨易感程度最高的为野生鼷鼠,这一品种的小鼠即使是感染少数的鼷鼠肉螨,也会引起脱毛、皮肤红斑、瘙痒、表皮剥脱、溃疡、脓皮病等反应[9]。在本试验观察过程中,C57BL/6J小鼠未发生明显的临床症状,因为该品系小鼠是野生鼷鼠的变种,在驯化过程中可能会降低其对鼷鼠肉螨的易感性。但是如果长期不对患病小鼠进行治疗处理,可能仍会导致小鼠出现严重的临床症状。
有研究对鼷鼠肉螨成虫大小进行了测量,雌螨体长400~500μm,雄螨体长280~320μm,体宽均在160~180μm[10]。本试验对发现的螨虫进行了体长和体宽的测量,雌螨大小为(0.404~0.529)mm×(0.211~0.233)mm(n=5),大小与文献所报道的范围基本一致;雄虫大小为(0.325~0.479)mm×(0.186~0.217)mm(n=5),大小略大于文献报道的大小范围。由于鼷鼠肉螨的体型很小,正常情况下肉眼难以发现,当发现小鼠感染鼷鼠肉螨时,往往已经感染十分严重,所以需要寻找一种有效、快速的检测方法,以便在感染初期就能检测到鼷鼠肉螨,有利于早期对鼷鼠肉螨进行有效防控。
有多种方法可采集鼷鼠肉螨并进行检测,如透明胶纸法、被毛采集法、皮肤刮擦法等。透明胶纸法操作最为简便,所以在检测初期,本试验采用该方法对小鼠感染情况进行了检测,但是在使用该方法过程中,阳性小鼠检测结果出现了假阴性的情况,所以本试验结合了多个部位采集毛发的方法对小鼠进行检测,结合被毛采集法后,能有效提高检出率。有研究报道,皮肤刮擦法是最有效的检测方法,但该方法需要对小鼠进行麻醉或安乐死后方可进行,容易对实验小鼠造成损伤,而且这种方法工作量大,检出效率低,不利于快速对实验动物的整体感染情况进行检查[11]。PCR检测方法能够通过使用拭子对整个动物、笼舍、架子等进行全面采样,从而减少工作量,提高检出率[12],未来可作为鼷鼠肉螨的检测方法之一。建立PCR检测方法首先需要找到合适的检测基因,本试验选择了鼷鼠肉螨18S rRNA基因对镜检阳性样本进行了分子生物学鉴定,该PCR方法能有效扩增出鼷鼠肉螨的目的片段,与Lee等得出的结果一致,证明PCR检测方法可用于鼷鼠肉螨的检测[13]。

