猪肌内脂肪沉积相关基因的筛选及其表达特性分析
杨 帅,史明月,李文霞,员佳乐,孙 迪,路 畅,杨 阳,蔡春波,高鹏飞,郭晓红,李步高,曹果清
(山西农业大学动物科学学院,太谷 030801)
脂肪沉积是一个受多种因素调控的复杂过程,脂肪组织尤其是肌内脂肪组织对于畜禽肉品质的改善有重要影响。肌内脂肪(intramuscular fat,IMF)又被称为大理石纹脂肪组织,位于肌纤维旁及肌束膜结缔组织,主要由甘油三酯(triacylglycerol,TG)和磷脂构成,其含量影响肉的嫩度、多汁性和风味,IMF含量低会导致肉质口感变干[1-2]。猪肉IMF含量在2.0%~3.0%时,胴体瘦肉率适中,肌肉呈现较为理想的大理石纹,嫩度显著提高,口感也有所改善[3-4]。猪IMF含量受遗传、环境因素、营养水平等多种因素影响。其中,遗传因素对不同品种IMF含量起决定性作用,涉及脂质和碳水化合物代谢、细胞信号转导、刺激反应及组织的基因表达水平等多种调控途径[5-6]。 脂肪细胞作为脂肪组织的主要组成单位,其增殖和分化在脂肪沉积过程中具有重要作用[7]。
转录组测序可精确获得某一物种在特定条件下所有转录产物的表达状况[8]。利用高通量测序计算mRNA表达量,结合生物信息分析可高效获得性状相关基因的表达模式与功能差异[8]。目前,转录组测序已广泛应用于畜禽重要经济性状相关的分子机理研究。Muoz等[9]通过对伊比利亚猪背最长肌进行转录组分析,获得了VDR、ATF6、ARID5B、CREB1、SP1 5个参与脂肪形成的调控因子。Xu等[10]比较约克夏猪和魏猪背最长肌转录组测序数据,筛选到717个差异表达基因,获得了FABP3、PDK4、ACSL1和UCP3共4个与脂肪代谢相关的候选基因。吴垚群等[11]对松辽黑猪和长白猪背最长肌进行转录组测序分析,筛选获得DGKα、FGF1、BTD、HLCS、LPIN1、FGFR1和ZNF7共7个参与脂质代谢的候选基因。
马身猪是山西省地方优良猪种,分布于山西北部偏寒地区,体质健壮,抗逆性强,肉品质好;大白猪为引进品种,瘦肉率高,生长速度快[12]。Zhao等[13]研究表明,相同饲养管理水平下,马身猪终末体重低于大白猪,但背部皮下脂肪厚度和IMF含量高于大白猪,且肌内脂肪细胞数量多,成脂终末分化能力强。目前,关于马身猪和大白猪IMF含量差异形成的分子机理尚未明确。本研究以马身猪和大白猪为试验动物,基于转录组测序比较两品种背最长肌差异基因,通过GO、KEGG和GeneCards等生物信息学分析,筛选可能影响IMF沉积的差异基因,并对其表达特性进行分析,为阐明马身猪和大白猪IMF沉积差异机理和改善肉品质提供一定的理论借鉴。
1 材料与方法
1.1 材料
1.1.1 样品采集 180日龄马身猪(MS)与大白猪(LW)均由山西省大同市种猪场提供。选取健康的马身猪和大白猪各3头,相同条件下饲养,于180日龄时屠宰。分别采集同一部位背最长肌组织、腹部和背部皮下脂肪组织,冻存管分装后置于液氮中冻存,随后于-80 ℃保存备用。猪肌内脂肪细胞由山西农业大学动物遗传育种实验室提供。
1.1.2 主要试剂及仪器 TRI Reagent®购自Sigma公司;TruSeqTMStranded Total RNA Library Prep Kit购自Illumina公司;ReverTra Ace qPCR RT Master Mix试剂盒、AceQ®Universal SYBR qPCR Master Mix试剂盒均购自南京诺唯赞生物科技有限公司;油红O染色液购自北京索莱宝科技有限公司。全自动样品快速研磨仪(JXFSTPRP-24L)购自上海净信有限公司;BIO-CFX荧光定量PCR仪(BIO-CFX96 Touch)购自Bio-Rad公司。
1.2 方法
1.2.1 转录组测序及原始数据质控 使用TRI Reagent®提取背最长肌组织样总RNA。使用TruSeqTMStranded Total RNA Library Prep Kit将质量合格的RNA分别混池,构建链特异性文库。使用Illumina HiSeq 2500平台完成高通量测序[14]。
1.2.2 差异基因筛选与分析 基于FPKM(Fragments Per Kilobase of transcript per Million fragments mapped)值,参考错误发现率(false discovery rate,FDR)和差异倍数(FoldChange,FC),利用Edge R包进行基因差异表达分析,设置阈值为FDR<0.05和log2|FoldChange|≥1;利用PheatMap R包分析样品间差异基因的分布;利用Cluster Profiler R包进行GO功能富集分析;利用OmicShare云平台进行KEGG通路注释;利用GeneCards查询差异基因功能。
1.2.3 肌内脂肪细胞培养及成脂诱导 复苏猪肌内脂肪细胞,待细胞密度达99%时,在生长培养基中添加100 μmol/L吲哚美辛、5 μmol/L胰岛素、0.5 mmol/L IBMX和1 μmol/L DEX诱导成脂分化;48 h后,更换生长培养基,并添加5 μmol/L胰岛素;分别收集成脂分化0、1、3、5及7 d的细胞样品,油红O染色依据试剂盒要求进行,染色结束后利用倒置显微镜观察拍照。
1.2.4 反转录及引物设计 分别提取2个品种猪背最长肌组织,背部和腹部皮下脂肪组织,以及成脂分化0、1、3、5、7 d的肌内脂肪细胞总RNA。使用ReverTra Ace qPCR RT Master Mix试剂盒反转录合成cDNA,-20 ℃保存备用。在NCBI上查找目的基因mRNA序列,并设计实时荧光定量PCR引物,引物信息见表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 引物序列信息
1.2.5 实时荧光定量PCR分析 以β-actin为内参基因,使用AceQ®Universal SYBR qPCR Master Mix试剂盒和BIO-CFX荧光定量PCR仪检测差异基因的表达量。PCR扩增体系10 μL:模板cDNA 1 μL,SYBR qPCR Master Mix 5 μL,上、下游引物0.8~1 μL,RNase-free ddH2O补足体系。PCR扩增程序:95 ℃ 30 s;95 ℃ 10 s,退火(退火温度见表1)20 s,共45个循环;95 ℃ 20 s,60 ℃ 30 s,95 ℃ 15 s,采集熔解曲线。每个样本取3个生物学重复,基因相对表达水平采用2-△△Ct法计算。
1.3 统计分析
采用SPSS 21.0软件的单因素方差分析和独立样本t检验分析差异显著性。结果采用平均值±标准误表示,P<0.05表示差异显著;P<0.01表示差异极显著。
2 结 果
2.1 差异表达基因筛选及聚类分析
基因表达水平基于FPKM值衡量,共筛选到280个差异表达基因。马身猪相对于大白猪,有152个基因表达下调,有128个基因表达上调(图1)。随机挑选35个基因进行层次聚类分析,结果表明,马身猪和大白猪各自的3个生物学重复样本高度聚类,样品间相关性较高(图2)。上调和下调基因明显分为2个基因簇,且分布与测序结果吻合,表明所用样本分组合理,重复性较好。

图1 差异表达基因火山图Fig.1 Volcano plot of differentially expressed genes
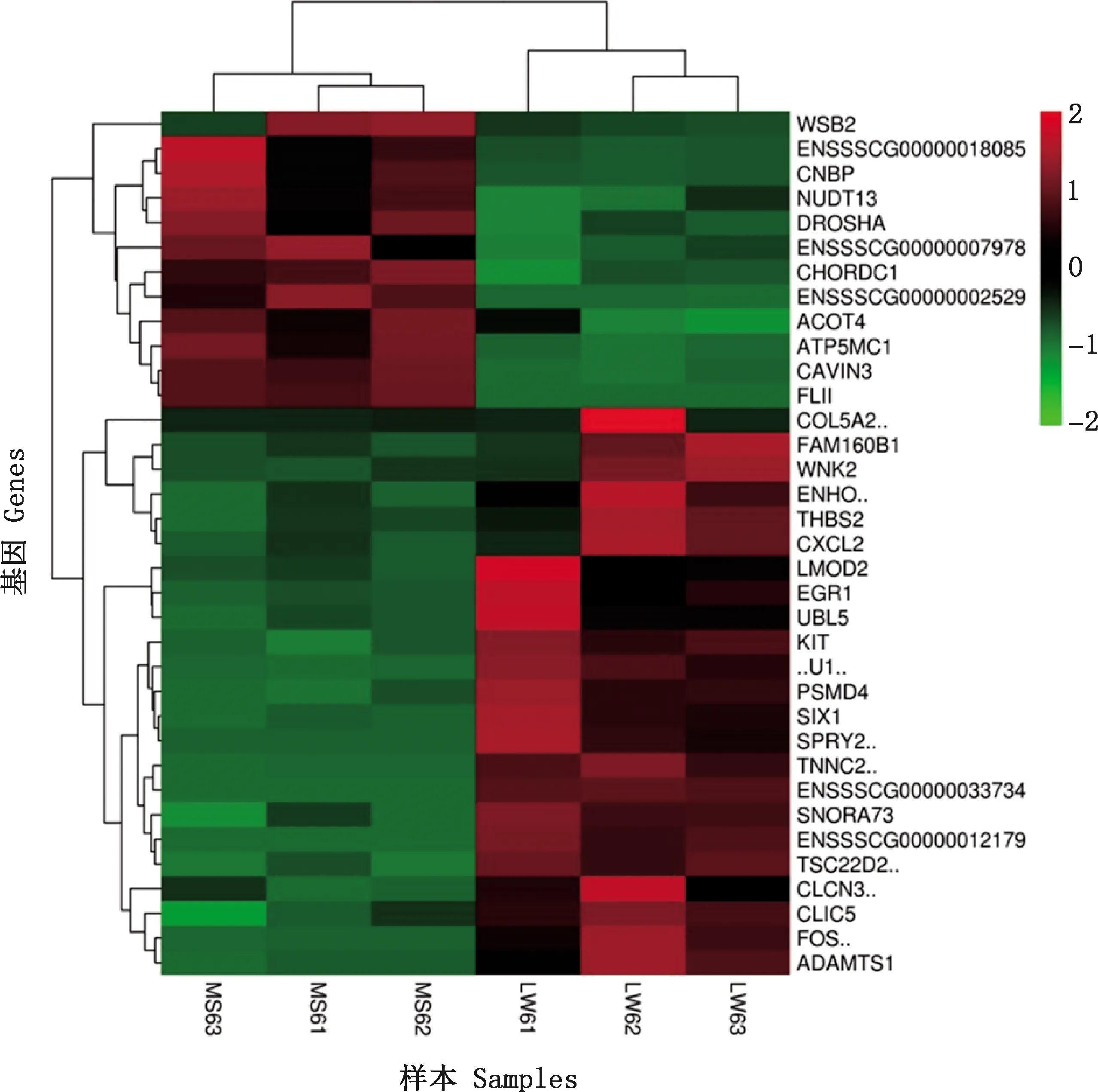
图2 35个差异表达基因聚类分析Fig.2 Cluster analysis of 35 differentially expressed genes
2.2 差异表达基因GO功能富集分析
由图3可知,被注释到的差异表达基因共参与了46个GO条目,在生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组分(cellular component,CC)分类中,包含的亚类分别为24、8和14个。在生物过程分类中,参与细胞过程、代谢过程和生物过程调控的差异表达基因最多,分别为138、111和112个,与肉品质相关联的发育过程也有差异表达基因被注释;在分子功能分类中,结合和催化活性占比最高,富集的差异表达基因数为152和69个,其次是分子功能调节、转录活性调节和抗氧化活性等;在细胞组分分类中,差异表达基因主要参与细胞、细胞部分和细胞器,数目分别为143、143和118个。其中,富集于脂质代谢相关生物过程的GO条目中共有13个差异表达基因(表2)。
2.3 差异表达基因KEGG通路富集分析
KEGG通路富集分析表明,差异表达基因显著富集到12条信号通路,选取前10条显著KEGG通路进行展示,其中,TGF-β信号通路(5.1%)为上调差异表达基因富集最多的通路,PI3K-Akt信号通路(2.3%)为下调差异表达基因富集最多的通路(图4)。PPAR信号通路、MAPK信号通路、脂肪细胞因子信号通路与IMF沉积相关,包括PLIN5、SLC27A6、FABP3、TRAF2、SOCS3、DUSP1和NR4A1等基因(表3)。
2.4 脂肪沉积相关差异表达基因鉴定及其在2个品种猪不同部位脂肪组织中的表达特性
利用GeneCards在线数据库对上述基因的功能进行分析,共筛选获得TRAF2、DUSP1、ACOT4、NR4A1、SLC27A6和PLIN5 6个与脂肪沉积相关的基因(表4),其中,ACOT4、SLC27A6、PLIN5基因为上调基因,TRAF2、DUSP1、NR4A1基因为下调基因。实时荧光定量PCR分析结果表明,在2个品种猪背最长肌中,马身猪NR4A1和DUSP1基因表达量显著或极显著低于大白猪(P<0.05;P<0.01),而马身猪PLIN5基因的表达量极显著高于大白猪(P<0.01),TRAF2、ACOT4和SLC27A6基因在2个品种猪背最长肌中的相对表达量差异不显著(P>0.05)(图5)。
NR4A1和PLIN5基因在马身猪背部皮下脂肪组织中的表达量极显著低于腹部皮下脂肪组织(P<0.01),DUSP1基因表达量差异不显著(P>0.05);在大白猪背部皮下脂肪组织中,NR4A1、DUSP1和PLIN5基因表达量极显著或显著高于腹部皮下脂肪组织(P<0.01;P<0.05)。2个品种相比,大白猪背部皮下脂肪组织NR4A1、DUSP1和PLIN5表达量极显著高于马身猪(P<0.01),腹部皮下脂肪组织NR4A1和DUSP1基因表达量显著高于马身猪(P<0.05),PLIN5基因表达量差异不显著(P>0.05)(表5)。

图3 差异表达基因GO功能富集分析Fig.3 GO function enrichment analysis of differentially expressed genes
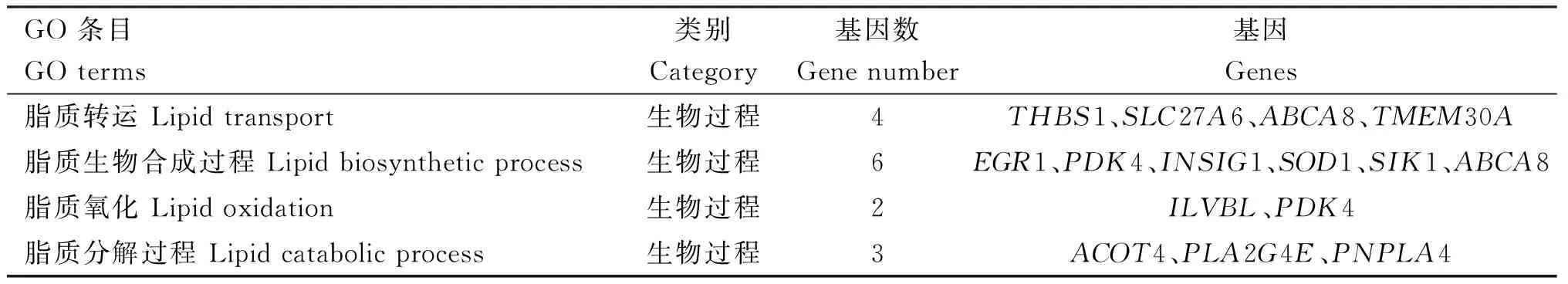
表2 脂质代谢相关GO条目
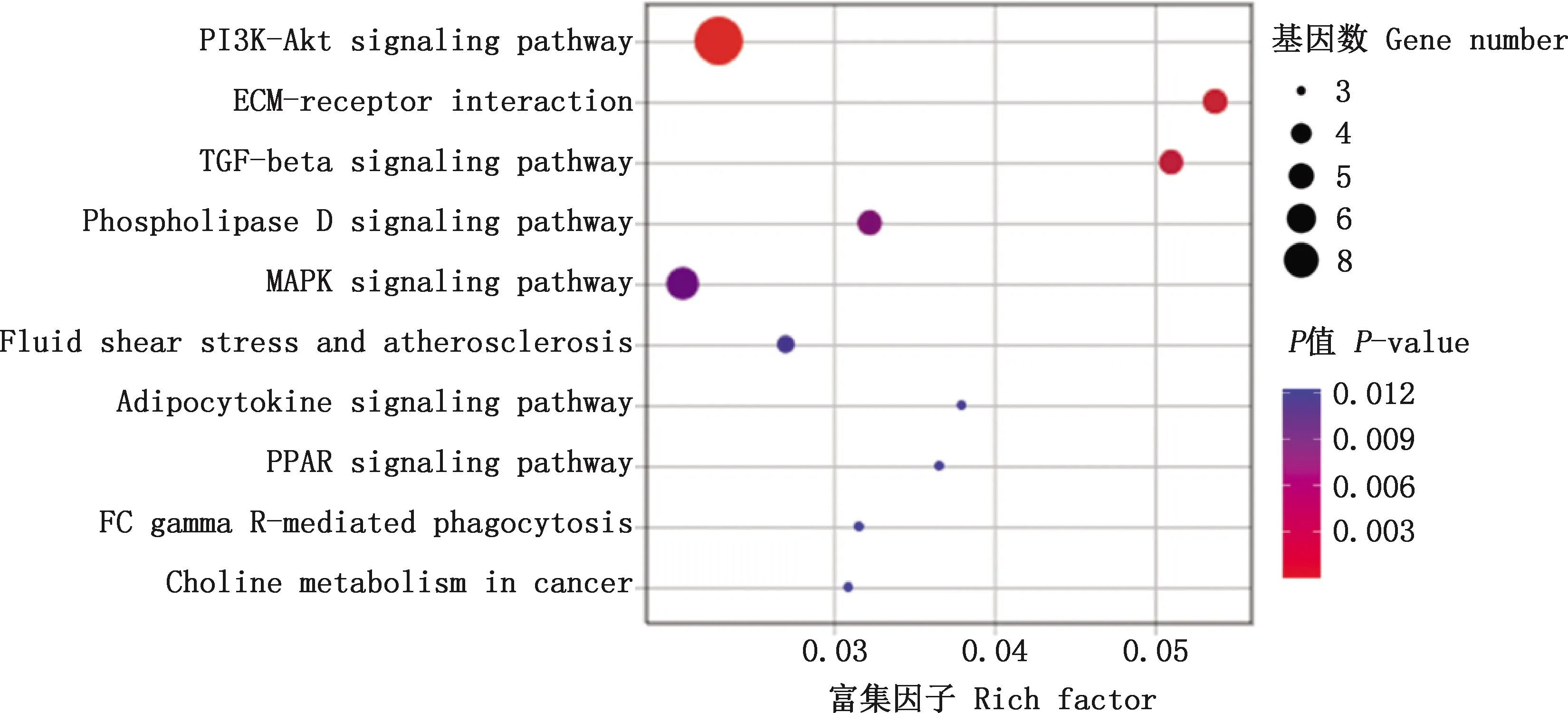
图4 差异表达基因KEGG通路富集Fig.4 KEGG pathway enrichment analysis of differentially expressed genes
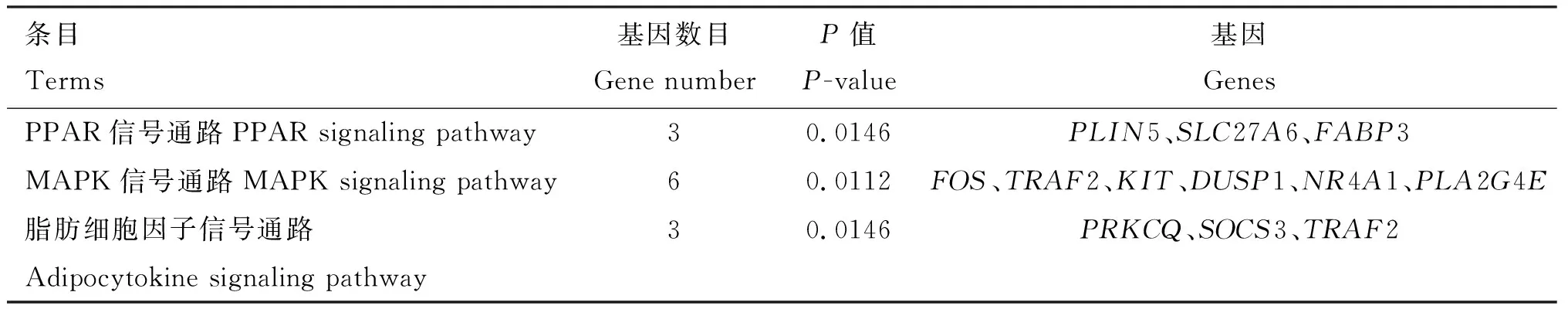
表3 脂质代谢相关KEGG条目

表4 脂代谢相关基因

*,差异显著(P<0.05);**,差异极显著(P<0.01);ns,差异不显著(P>0.05)。表5同*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01);ns,No significant difference (P>0.05).The same as table 5图5 马身猪和大白猪背最长肌差异表达基因相对表达量Fig.5 Relative expression of differentially expressed genes in longissimus dorsi muscle between Mashen and Large White pigs

表5 差异表达基因在2个品种猪背部和腹部皮下脂肪组织中的相对表达量

续表
2.5 脂肪沉积相关差异表达基因在肌内脂肪细胞成脂分化过程中的表达特性
利用实时荧光定量PCR分析脂肪沉积差异表达基因在猪肌内脂肪细胞成脂分化过程中的表达特性(图6),结果显示,随着成脂分化的进行,NR4A1基因表达量呈降低趋势,与0 d相比,成脂分化1~7 d表达量显著降低(P<0.05);DUSP1和PLIN5基因表达量呈上升趋势,且在第5天表达量明显升高,显著高于0 d(P<0.05)(表6)。

图6 猪肌内脂肪细胞(A)及脂滴油红O染色(B)(40×)Fig.6 Porcine intramuscular adipocytes (A) and lipid oil red O staining (B)(40×)
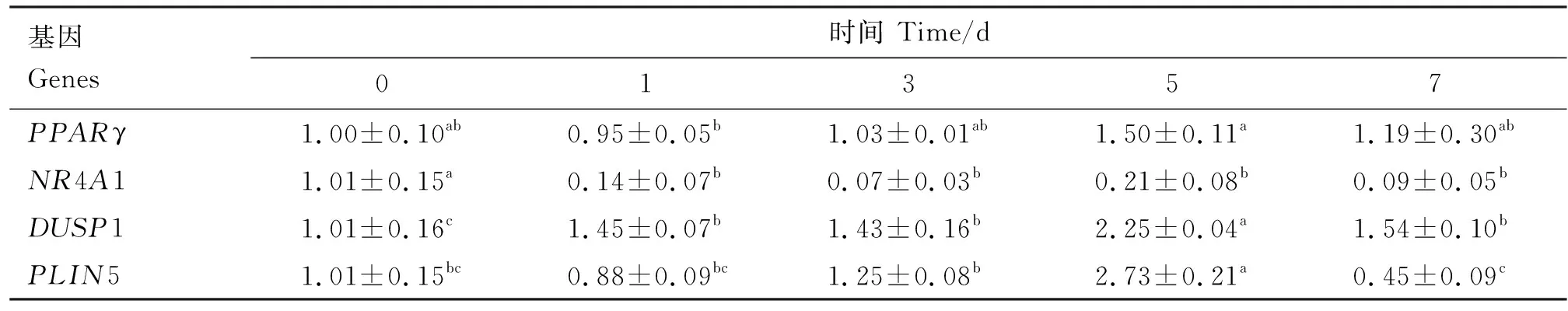
表6 成脂分化过程差异表达基因表达变化
3 讨 论
IMF是影响猪肉品质的主要因素之一,脂肪组织的形成是包括脂肪分解和脂肪生成的动态过程。本研究基于IMF含量差异较大的马身猪和大白猪的背最长肌转录组测序数据筛选差异表达基因,通过对差异表达基因进行GO功能和KEGG通路富集分析,筛选出与脂质代谢相关的基因,结合利用GeneCards对相关基因功能查询的结果,获得了TRAF2、DUSP1、NR4A1、SLC27A6、PLIN5和ACOT4共6个与脂肪沉积相关的基因。其中,NR4A1、DUSP1及PLIN5基因在马身猪和大白猪背最长肌中的表达量存在显著差异,而TRAF2、ACOT4和SLC27A6基因表达量在两品种间差异不显著,推测NR4A1、DUSP1及PLIN5基因是影响猪IMF沉积的候选基因。
NR4A1是NR4A亚家族成员,常作为转录因子参与相应基因的表达,也可与同家族成员NR4A2和NR4A3协同作用于细胞增殖、分化和代谢等过程[15-16]。NR4A1间接上调p53表达水平,抑制固醇调节元件结合转录因子1(sterol regulatory element binding transcription factor 1,SREBP1)及其下游脂肪生成相关酶脂肪酸合成酶(fatty acid synthase,FAS)、硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturease1,SCD1)和甘油-3-磷酸酰基转移酶线粒体(glycerol-3-phosphate acyltransferase mitochondrial,GPAM)的表达,降低机体TG含量[17],也可与GATA结合蛋白2(GATA binding protein 2,GATA2)直接互作抑制过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor gamma,PPARγ)表达,抑制脂肪细胞成脂分化[18]。赵伟明等[19]研究发现,安格斯牛背膘脂肪NR4A1基因表达量低于西门塔尔牛,而安格斯牛IMF含量显著高于西门塔尔牛,表明NR4A1基因表达量低有利于IMF沉积。本研究中,脂肪型猪种马身猪背最长肌中NR4A1基因表达量显著低于瘦肉型猪种大白猪,而马身猪IMF含量显著高于大白猪[13],说明NR4A1可抑制猪IMF沉积,与前人研究结果一致[17-19]。在脂肪前体细胞成脂分化过程中,随着成脂分化的进行,NR4A1基因表达量逐渐降低,进一步表明NR4A1基因对成脂分化起负调控作用。大白猪背部皮下脂肪组织中NR4A1基因表达量高于腹部皮下脂肪组织,而马身猪中呈相反趋势,可能与猪种的经济类型及不同部位脂肪组织的细胞组成及成脂机制有关,具体原因仍需进一步研究。
DUSP1作为磷酸酶,主要通过苏氨酸、酪氨酸残基选择性灭活胞外信号调节激酶(extracellular signal-regulated kinases,ERKs)、p38和c-Jun N-端激酶(c-Jun N-terminal kinases,JNKs)3种MAPK信号的活性[20]。相关研究表明,抑制ERK1/2磷酸化,能够促进PPARγ和CCAAT增强蛋白结合蛋白α(CCAAT enhancer binding protein alpha,CEBPα)的表达,促进TG和脂肪酸结合蛋白(fatty acid binding protein 2,Ap2)的积聚,正调控成脂分化过程[21]。但也有研究发现,ERK1/2信号在成脂分化过程中存在正负调控,p38信号也存在正负调控[22]。而以JNK为核心的JNKs信号被抑制后,成脂关键基因CEBPα转录活性升高,Ap2表达量增加,促进成脂分化过程[23]。Li等[24]研究发现,在高背脂和低背脂沂蒙黑猪肝脏中与氧化应激相关的DUSP1基因存在差异表达,而肝脏中的氧化应激能够调节脂质代谢,显著影响猪IMF沉积。本研究中,DUSP1基因在马身猪中的表达量低于大白猪,在大白猪背部和腹部皮下脂肪组织中的表达量存在显著性差异,而在马身猪两种脂肪组织中表达差异不显著,表明DUSP1基因的低表达有利于马身猪的脂质沉积,可将DUSP1作为影响脂质沉积的候选基因。但在肌内脂肪细胞成脂过程中,DUSP1基因表达呈明显上升趋势,这与活体表达情况不一致。DUSP1基因主要通过MAPK信号发挥功能,其对成脂过程的调控除了受遗传因素影响外,在个体水平还受年龄等因素影响,且在不同发育阶段功能不同,从而导致其在细胞和个体水平表达的不一致。
PLIN5是一种覆盖于细胞脂滴表面的磷蛋白,多分布于心脏、肝脏、棕色脂肪和骨骼肌等脂肪酸氧化代谢活跃的组织,调节相应组织的脂质代谢过程[25]。PLIN5作为关键脂滴蛋白受PPARγ调控,通过降低脂肪酸氧化或抑制TG脂解,促进机体内脂质的沉积[26-27]。在小鼠骨骼肌中,缺失PLIN5基因会导致氧化型肌纤维中的TG脂解,加快脂肪酸氧化速率;而过表达PLIN5基因后,肌细胞脂滴中TG含量增加[28]。同时,PLIN5也可通过调控线粒体生物合成和氧化相关基因的表达,促进TG水解[29]。Puig-Oliveras等[30]研究发现,在伊比利亚猪和长白猪背最长肌中PLIN5基因存在差异表达,且与肌肉脂肪酸代谢相关。本研究中,随着成脂分化的进行,PLIN5基因表达明显升高,与PLIN5基因促进脂质沉积的功能相一致。在相同饲养条件下,马身猪背最长肌和腹部皮下脂肪组织PLIN5基因表达量显著高于大白猪,也与马身猪成脂能力强的种质特性相吻合。此外,马身猪主要生活在山西北部高寒地区,温度较低,其机体线粒体生物合成与利用高于大白猪,这也有利于其生存和IMF沉积。众所周知,皮下脂肪与IMF的发育是相互独立的,皮下脂肪的过度沉积会导致肉品质降低,而IMF含量与肉品质呈正相关,本研究中PLIN5基因在马身猪背部皮下脂肪的表达量低于大白猪,这也可能是马身猪肉品质优于大白猪的原因之一。
本研究中,TRAF2、ACOT4和SLC27A6基因分别被注释到脂质代谢相关的GO和KEGG条目,但在2个品种猪背最长肌中表达量差异不显著。TRAF2主要通过激活细胞核因子κB(nuclear factor-kappa B,NF-κB)信号参与细胞的增殖、凋亡及免疫应答反应过程[31];ACOT4与磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)/葡萄糖转运蛋白4(glucose transporter 4,GLUT4)途径有关[32],表明TRAF2和ACOT4的主要功能对IMF沉积影响较小。SLC27A6主要参与机体内特定脂肪酸的转运[33]。Chen等[34]研究发现,在高大理石纹的牛背最长肌中SLC27A6基因表达水平较高,表明SLC27A6基因参与牛IMF沉积过程。本研究中,在2个品种猪背最长肌中SLC27A6基因表达量差异不显著,表明在不同物种中SLC27A6基因对脂肪沉积的调控可能存在差异。
4 结 论
本研究筛选到NR4A1、DUSP1及PLIN5 3个与猪脂肪沉积相关的候选基因,其中,马身猪NR4A1基因表达量显著低于大白猪,在脂肪细胞成脂分化过程中其表达量呈降低趋势,其对猪脂肪沉积有负调控作用;马身猪PLIN5基因表达量极显著高于大白猪,且在脂肪细胞成脂分化过程中PLIN5基因表达量呈上升趋势,其对猪脂肪沉积有促进作用;DUSP1基因在马身猪中的表达量极显著低于大白猪,而在脂肪细胞成脂分化过程中DUSP1基因表达量呈上升趋势,其对脂肪沉积的功能在活体和细胞上表现不同。

