利用表面增强拉曼光谱定量检测植物激素脱落酸
张燕燕 李灿 苏睿 李林泽 位文涛 李保磊 胡建东

摘要:植物激素脱落酸(Abscisic Acid ,ABA )在调控植物生长和发育方面具有重要作用。然而,ABA 在植物组织中含量较低,迫切需要快速灵敏的检测方法。本研究建立了一种基于适配体识别和表面增强拉曼光谱( Surface-Enhanced Raman Spectroscopy ,SERS )检测的 ABA 快速、定量检测方法。ABA 适配体修饰的纳米金颗粒兼具 SERS信号增强和选择性识别等特点,实现了复杂植物样品基质中痕量 ABA 的快速、灵敏检测。当 ABA 分子出现时,适配体将与 ABA 分子特异性结合,结合后的适配体折叠成 G-四聚体结构,将 ABA 分子包裹在四聚体结构内,拉近 ABA 分子与金纳米颗粒之间的距离,获得增强并稳定的 ABA 分子 SERS 信号。在适配体浓度优化的条件下,该方法检测限为0.1?mol/L ,线性相关系数 R2=0.9855,重复性相对标准偏差(Relative Standard Deviation ,RSD )≤6.71%,且 SERS 增强基底的稳定性良好(>6个月)。特别是,该方法用于小麦叶片中 ABA 的检测,检测结果与酶联免疫吸附剂测定(Enzyme Linked Immunosorbent Assay, ELISA )具有良好的吻合度(相对误差≤9.13%)。该研究为植物激素快速检测提供了有效的解决方案。
关键词:脱落酸;适配体识别;表面增强拉曼光谱;金纳米颗粒;生物传感器
中图分类号:Q946.885;O657.37 文献标志码:A 文章编号:SA202202001
引用格式:张燕燕, 李灿, 苏睿, 李林泽, 位文涛, 李保磊, 胡建东.利用表面增强拉曼光谱定量检测植物激素脱落酸[J].智慧农业(中英文), 2022, 4(1):121-129.
ZHANG Yanyan, LI Can, SU Rui, LI Linze, WEI Wentao, LI Baolei, HU Jiandong. Quantitative determination of plant hormone abscisic acid using surface enhanced Raman spectroscopy[J]. Smart Agriculture, 2022, 4(1):121-129.(in Chinese with English abstract)
1 引言
脫落酸( Abscisic Acid ,ABA )是小麦体内的一种内源激素,是小麦生长发育代谢产生的一种有机信号小分子,在极低浓度下,对小麦的生长具有显著的生理效应,在小麦生长过程中起着至关重要的作用[1]。小麦生长的不同阶段不同部位 ABA 的浓度含量不同,这直接关系到小麦种子的活力、抗倒伏能力、光合性能和抗旱性[2]。由于小麦的 ABA 浓度较低,大概在0.038~13.2 nmol/L [3],因此为了定量或监测不同发育期的 ABA 浓度,实时监测小麦的生长发育状况,恶劣环境对小麦生长的影响,灵敏快速的 ABA检测方法非常重要。
截至目前,用于 ABA 的检测技术主要有比色法( Colorimetric Method )[4]、局部表面等离子体共振 ( Local Surface Plasmon Resonance, LSPR )[5]、高效液相色谱仪(High Performance Liquid Chromatography , HPLC )[6]、电化学法( Electrochemical Method )等[7]。这些方法虽然具有足够的准确性,但仍存在样品前处理繁琐、检测成本高、时间长、需要专业操作人员等缺点[8]。因此,有必要建立一种简单、高灵敏度的植物样品中 ABA的微量检测方法。
表面增强拉曼光谱( Surface-Enhanced Ra‐ man Spectroscopy , SERS )是一种强大的分子振动光谱技术,它可以提供目标分子的特定指纹信息[9-12]。随着传感技术与激光技术的发展,SERS 技术已广泛应用于化学分析[13-15]、生物医学成像[16]、环境和食品检测[17]等领域。然而,由于 SERS 产生“热点”的波动,定量的 SERS 仍面临一些挑战。产生均匀热点的关键在于利用纳米金或银基底尽可能稳定地增强 SERS信号,除了可以通过合成高质量的贵金属纳米颗粒以外,借助于对分析物分子有特殊捕获能力的抗体或者适配体来增强拉曼信号的方法也越发常见[18]。Man 等[19]构建了一个通用的生物分子检测平台,将Schizotype适配体与光诱导增强拉曼光谱效应相结合,用于超灵敏检测三磷酸腺苷、可卡因和凝血酶。该研究表明适配体在生物传感方面可以代替抗体来捕获目标分子,适配体结合 SERS方法具有较高的灵敏度。Hu等[5]利用适配体结合局域表面等离子共振 ( Localized Surface Plasmon Resonance ,LSPR )的方法对 ABA进行了定量研究,结果证明,ABA 的适配体对 ABA 分子有较好的识别能力,可以作为构建 ABA 生物传感器的识别单元。另外,利用 SERS法对 ABA的定量研究还处于起步阶段,目前还未发现 SERS方法结合适配体的相关文献。
当检测体系中有脱落酸存在时,适配体与脱落酸分子特异性结合,适配体的构象转变为 G四聚体样结构,将 ABA 分子包裹在四聚体结构之间,拉近并固定脱落酸分子与纳米金颗粒之间的距离,使得脱落酸分子的拉曼信号强度稳定且增加。基于这一原理,本研究主要以基于 SERS的植物激素 ABA定量检测生物传感器为研究对象,以纳米金粒子作为拉曼探针,适配体作为捕获探针修饰在纳米金颗粒上,构建了一种灵敏、快速的适配体传感器并实现对植物激素 ABA 定量检测。
2 材料与试验方法
2.1材料和仪器
本试验所用的四氯金酸四水合物( HAuCl4·4H2O )、硝酸银(AgNO3)、 L-抗坏血酸( AA )购买于阿拉丁试剂有公司(中国上海);脱落酸粉末( ABA )、柠檬酸二水合钠 ( C6H5Na3O7·2H2O )、聚乙二醇山梨糖单月金酸酯( Tween20)购自 Sigma-Aldrich (美国)。试验中 ABA溶液的配置需要注意,分析天平取0.264 g的 ABA 粉末用0.5 mL 的无水乙醇完全融化,加水定容至10 mL作为母液,密封冷藏;定容后 ABA溶液的浓度为100 mmol/L ,试验中使用的 ABA 溶液采用母液加水稀释到使用浓度。脱落酸适配体购买于生工生物工程(上海)股份有限公司,序列号为: HS-5'-ATG GGT TAG GTG GAG GTG GTT ATT CCG GGA ATT CGC CCT AAA TAC GAG CAA C-3'[20]。所有溶液制剂均采用超纯水,使用的玻璃器皿均采用王水[ HCl:HNO3=3:1(v/v)] 清洗,试验前用超纯水多次冲洗。
合成纳米金颗粒的紫外-可见光谱用紫外可见分光光度计(南京菲勒仪器有限公司,南京,中国)记录。利用透射电子显微镜( JEOL JEM-1400 Plus ,Tokyo ,Japan)在120 kV加速电压下获得纳米金颗粒的透射电子显微镜( Transmis‐sion Electron Microscope , TEM )图像。离心前用0.05% TWeen20溶液冲洗所有离心管,以防止纳米颗粒吸附在管壁上。SERS 信号由共焦拉曼显微系统(先锋科技有限公司,北京,中国)采集。
2.2纳米金颗粒合成
将装有100 mL 、0.01%氯金酸溶液的锥形烧杯置于磁力加热搅拌器上,轻轻搅拌,加热温度设置为120°C 。溶液煮沸后,调节搅拌器为剧烈搅拌模式,同时快速加入1 mL 、1%的柠檬酸三钠溶液,10 s 后溶液的颜色依次变色为灰、黑、蓝,最后逐渐稳定在紫红色, 10 min 后关闭热源,继续搅拌溶液至室温,冰箱冷藏待进一步利用。
2.3适配体修饰纳米金颗粒
将 ABA 适配体包裹在纳米金颗粒表面制备捕获探针。将浓度为0.12μmol/L ,3μL 活化后的巯基适配体 SH-Apt 加入到3 mL Au NPs 溶液中,室温(25℃)孵育12 h 。以10,000 r/m离心10 min 去除未结合的适配体,将沉淀物分散在3 mL的超纯水中备用。
2.4适配体浓度优化
核酸适配体浓度的大小与捕捉到 ABA 分子的多少以及检测灵敏度、检测限密切相关,因此,研究了适配体浓度分别在0.04、0.08、0.12和0.16μmol/L , ABA 的浓度分别在1、5 和10 mmol/L 的条件下, ABA 拉曼光谱强度的变化,从而优化出最佳的适配体浓度。
2.5 ABA 检测
以适配体修饰的纳米金颗粒为表面增强拉曼的活性捕获基底检测来 ABA ,将50μL不同浓度的 ABA 溶液(1×10?7~1×10?4 mol/L )与50μL 的适配体修饰的纳米金颗粒溶液混匀静置30 min 后,将10μL的混合物滴在干净的硅片上,室温干燥后进行 SERS检测。拉曼仪器入射激光的功率设置为65 mW,曝光时间为10 s 。SERS 信號由共焦拉曼显微系统(先锋科技有限公司,北京,中国)采集。拉曼系统包括一个高稳定的暗场显微镜( BX41,奥林巴斯,美国),一个共焦拉曼模块和一个配备 CCD (1024×256像素传感器,德国)的高分辨率光谱仪(安道尔科技,英国)。本研究中所有的拉曼光谱均在532nm激光辐射的10倍物镜下采集。
2.6方法验证
使用适配体 SERS传感器检测 ABA的真实样品并与 ELISA 检测结果做对比。ABA 的真实样品提取方法为:取新鲜冻干的小麦叶片1.0 g ,液氮研磨后,用2 mL甲醇-水-甲酸(15:4:1,v/v/v)超声提取20 min 后放入冰箱冷冻避光24 h ,在4℃条件下10,000 r/min离心10 min ,取上清液于4 mL 棕色瓶中避光;再次用1 mL 甲醇-水-甲酸重复提取2次,合并上清液,30℃条件下减压蒸发致干,用 500μL 甲醇-水-乙酸(1800:200:1,v/v/v)复溶,4℃条件下10,000 r/min离心10 min后取上清液,待用。
3 结果与讨论
3.1检测原理
利用 SERS结合适配体修饰的纳米金颗粒检测植物激素脱落酸的原理如图1所示,将纳米金颗粒上修饰植物激素脱落酸的巯基适配体( SH-Apt),巯基适配体与纳米金颗粒之间形成Au-S 共价键结合。结合在纳米金颗粒外部的适配体随意自然伸长。当体系中有脱落酸存在时,任意分布的脱落酸适配体与 ABA 结合,伸长的适配体随即折叠为 G 四聚体,将 ABA 分子包围在 G 四聚体中间,这时 ABA 与纳米金颗粒之间的距离拉近并且距离固定,ABA 分子不会随意从纳米金颗粒上脱落下来。离心后,将含有ABA 分子的纳米金颗粒溶液进行拉曼检测,由于 ABA 分子与纳米金颗粒之间距离固定,那么ABA分子所产生的 SERS信号也将稳定,从而建立 ABA的浓度与 SERS强度之间的定量关系。
3.2纳米金颗粒的表征
合成的纳米金颗粒的 TEM 图像如图2(a)所示,从 TEM 图中可知,合成的纳米金颗粒大小一致,分布均匀,且紫外可见峰位于525 nm 左右,峰曲线窄而光滑,说明纳米金颗粒的大小均匀。结合图2(b)可知纳米金颗粒的平均粒径在60nm左右。
3.3适配体修饰纳米金颗粒表征
将合成的纳米金颗粒做 zeta 电势表征,如图3所示。柠檬酸三钠还原的氯金酸溶液生成的纳米金颗粒中含有带负电的柠檬酸根离子,所以纳米金颗粒带负电。Zeta电势表征纳米金颗粒的电势为-26 mW,带巯基的适配体带正电,将适配体修饰在纳米金颗粒上之后,电势为-10.7 mW,说明适配体成功修饰在纳米金颗粒之上。
3.4适配体浓度优化
当 ABA溶液的浓度分别为1、5和10 mmol/L时,未结合适配体的裸金作为增强基底测得的 ABA溶液的 SERS强度平均值分别为1000、1400和2500。当 ABA 的浓度为1 mmol/L时,不同浓度的适配体修饰金纳米颗粒后作为增强基底测得的 SERS强度的平均值分别为1400、2000、4500和2800;当 ABA 的浓度为5 mmol/L时,不同浓度适配体修饰纳米金颗粒后作为增强基底测得的SERS强度的平均值分别为2030、3500、6020和4480;当 ABA的浓度为10 mmol/L时,不同浓度适配体修饰纳米金颗粒后作为增强基底测得的SERS强度的平均值分别为2520、4680、6120和6300。将不同浓度的核酸适配体修饰纳米金颗粒后结合 ABA分子所得的 SERS强度与未修饰适配体的纳米金颗粒作为增强基底所得的 SERS强度比值做图(图4)。
由图4可见,含有适配体的增强基底所测 SERS 值与不含适配体的裸金基底所测 SERS 值的比值逐渐增大,说明随着适配体浓度的增大,捕获的 ABA 分子增多,相应的 SERS 信号增强。当适配体浓度达到0.12?mol/L 时,含有适配体的增强基底所测 SERS值与不含适配体裸金基底所测 SERS值的比值达到最大。当适配体浓度达到0.16?mol/L 时,比值却减小,说明随着适配体浓度的进一步增大,捕获的 ABA 分子却没有增多,相应的 SERS信号也没有增强。这是因为当适配体的浓度大于0.12?mol/L 时,体系中存在多余的适配体会竞争系统中的 ABA 分子,导致结合在纳米金颗粒上的 ABA 分子减少,从而 SERS 强度降低。因此,本试验需用最佳的核酸适配体浓度为0.12?mol/L。
3.5 ABA 的检测
为确认 ABA 拉曼峰的位置,取购买的 ABA 粉末在没有增强的情况下的直接采集其拉曼光谱,图5为 ABA 粉末的拉曼光谱及 ABA 的分子结构。可见 ABA分子信号较强的拉曼峰有4个,分别是1637、1237、1050、615 cm-1,分别对应于 ABA 分子结构中碳碳双键的伸缩振动、碳碳单键的伸缩振动、甲基的非平面摆动、碳碳单键的外扭式振动[21]。 1637 cm-1相对于其他特征峰相对较强,结合 ABA 分子的结构,1637 cm-1主要来自于碳碳双键和碳碳单键的运动[22],其中碳碳双键的伸缩振动引起的拉曼散射最为剧烈,所以1637 cm-1可以作为 ABA 的拉曼特征峰用于植物激素 ABA的定性和定量检测。
将不同浓度的 ABA 标准溶液与适配体修饰的纳米金颗粒混合后,滴在硅片上干燥后进行SERS检测,检测光谱结果如图6(a)所示。此检测方法可以用来检测 ABA的浓度,当 ABA的浓度为0.1μmol/L 时,也可以很清楚得看到1637 cm-1的特征峰,说明适配体修饰的纳米金颗粒具有很好的检测灵敏度。将 ABA 的浓度与1637 cm-1特征峰处的 SERS强度作出线性关系如图6(b)所示,在0.1~100μmol/L 范围内,R2=0.9855。
3.6重复性试验
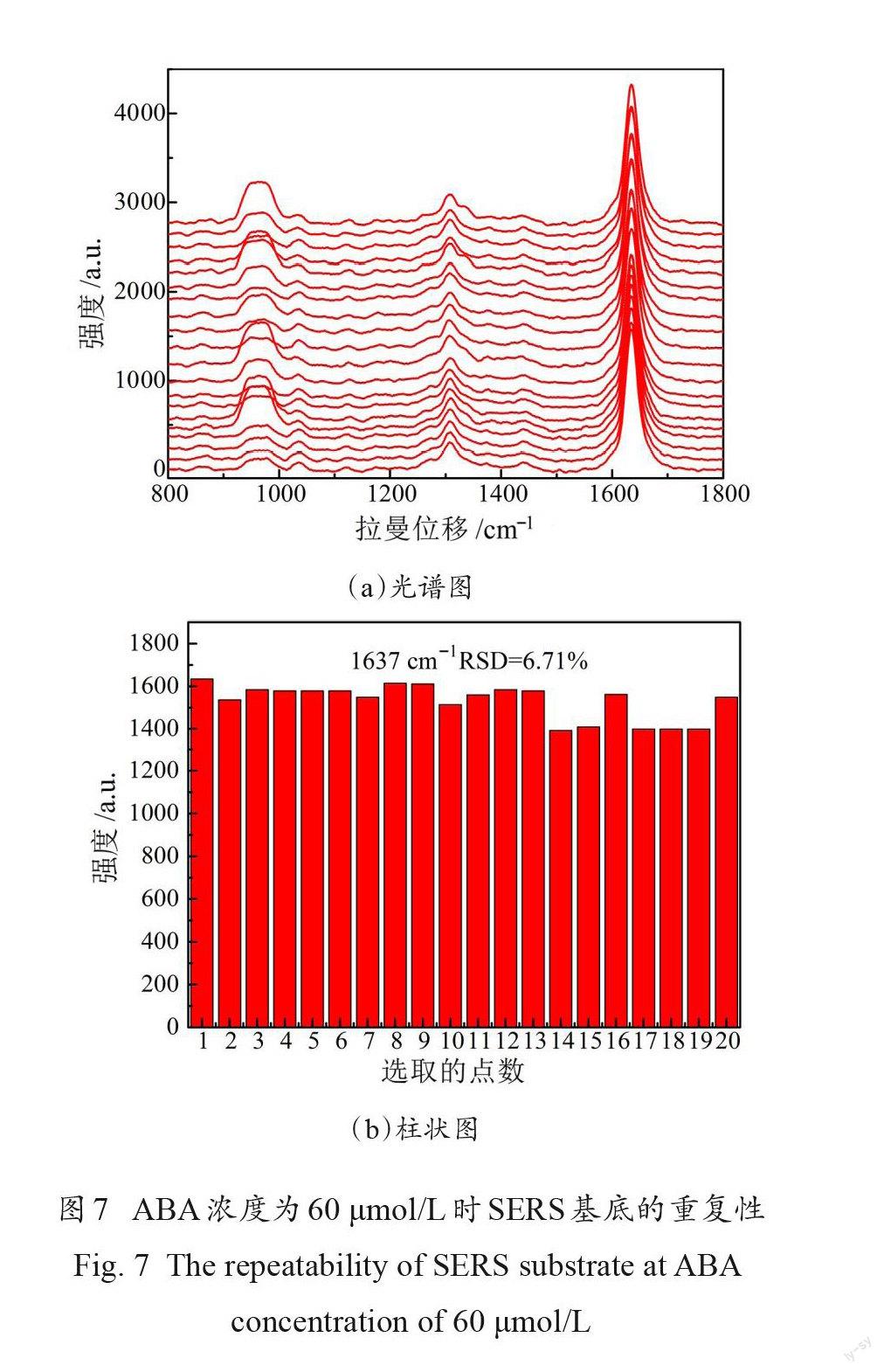
增强基底的重现性是 SERS检测的关键,因此,研究了 SERS信号的重复性。在 ABA浓度为60μmol/L 條件下,随机在基底上取20个点的SERS强度作为研究对象。在1637 cm-1处的20个随机点的拉曼强度在1575到1608之间波动,拉曼光谱图如图7(a)所示,相应的柱状图如图7(b)所示,相对标准偏差( Relative Stan-dard Deviation , RSD )值为6.71%。一般认为,一个新的或现有的 SERS定量测量体系的重现性 RSD 应小于20%[23]。说明该适配体修饰的纳米金颗粒 SERS生物传感器可作为定量测量脱落酸含量的一种分析方法,且为后期研发更为灵敏的、特异性更强的 SERS生物传感器奠定基础。
3.7增强基底稳定性试验
纳米颗粒增强基底的稳定性是适配体 SERS 传感器能够用于实际检测的关键,因此,对纳米颗粒的稳定性进行试验。制备好的适配体修饰的纳米金颗粒在冰箱里4℃保存,分别在1、3、6和8个月后检测其紫外可见光谱。如图8(a)可知,适配体修饰的纳米金颗粒在放置1个月和3个月时,LSPR 峰的位置几乎不变,只是吸光度相应降低。在放置6个月之后,LSPR 峰发生红移,但是移动量很小,且吸光度值也发生减小。
但是放置8个月之后,适配体修饰的纳米金颗粒的 LSPR峰继续红移,紫外可见光谱变宽,说明纳米金颗粒可能有一定程度聚集。
将放置不同时间的适配体修饰的纳米金颗粒作为增强基底检测10 mmol/L的脱落酸溶液,检测结果如8(b)所示。在放置1个月时,ABA的SERS 强度几乎不变;放置3个月时, ABA 的SERS 强度减小很小,大约为初始值的96%;放置6个月时,所测得的 ABA 强度的平均值为5000,大约是初始值的70%;放置8个月时,ABA的 SERS强度跟没有修饰适配体的纳米金颗粒的增强性差不多,大约为初始值的50%。由此可知,适配体修饰的纳米金颗粒作为增强基底检测脱落酸具有较长的保质期,其稳定性超过6个月。
3.8真实样品检测
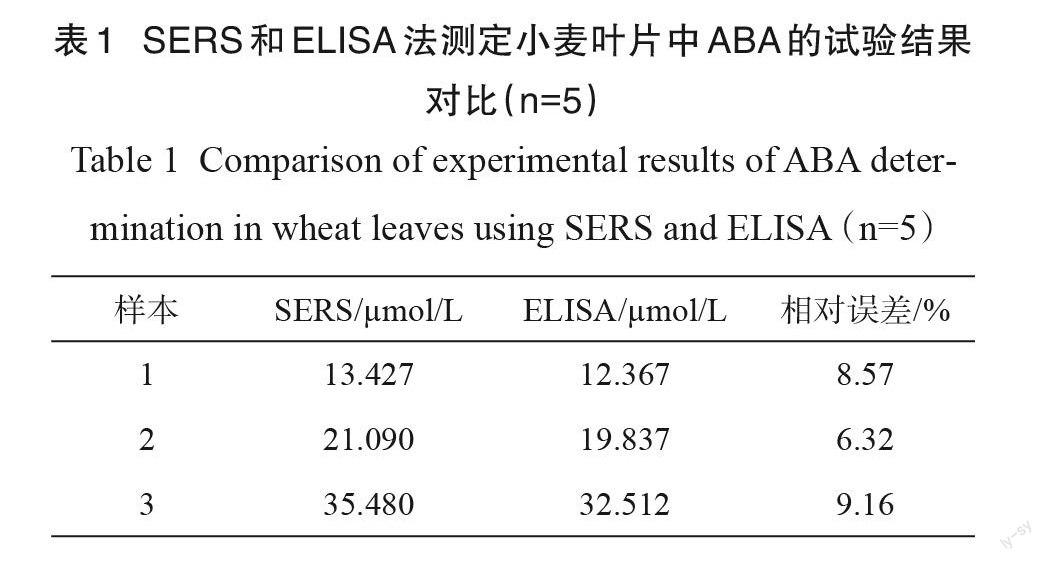
为验证所构建的 SERS传感器对真实样品的检测能力,提取成熟期小麦叶片中的 ABA ,对提取液中 ABA 含量进行检测,并将其检测结果与酶联免疫吸附测定(Enzyme Linked Immuno‐ sorbent Assay ,ELISA )检测结果进行对比分析,对比结果如表1所示。将 ELISA 法与 SERS 法进行比较,ABA含量的最大相对误差为9.16%,说明两种方法测试的结果具有一致性。
4 結论
合成高质量的纳米金颗粒,对纳米金颗粒进行紫外和 TEM 表征。在纳米金颗粒上修饰 ABA 的巯基适配体作为 SERS 基底对 ABA 进行检测,适配体与纳米金颗粒之间形成 Au-S共价键结合。
优化适配体的浓度为0.12?mol/L ,在优化的条件下,该生物传感器对 ABA 的检测浓度可达0.1μmol/L ,在0.1~100μmol/L 范围内,R2=0.9925,说明该方法的灵敏度较好。对基底上随机选取的20个点进行基底的重现性分析,其RSD 值为6.71%,说明该基底的信号重现性较好。另外,该适配体修饰的纳米金颗粒具有良好的稳定性,其寿命超过6个月。最后,提取 ABA的真样样品,利用该方法对 ABA真实样品试验,并与 ELISA检测结果相对比,检测结果最大相对误差为9.16%。
该生物传感器是利用 SERS对植物激素检测的探索性研究,研究的结果将对 ABA 的后续定量和现场检测,以及其他植物激素的检测具有重要的参考价值。
参考文献:
[1] ZHOU Q, ZHANG F, JI S, et al. Abscisic acid acceler‐ates postharvest blueberry fruit softening by promotingcell wall metabolism[J]. Hortic-Amsterdam, 2021,288: ID 110325.
[2] SHIBATA M, COELHO C, GARIGHAN D, et al. Seeddevelopment of Araucaria angustifolia: Plant hormonesand germin ability in 2 years of seeds production[J].New Forests, 2021, 52(5):759-775.
[3] SIRKO A, WAWRZYNSKA A, BRZYWCZY J, et al.Control of ABA signaling and crosstalk with other hor‐mones by the selective degradation of pathway compo‐nents[J]. International Journal of Molecular Sciences,2021, 22(9): ID 4638.
[4] ZHOU G, LUO Y, XU Q, et al. Peptide-capped goldnanoparticle for colorimetric immunoassay of conjugat‐ed abscisic acid[J]. Acs Applied Materials Interfaces,2021, 4(9):5010-5015.
[5] WANG S, ZHANG H, ZEPHANIA B, et al. A multi-channel localized surface plasmon resonance system for absorptiometric determination of abscisic acid by using gold nanoparticles functionalized with a polyade‐ nine-tailed aptamer[J]. Microchimica Acta, 2020, 187(1): ID 20.
[6] YAN S, GUO L, WU C, et al. Simultaneous determina‐tion of three kinds of endogenous hormones content in seeds of post-harvest Yali pear by high performance liquid chromatography[J]. Chinese Journal of Analyti‐cal Chemistry, 2010, 38(6):843-847.
[7] LI Y, XIA K, WANG R, et al. An impedance immuno‐sensor for the detection of the phytohormone abscisic acid[J]. Analytical and Bioanalytical Chemistry, 2008, 391(8):2869-2874.
[8] FU J, SUN X, WANG J, et al. Progress in quantitativeanalysis of plant hormones[J]. Chinese Science Bulle‐ tin, 2011, 56(4-5):355-366.
[9] WANG P, SUN Y, LI X, et al. Recent advances in met‐al organic frameworks based surface enhanced Raman scattering substrates: Synthesis and applications[J]. Molecules, 3021, 26(1): ID 209.
[10] DE SOUZA M, OTERO J, LOPEZ-TOCON I. Com ‐parative performance of citrate, borohydride, hydroxyl‐ amine and beta-cyclodextrin silver sols for detecting ibuprofen and caffeine pollutants by means of surface- enhanced Raman spectroscopy[J]. Nanoterials, 2020, 10(12): ID 2339.
[11] MOSKOVITS M. Surface roughness and the enhancedintensity of Raman scattering by molecules adsorbed on metals[J]. Journal of Physics and Chemistry of Sol‐ ids, 1978, 69(4):4159-4162.
[12] MOSKOVITS M. How the localized surface plasmonbecame linked with surface-enhanced Raman spectros‐ copy[J]. Notes and Records of the Royal Society, 2012, 66(2):195-203.
[13] PETTINGER B, WENNING U, WETZEL H. Surfaceplasmon enhanced Raman scattering frequency and an‐ gular resonance of Raman scattered light from Pyridine on Au, Ag and Cu electrodes[J]. Surface Science, 1980, 101(1-3):409-416.
[14] BOYACK R, LE RU E. Investigation of particle shapeand size effects in SERS using T-matrix calcula‐tions[J]. Physical Chemistry Chemical Physics, 2009,11(34):7395-7405.
[15] QU L, GENG Y, BAO Z, et al. Silver nanoparticles oncotton swabs for improved surface-enhanced Ramanscattering, and its application to the detection of carba‐ryl [J]. Microchimica Acta, 2016, 183(4):1307-1313.
[16] LIU J, WHITE I, DEVOE D. Nanoparticle-functional‐ized porous polymer monolith detection elements forsurface-enhanced Raman scattering[J]. AnalyticalChemistry, 2011, 83(6):2119-2124.
[17] MAKAM P, SHILPA R, KANDJANI A, et al. SERSand fluorescence-based ultrasensitive detection of mer‐cury in water[J]. Biosensors Bioelectronics, 2018, 100:556-564.
[18] LI J, ZHANG Y, DING S, et al. Core-shell nanoparti‐cle-enhanced Raman spectroscopy[J]. Chemical Re‐views, 2017, 117(7):5002-5069.
[19] MAN T, LAI W, XIAO M, et al. A versatile biomolecu‐lar detection platform based on photo-induced en‐hanced Raman spectroscopy[J]. Biosensors Bioelec‐tronics, 2019, 147: ID 111742.
[20] GROZIO A, GONZALEZ V, MILLO E, et al. Selec‐tion and characterization of single stranded DNA ap‐tamers for the hormone abscisic acid[J]. Nucleic AcidTherapeutics, 2012, 23(5):322-331.
[21]張燕燕, 李冬贤, 马刘正, 等.植物激素脱落酸分子的光谱与结构研究:理论与实验[J].光谱学与光谱分析, 2021, 41(9):2859-2865.
ZHANG Y, LI D, MA L, et al. Spectroscopic and struc‐tural studies of plant hormone abscisic acid molecules:Theory and experiment[J]. Spectroscopy and SpectralAnalysis, 2021, 41(9):2859-2865.
[22] ZHANG Y, ZHANG H, LI D, et al. Surface-enhancedRaman spectroscopy for the quantitative detection ofabscisic acid in wheat leaves using silver coated goldnanocomposites[J]. Spectroscopy Letters, 2021, 54(10):732-741.
[23] ZHOU Z, XIAO R, CHENG S, et al. A universalSERS-label immunoassay for pathogen bacteria detec‐tion based on Fe3O4@Au-aptamer separation and anti‐body-protein a orientation recognition[J]. AnalyticalChimica Acta, 2021, 1160: ID 338421.
Quantitative Determination of Plant Hormone Abscisic Acid Using Surface Enhanced Raman Spectroscopy
ZHANG Yanyan1,2 , LI Can1,2 , SU Rui1,2 , LI Linze1,2 , WEI Wentao1,2 ,LI Baolei1,2 , HU Jiandong1,2,3*
(1. College of Mechanical and Electrical Engineering, Henan Agricultural University, Zhengzhou 450002, China;
2. Henan International Joint Laboratory of Agricultural Laser Technology, Zhengzhou 450002, China;
3. State Key Laboratory of Wheat and Corn Crop Science, Zhengzhou 450002, China )
Abstract: Plant hormone Abscisic Acid (ABA) plays an important role in regulating plant growth. However, the content of ABA in plant tissues is very low, and rapid and sensitive detection methods are urgently needed. In this study, a rapid and quantitative ABA detection method was established based on aptamer recognition and surface-enhanced Raman spectroscop (SERS). The gold nanoparticles modified by ABA aptamer had the characteristics of SERS signal enhancement and selective recognition, re‐alizing the rapid and sensitive detection of trace ABA in complex plant sample matrix. When ABA molecules appeared in detect system, the aptamer would specifically bind with ABA molecules, and the aptamer folded into G-tetrad structure at same time, which wrapped ABA molecules in the tetrad structure, shortened the distance between ABA molecules and gold nanoparticles, and the enhanced and stable ABA molecules SERS signal were obtained. Under the condition of optimized aptamer concentra‐tion at 0.12?mol/L, different concentrations of ABA solutions in the detection system were detected. Within the concentration range of 0.1-100?mol/L, the SERS intensity of ABA presented a good linear relationship with the concentration. The detec‐tion limit of this method was 0.1?mol/L and the linear correlation coefficient R2 was 0.9855. The repeatability test of 20 points randomly on SERS substrate showed that the relative standard deviation (RSD) was 6.71%, indicating the stability of SERS sub‐strate was well. Furthermore, the substrate of gold nanoparticles modified by the ABA aptamer terminal with sulfhydryl group (SH-Apt) could be stored in the refrigerator for more than half a year, indicating that the substrate has good stability. Once the preparation of the synthesized SH-Apt modified gold nanoparticles was completed. It could be used on demand without the need to prepare SERS substrate for every detection. In this sense, the constructed aptamer SERS biosensor could realize the rap‐ id and quantitative detection of ABA. The method was used for the determination of ABA in wheat leaves, and the result was in good agreement with the Enzyme Linked Immunosorbent Assay (ELISA)(The max relative error was 9.13%). This biosensor is an exploratory study on the detection of plant hormones by SERS, and the results of the study will have important reference val‐ue for the subsequent quantitative and on-site detection of ABA, as well as the detection of other plant hormones.
Key words: abscisic acid; aptamer recognition; surface-enhanced Raman spectroscopy; gold nanoparticles; biosensor

